探针导向重组酶介导等温扩增法检测MTB rpoB基因突变的应用价值
2020-06-13李鑫娜申辛欣王瑞白段素霞张瑞卿王瑞欢白雪丁凡国豪王金荣高源陈子巍马学军
李鑫娜 申辛欣 王瑞白 段素霞 张瑞卿 王瑞欢 白雪丁 凡国豪 王金荣 高源 陈子巍 马学军
利福平作为一线抗结核药物,主要通过与细菌的RNA聚合酶的β亚单位结合,干扰细菌的RNA转录,从而发挥杀菌作用。编码RNA聚合酶β亚单位的基因(rpoB基因)中有一段长81 bp的利福平耐药决定区(rifampin resistance-determining region, RRDR;密码子507~533,共27个氨基酸),超过95%的利福平耐药MTB菌株在该区域内发生突变,而密码子516、526和531是最常见的突变位点[1]。
目前,核酸检测技术更迭迅速,使得MTB分子生物学药物敏感性试验(简称“药敏试验”)技术发展迅速,例如,聚合酶链反应-单链构象多态性方法(PCR-SSCP)[2]、荧光定量PCR方法[3]、高分辨率熔解曲线法[4-5]、反向探针杂交方法[6]、基因芯片技术[7-8]等。这些方法和技术虽结果准确,但需要专业人员进行操作,且实验对仪器设备依赖性较高,需要高精密仪器。重组酶介导等温扩增法(recombinase aided amplification, RAA)是一种适合现场和基层的等温核酸扩增方法。该方法操作简便,可利用便携式仪器快速进行病原微生物检测[9-10]。笔者实验室曾建立探针导向的重组酶介导的等温扩增法(probe-directed recombinase amplification,PDRA),并成功应用于5,10-亚甲基四氢叶酸还原酶(MTHFR)A1298C的单核苷酸多态性(SNP)位点检测[11]。本研究中,笔者拟探究采用PDRA方法检测MTB的rpoB基因516位点突变的应用价值。
材料和方法
1.菌株来源:6株MTB利福平耐药菌株、35份MTB培养阳性的痰标本均来自中国疾病预防控制中心传染病所结核病室。
2.细菌基因组制备:采用十六烷基三乙基溴化铵(CTAB)方法进行细菌基因组提取[12]。方法简述如下:80 ℃灭活30 min,离心弃上清,菌体沉淀用400 μl TE缓冲液旋起,加入溶菌酶,37 ℃孵育16~20 h。加入10% 十二烷基硫酸钠(SDS)/蛋白酶K混合液,65 ℃孵育10 min,加入氯化钠(NaCl)和CTAB/NaCl混合液,65 ℃孵育10 min,加入氯仿/异戊醇混合液,离心并转移上清,加入0.6倍体积异丙醇以沉淀DNA,-20 ℃放置30 min,离心弃上清,用1 ml 70%冰乙醇洗涤DNA沉淀;离心并且干燥,用TE缓冲液溶解DNA。
3.标准质粒制备:质粒合成由北京擎科生物技术有限公司完成,包括1种野生型(TB-516-GAC,即TB-516-W)和3种516位点单点突变型(TB-516-GGC突变、TB-516-GTC突变、TB-516-TAC突变)。片段长度为960 bp的rpoB基因,其中包含81 bp 的RRDR决定区。
4.仪器与试剂:RAA 荧光检测仪QT-7200、RAA荧光基础试剂盒均购自江苏奇天基因生物科技有限公司,引物和探针由生工生物工程(上海)股份有限公司合成。
5.引物和探针设计:通过NCBI下载rpoB基因序列,在516位点附近设计探针和引物,避免出现二级结构及形成引物二聚体。设计1条野生型探针、3条突变型探针、1条反向引物。探针长46~52个碱基,3′端采用C3-spacer阻断,荧光基团和淬灭基团标记在中间相邻近的T碱基上,突变点位于四氢呋喃(THF)的5′端。具体序列见表1。
6.PDRA 扩增体系及条件:参照文献[11],516位点常见突变包括3种类型(GGC、GTC、TAC),需配制4种反应体系,分别检测野生型及3种突变型。4种检测体系的引物组成如下:TB-516-W检测体系为P-W和R,TB-516-GGC检测体系为P-GGC和R,TB-516-GTC检测体系为P-GTC和R,TB-516-TAC检测体系为P-TAC和R。以TB-516-W检测体系为例,总体积50 μl,包括300 nmol/L正向探针(P-W),420 nmol/L反向引物(R)以及1×缓冲液。向装有干粉的反应管中加入上述混合液和2 μl模板DNA,并将2.5 μl醋酸镁(280 mmol/L)加入管盖内,盖上管盖,混匀离心使醋酸镁进入扩增体系。其他检测体系配制同上,只需进行探针替换即可。将上述反应管放入QT-7200荧光检测仪中,39 ℃反应40 min,实时收集荧光。通过比较检测样品在4种反应体系的扩增时间差异来判断是否发生突变及突变类型。

表1 PDRA方法的探针及引物
注标注下划线的碱基为516突变点
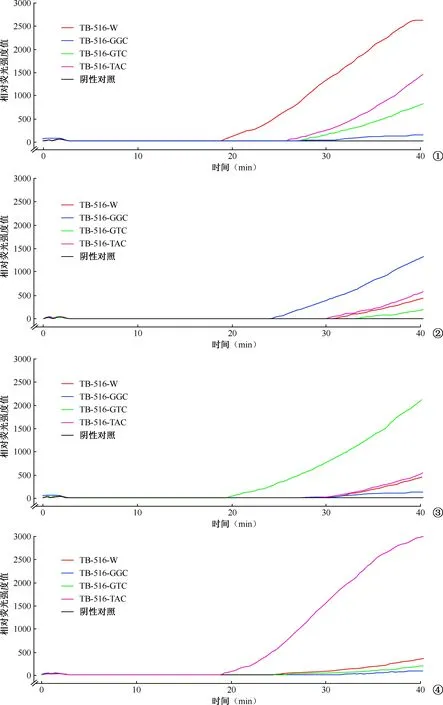
图1~4 PDRA方法特异度检测。图1为4种检测体系分别扩增2×105拷贝野生型质粒情况,可见TB-516-W体系的阳性阈值时间早于其他体系。 图2为4种检测体系分别扩增2×105拷贝 TB-516-GGC突变型质粒情况,可见TB-516-GGC体系的阳性阈值时间早于其他体系的阳性阈值时间。图3为4种检测体系分别扩增2×105拷贝 TB-516-GTC突变型质粒情况,可见TB-516-GTC 体系的阳性阈值时间早于其他体系的阳性阈值时间。图4为4种检测体系分别扩增2×105拷贝 TB-516-TAC突变型质粒情况,可见TB-516-TAC体系的阳性阈值时间明显早于其他体系的阳性阈值时间

图5~8 PDRA方法敏感度检测。图5为TB-516-W体系检测1010~103拷贝/μl野生型质粒。图6为TB-516-GGC体系检测1010~103拷贝/μl TB-516-GGC突变型质粒。图7为TB-516-GTC体系检测1010~103拷贝/μl TB-516-GTC突变型质粒。图8为TB-516-TAC体系检测1010~103拷贝/μl TB-516-TAC突变型质粒
7.PDRA方法的特异度和敏感度检测:4种类型的质粒,包括一种野生型和3种突变型质粒,作为模板进行特异度实验;分别将质粒10倍稀释为1×1010~1×103拷贝/μl用以敏感度检测实验,以无核酶水作为阴性对照,重复3次独立实验并记录实验结果,以3次均可检测出的最低拷贝数浓度作为检测敏感度。
8.方法测试:(1)菌株测试:对MTB利福平耐药菌株,采用CTAB法提取基因组,经PCR后进行测序[13],同时用本研究建立的检测516位点的PDRA方法进行测试。(2)临床标本测试:经培养后的痰液临床标本,采用CTAB法提取基因组,经PCR后进行测序[13],并且进行516位点的PDRA方法测试。
结 果
1.PDRA方法特异度:通过4种检测体系分别检测4种不同类型的质粒,只有检测探针与检测模板完全匹配的检测体系,阳性阈值时间最早,相对荧光强度值最高;而其他扩增体系的阳性阈值时间滞后或者荧光值低。图1~4显示了4种检测体系检测2×105拷贝质粒的情况。当检测体系的探针与模板为相互对应关系时,阳性阈值时间最早;当检测体系的探针与模板不是对应关系时,则表现为阳性阈值时间滞后。检测体系TB-516-W、TB-516-GGC、TB-516-GTC和TB-516-TAC的阳性阈值时间差值分别为7.0、5.8、10.0、7.0 min。4种检测体系稳定,在检测不同浓度的模板时,拥有相对稳定的阳性阈值时间及时间差值。
2.PDRA方法敏感度:4种检测体系分别检测对应类型的质粒DNA(1010~103拷贝/μl),从而确定PDRA方法的敏感度,如图5~8所示,在40 min内,4种检测体系的敏感度均可达到1000拷贝/μl。
3.菌株测试结果:采用PDRA法及测序法检测6株利福平耐药MTB,6株MTB经测序后发现有3株发生516位点突变,3株发生526位点突变,1株发生531位点突变,其中1株发生了双位点突变(菌株T5),PDRA方法检测各菌株516位点的结果与预期结果一致,可正确区分是否发生516位点突变,并且可确定516位点突变类型。具体表现为516位点突变的菌株,PDRA检测结果显示突变型体系阳性阈值时间早于野生型体系,而突变类型不同,则对应体系的阳性阈值时间更早(图9~11);而对于非516位点突变菌株,PDRA检测结果显示野生型体系的阳性阈值时间更早(图12~14)。
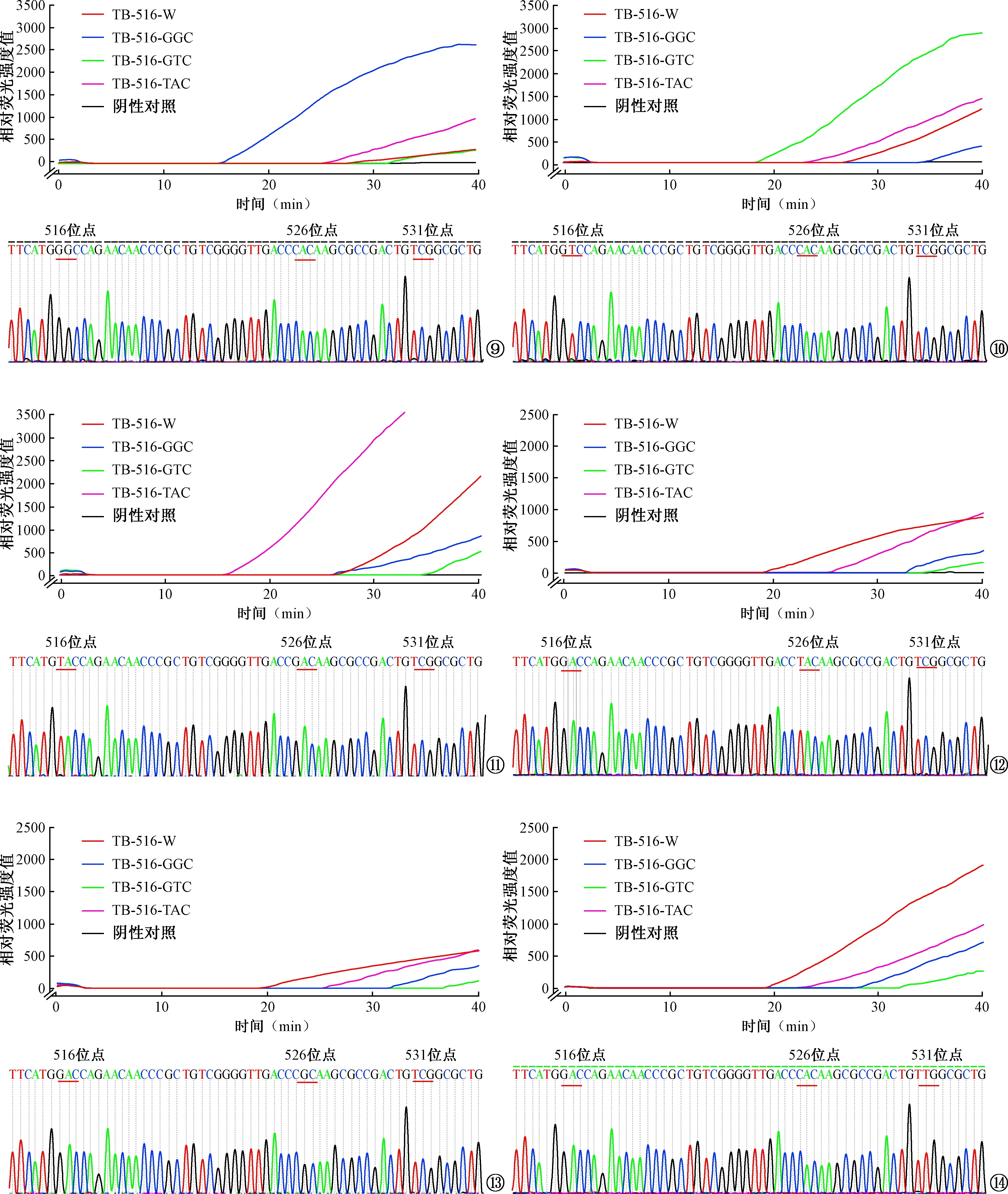
图9~14 PDRA法及测序法检测MTB菌株结果对比。图9为MTB菌株HN05021(516-GGC突变)检测结果。图10为MTB菌株HeN05046(516-GTC突变)检测结果。图11为MTB菌株T5(516-TAC,526-GAC突变)检测结果。图12 为MTB菌株T7(516-W,526-TAC 突变)检测结果。图13为MTB菌株T4(516-W,526-CGC突变)检测结果。图14为MTB菌株FJ-14011(516-W,531-TTG突变)检测结果
4.临床标本测试结果:35份痰标本,经测序后确定有8份(22.9%)在rpoB基因RRDR决定区发现点突变,其中2份(5.7%)发现516位点突变(GGC、GTC),1份(2.9%)发现526位点突变,5份(14.3%)发现531位点突变。针对516位点的PDRA方法检测标本的实验结果与预期结果一致,可识别516位点有无突变,以及发生突变的类型。标本检测结果示例见图15~18,如图15、16所示:2份516位点突变标本经PDRA测试,表现为对应的突变型体系阳性阈值时间早;如图17、18所示: 531位点突变标本及野生型标本经PDRA测试,表现为野生型体系的阳性阈值时间早。
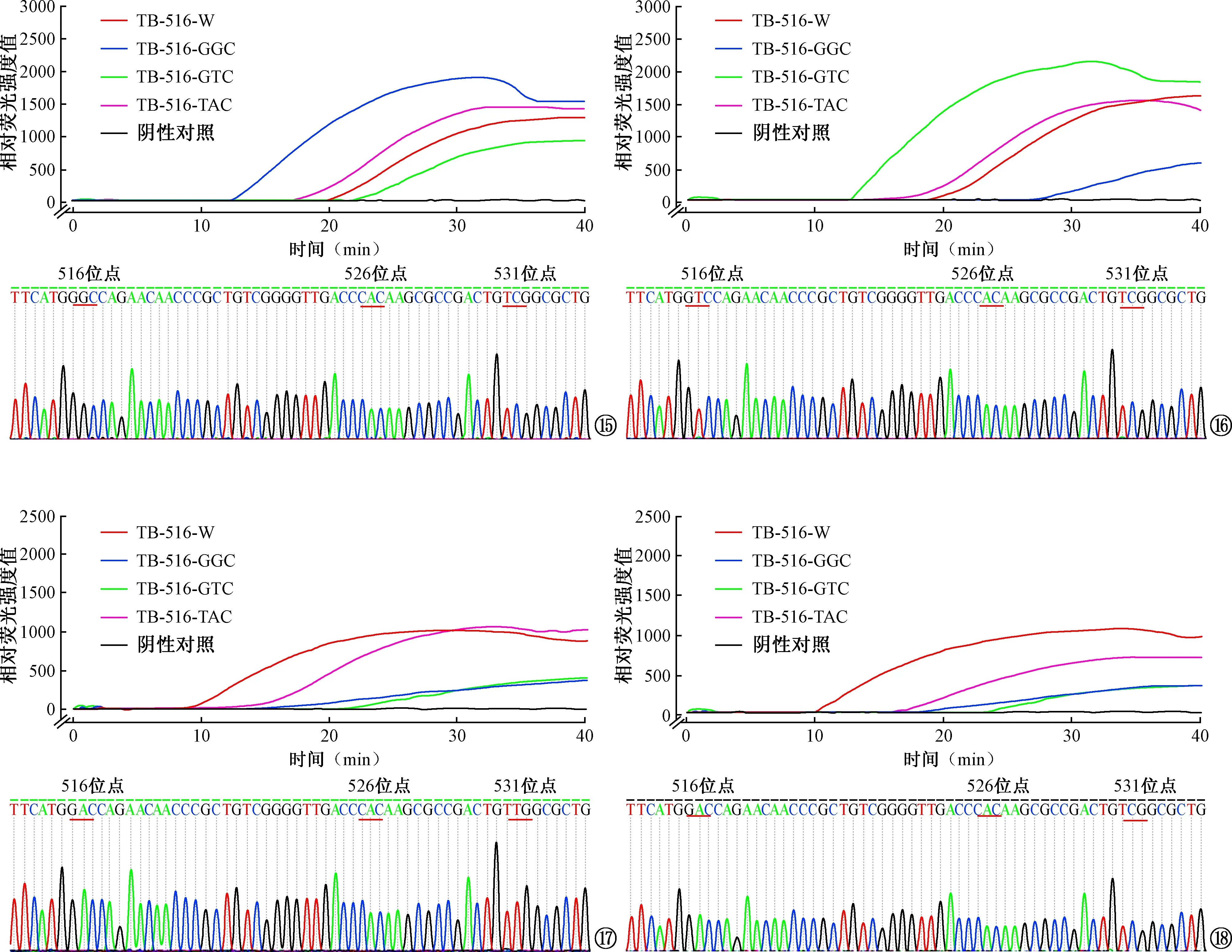
图15~18 PDRA法及测序法检测MTB培养阳性痰标本结果对比。图15为标本181030(516-GGC突变)检测情况。图16为标本181076(516-GTC突变)检测情况。图17为标本181059(516-W,531-TTG突变)检测情况。图18为标本181034(野生型)检测情况
讨 论
本研究应用PDRA法检测MTB利福平耐药基因rpoB基因的516突变位点,通过设计特异性探针识别单个碱基,利用单引物和单探针进行扩增,借助便携荧光检测仪判断该位点是否发生突变。因rpoB基因516位点常出现3种突变类型(GGC、GTC、TAC),所以设计4条特异性探针(1条野生型探针和3条突变型探针)和1条共同的反向引物,建立4种平行检测体系检测模板,在恒温39 ℃条件下反应40 min,依据阳性阈值时间早晚进行516位点突变点识别。不同检测体系在检测相同模板时,阳性阈值时间不同,只有体系的探针与模板完全匹配时,其阳性阈值时间最早,相对荧光强度值最高;而体系的探针与模板不匹配时,则阳性阈值时间晚,荧光值低。通过4种体系检测同一类型的重组质粒,确定了该方法的特异度;通过系列稀释的重组质粒,确定了该方法的检测敏感度为1000拷贝/μl。该方法与测序法同时检测利福平耐药菌株及痰标本, 所得结果一致。
目前已有将RAA方法应用于MTB和非结核分枝杆菌检测的研究。陈淑丹等[14]应用RAA方法检测3种非结核分枝杆菌(海分枝杆菌、脓肿分枝杆菌和堪萨斯分枝杆菌),检测下限可达1000拷贝/μl质粒DNA。陈斌等[15]应用RAA方法检测MTB,最低敏感度为0.043 ng/μl MTB基因组DNA,与其他呼吸道病原菌无交叉反应。两项研究侧重于病原体的定性检测,不涉及耐药突变位点的检测。而本研究的侧重点是已知MTB感染的前提下,进行MTB利福平耐药基因突变位点检测。在PDRA检测体系优化过程中,笔者借鉴等位基因特异性PCR(AS-PCR)的3′端错配原则,在探针的突变位点的5′方向加入人为错配碱基,但检测结果与预期相反,其区分度反而下降。分析可能的原因是RAA的扩增原理与PCR的扩增原理不同:RAA体系主要依赖重组酶与引物或探针形成核酸蛋白复合物,扫描模板,找到同源序列后可解开双链,启动延伸反应;而PCR则是通过温度循环保证扩增反应(变性-退火-延伸)顺利进行。在RAA体系里,序列同源性是非常重要的,引入人为错配碱基,降低了同源性比例,反而降低了探针的特异度。笔者曾尝试加入甜菜碱来提高特异度,但实验结果表明,加入甜菜碱后在某些检测体系(TB-516-GTC)中表现为促进作用,而某些检测体系(TB-516-GGC)则表现为抑制作用。这种拮抗作用的具体机制未明。为了保证检测体系的一致性。本次研究选择不加甜菜碱。
综上,本研究建立了一种检测MTB利福平耐药rpoB基因516突变位点的等温核酸扩增方法,该方法具有以下特点:(1)39 ℃恒温反应,无需精密PCR仪,只需一台便携式荧光检测仪;(2)检测快速,检测可在40 min内完成;(3)闭管操作,不易造成交叉污染;(4)检测结果通过荧光曲线有无及阳性阈值时间进行判定,直观易判断。本研究作为一个初步研究,证明PDRA方法可以应用于MTB利福平耐药基因位点突变的检测。但本研究也存在一些不足:造成利福平耐药的常见rpoB基因突变类型有3种,包括531位点、526位点及516位点[1],而笔者本次研究只建立了针对516位点的PDRA检测方法,后续还将进一步补充526、531位点的PDRA检测方法,并收集更多的测试标本完成方法学评估。
