电针对脑缺血大鼠侧脑室室管膜下区巢蛋白表达的影响
2020-05-15係梦琪任秀君
係梦琪 任秀君
缺血性脑中风是目前全世界第二大致死性疾病,死亡人数约占所有疾病的10%,是导致残疾的主要神经性疾病,因其发病复杂、治愈率低、预后差、易复发而备受关注[1- 2]。目前国内外关于缺血性中风治疗方法和预防的研究较少,西医临床治疗中风的常用方法是溶栓,但溶栓药物极易引起颅内出血,且时间窗较短,疗效有限[3]。因而研究更有效、安全的治疗方法至关重要。针灸治疗中风历史悠久,具有简便、价廉、不良反应小的特点,在临床中广泛用于中风及其后遗症的治疗[4],但其作用机制,尚不十分清楚。本实验通过比较缺血前电针“丰隆”(ST40),脑缺血后电针ST40、“百会”(GV20)与仅在脑缺血后电针ST40、GV20两种针灸处方对脑缺血大鼠的影响,试图说明电针预处理可通过增加缺血侧侧脑室室管膜下区(subventricular zone,SVZ)巢蛋白(Nestin)阳性细胞增殖促进脑缺血后神经损伤和修复,疗效优于仅在脑缺血后进行治疗,从而为临床治疗提供依据。
1 材料与方法
1.1 实验动物
SPF级雄性SD大鼠24只,7周龄,体重(200±20)g,由北京维通利华实验动物技术有限公司提供,动物许可证号:SCXK(京)2012-0001。饲养于北京中医药大学针灸推拿学院实验室,保持自然生物节律(12小时光照/12小时黑暗),温度(24±1)℃,湿度(50±10)%,自由摄食,水瓶给水。所有程序均由北京中医药大学学术委员会实验动物伦理分委员会审核批准(编号:BUCM-3-2018022802-1002)。
1.2 实验试剂及仪器
FeCl3(10025-77-1,天津市福晨化学试剂厂);Nestin抗体(ab11306,Abcam公司);二抗HRP抗小鼠IgG(BM104,武汉博士德生物工程有限公司);DAB显色液(AR1022,武汉博士德生物工程有限公司);无菌针灸针(0.30 mm×25 mm,北京中研太和医疗器械有限公司);韩氏穴位神经刺激仪(LH202H,北京华卫产业开发公司);电子显微镜(BX40F4,Olympus公司);数码相机(E-330,Olympus公司)。
1.3 制作模型
大鼠用10%戊巴比妥钠溶液(40 mg/kg)腹腔注射麻醉后,右侧卧位固定在鼠板上,在外耳道和左眶上缘中间切开皮肤,做一个大约2 cm的纵向切口,分离肌肉后,去除部分颞骨,暴露出大脑中动脉(middle cerebral artery,MCA),用浸有10 μL 50%FeCl3(用0.1 mol/L HCL配置)溶液的滤纸敷在该段动脉上20分钟,取下滤纸后生理盐水冲洗,缝合伤口,少许青霉素粉消炎抗菌,制作大脑中动脉血栓(middle cerebral artery thrombus,MCAT)模型[5]。
1.4 动物分组
大鼠按照随机数字表法随机分为4组:假手术组、模型组、电针1组、电针2组(每组6只)。(1)假手术组:饲养7天后,于第8天暴露MCA,用生理盐水滤纸贴敷20分钟。(2)模型组:饲养7天后,于第8天暴露MCA,用50%FeCl3滤纸贴敷20分钟,造成脑缺血模型。(3)电针1组:电针双侧ST40,每天1次,连续7天,于第8天造成脑缺血模型,术后电针ST40、GV20,每天1次,连续7天;(4)电针2组:饲养7天,于第8天造成脑缺血模型,术后电针ST40、GV20,每天1次,连续7天。每组动物均为术后1、7天两个时间点进行脑组织取材,每个时间点3只大鼠。电针1组、电针2组治疗期间用布袋固定大鼠进行电针治疗,其余各组同期布袋固定。实验流程见图1。
1.5 针刺方法
根据《实验针灸学》[6]中的实验动物穴位图定位。ST40在膝关节后外侧,腓骨正中,腓骨小头下7 mm。GV20在顶骨正中。GV20 前2 mm穴点被选取用于连接电针。ST40直刺7 mm,GV20和前方2 mm处各向后斜刺2 mm;双侧ST40,GV20及其前方2 mm处分别接电针仪,疏密波,频率2/100 Hz交替,刺激强度以1-2-3 mA为宜,大鼠肢体出现轻微颤动,治疗持续时间30分钟。
1.6 行为学检测
在手术后1天运用改良的Bederson评分法[7]对所有动物神经功能缺损评分(neurological deficit score,NDS)进行检测。0分(正常):无神经功能缺陷;1分(轻度):提尾时右侧前爪不能伸展;2分(中度):向右侧转圈;3分(重度):向右侧倾倒;4分(极重度):意识丧失,不能自主活动。术后清醒时评分大于或等于1分者入选。
1.7 取材
各组大鼠生存期满,戊巴比妥钠腹腔麻醉后仰卧位固定,剖开胸腔暴露心脏,从左心室插入灌流针,剪开右心耳,生理盐水灌注5分钟后,4%多聚甲醛继续灌注20分钟直至动物四肢僵硬、肝脏变白,取出大脑用10%中性甲醛固定48小时以上,石蜡浸润包埋,制成蜡块,在前脑侧脑室水平制备冠状切片,片厚5 μm,常温保存。
1.8 组织形态学观察
每组大鼠在术后1天选取两张石蜡切片,经苏木精-伊红(hematoxylin-eosin,HE)染色后观察缺血半暗带的组织形态变化。
1.9 Nestin免疫组化检测
每只大鼠随机选取3张切片,进行免疫组化染色[8],以检测nestin在前脑SVZ的表达,切片以缺血侧侧脑室背外侧角和侧脑室外侧壁为观察部位,显微镜下放大400倍,照相机采集图片,通过ImageJ软件(http:// ImageJ.nih.gov)获得面密度[9]。
1.10 统计学处理


注:电针1组造模前电针ST40 7天,第8天模型组和电针1、2组用50%FeCl3滤纸贴敷左侧MCA建立MCAT模型,假手术组用生理盐水代替FeCl3。术后即刻开始电针ST40、GV20,以后每天一次,每次30分钟,持续7天。
图1 实验设计图
2 结果
2.1 各组大鼠脑缺血术后行为学检测结果
术后1天,模型组动物饮食减少,体重减轻,右侧上肢屈曲,部分出现身体向右倾斜的现象,无意识丧失症状。与模型组比较,电针1、2组NDS降低(P<0.05),差异有统计学意义;与电针2组相比较,电针1组神经功能缺损有减轻趋势,但差异无统计学意义(P>0.05)。见表1。

表1 大鼠脑缺血术后1天NDS结果
注:与假手术组比较,aP<0.01;与模型组比较,bP<0.05,cP<0.01。
2.2 大鼠脑缺血术后HE染色结果
脑缺血术后1天,假手术组缺血半暗带皮层神经元和神经胶质细胞结构完整,排列整齐,核仁清晰,无胞浆红染。模型组神经元排列散乱,偶见胞浆红染,细胞周围间隙扩大,部分血管红细胞渗出,细胞核固缩、深染,核周出现空泡。电针治疗后,缺血半暗带胶质水肿减轻,正常神经元明显增多,细胞空泡变性减少,组织形态趋于正常。见图2。
2.3 大鼠脑缺血术后Nestin免疫组化染色结果
假手术组侧脑室背外侧角和侧脑室外侧壁Nestin阳性细胞数量较少,染色较浅,分布稀疏,阳性表达主要集中在侧脑室外侧壁。模型组缺血侧侧脑室背外侧角染色加深,外侧壁阳性细胞表达增厚,在室管膜下区聚集。与模型组比较,电针治疗后,Nestin阳性反应强度进一步增强,电针1组更为明显;Nestin阳性细胞沿着侧脑室背外侧伸展向外延伸在术后7天时更明显。见图3、图4。
2.4 各组大鼠脑缺血术后Nestin面密度比较
与假手术比较,术后1、7天模型组侧脑室背外侧角和侧脑室外侧壁Nestin面密度均增加(P<0.01)。脑缺血术后1天,与模型组比较,电针1组侧脑室背外侧角(P<0.01)和侧脑室外侧壁Nestin面密度升高(P<0.01),电针2组侧脑室背外侧角(P<0.05)和外侧壁Nestin面密度也升高(P<0.01),差异有统计学意义。脑缺血术后7天,与模型组比较,电针1、2组侧脑室背外侧角Nestin面密度升高(P<0.01),侧脑室外侧壁Nestin面密度也有升高趋势,但差异无统计学意义(P>0.05)。电针1、2组之间比较,差异无统计学意义(P>0.05)。见表2、表3。

图2 各组大鼠脑缺血术后1天缺血半暗带皮层组织形态观察(HE染色,×400)

图3 各组大鼠脑缺血术后Nestin在缺血侧侧脑室背外侧角的表达(免疫组化染色,×400)
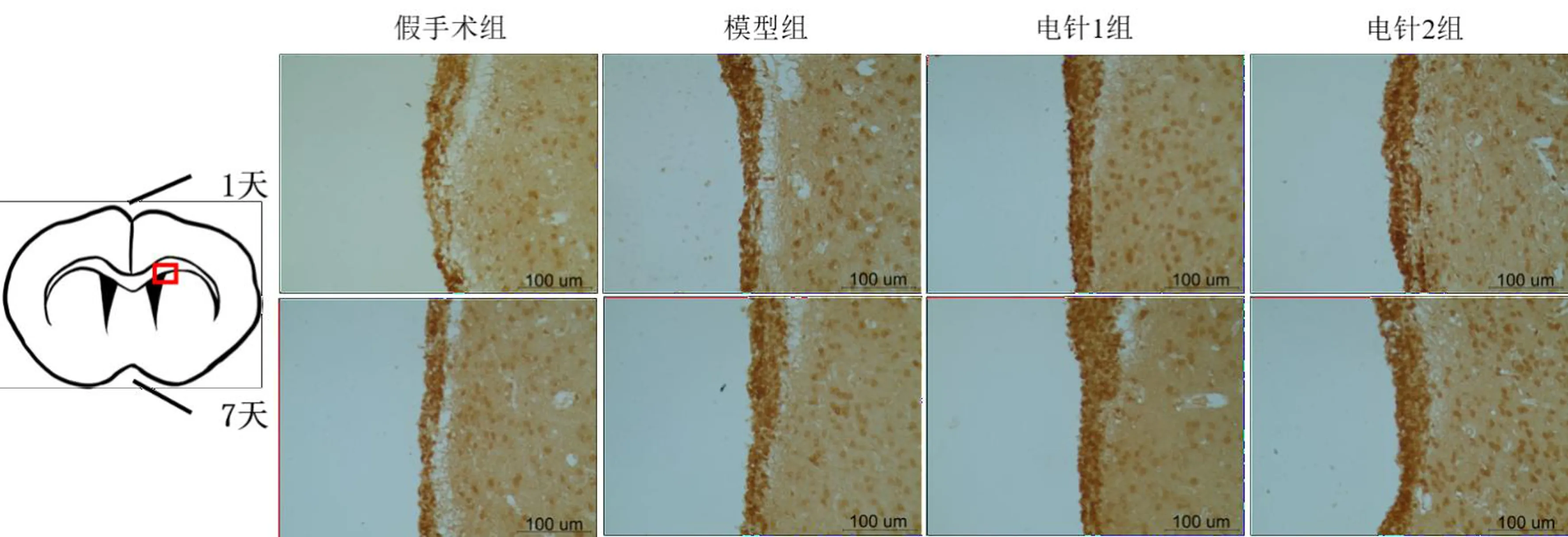
图4 各组大鼠脑缺血术后Nestin在缺血侧侧脑室外侧壁的表达(免疫组化染色,×400)

表2 各组大鼠脑缺血术后缺血侧侧脑室背外侧角Nestin面密度比较
注:n为高倍镜下视野数。与假手术组比较,aP<0.01;与模型组比较,bP<0.05,cP<0.01。

表3 各组大鼠脑缺血术后缺血侧侧脑室外侧壁上段Nestin面密度比较
注:n为高倍镜下视野数。与假手术组比较,aP<0.01;与模型组比较,bP<0.01。
3 讨论
缺血性中风是死亡和长期残疾的主要原因之一,临床上西医治疗中风常用的方法为溶栓[3],而唯一获得美国食品药品监督管理局批准的用于治疗缺血性中风的溶栓剂是重组组织纤溶酶原激活剂(recombinant tissue plasminogen activator,rtPA)。由于rtPA的治疗范围限制在症状发作时间开始3小时内,疗效有限,并且常常会导致颅内出血[10],这在很大程度上限制了rtPA的临床应用。鉴于其发病的广泛性和对患者的破坏性影响,临床上迫切需要治疗缺血性中风更好的方法。
再生策略,尤其是关于神经再生的治疗策略,为许多中风患者提供了希望。神经发生在成年大脑SVZ和海马齿状回的颗粒下层(subgranular zone,SGZ)长期存在[11]。哺乳动物的大脑包含神经干细胞(neural stem cells ,NSCs),它们具有自我更新、增殖和分化成多种神经细胞的能力[12]。当大脑缺血时,SVZ的NSCs增殖、分化,并异位迁移到纹状体和大脑皮层的缺血半暗带中,随后,产生新的神经元来替代丢失的神经细胞[13]。然而此类自发的神经源性反应是有限的,并不足以抵消由脑缺血引起的脑损伤。因此,采取能够刺激内源性NSCs增殖和分化的措施是非常重要的。通过针刺刺激NSCs的增殖、分化、迁移,可及时补充坏死凋亡的细胞,抑制缺血中心区范围的扩大,促进神经功能的恢复。Nestin常在成年NSCs以及未成熟的神经祖细胞中瞬时表达,并且在细胞转化为胶质细胞、神经元等分化细胞后消失,常被用来标记胚胎和成年大脑中的NSCs[14]。研究发现,脑缺血大鼠SVZ区的NSCs在造模后立即被激活,Nestin阳性细胞迅速增多,并在术后7天达到峰值[15],针刺可使缺血侧SVZ区Nestin表达水平增高,明显促进脑缺血损伤后内源性NSCs的增殖[16- 17]。
本实验结果显示,电针1、2组大鼠NDS较模型组明显降低,缺血半暗带胶质水肿减轻,神经元趋于正常,提示针灸疗法可以促进脑缺血损伤大鼠的功能恢复[18]。脑缺血术后,缺血侧侧脑室背外侧角和外侧壁Nestin阳性表达从1天开始增高,到术后7天达到高峰,脑缺血可能诱导SVZ区NSCs增殖,与既往文献研究结果一致。缺血前电针ST40,缺血后电针 ST40和GV20,能够使SVZ区Nestin的表达增强,阳性细胞向侧脑室背外侧伸展延续;缺血前不进行针刺预处理,仅在缺血后进行电针治疗同样可以达到增强NSCs增殖、迁移的目的,但效果不如前者,提示持续的电针治疗可能使缺血侧SVZ区NSCs处于连续增殖状态,并沿着侧脑室背外侧伸展迁移,从而达到修复损伤的目的。
综上所述,电针ST40、GV20可以改善神经功能,减轻缺血性脑损伤,促进SVZ区NSCs增殖,达到脑损伤后神经修复的目的;缺血前电针ST40,缺血后电针 ST40、GV20效果优于缺血后电针 ST40、GV20。
