“三法三穴”推拿手法对大鼠坐骨神经损伤后髓鞘厚度和神经调节蛋白1-人类表皮生长因子受体2表达的影响
2020-04-26沈熠莫岩君于天源吕桃桃罗宇婷张羽墨邵帅李易真
沈熠,莫岩君,于天源,吕桃桃,罗宇婷,张羽墨,邵帅,李易真
北京中医药大学,北京市 100029
坐骨神经及其分支与小腿、足的运动和感觉密切相关。坐骨神经损伤后,症状以臀部疼痛并向下肢放射,下肢无力、肌肉萎缩,自觉麻木、疼痛[1],感觉异常为主,临床可采用肌电图和神经传导速度进行诊断和疗效评估[2],可通过促进坐骨神经修复的药物治疗、物理治疗和手术治疗进行干预。坐骨神经损伤作为周围神经损伤的一种,其恢复机理尚不完全明确,亟需从多角度完善其机理并指导临床。本团队前期研究表明[8-20],推拿手法干预坐骨神经损伤大鼠可调控多层面、多因子的表达,促进坐骨神经的修复。
神经调节蛋白(neuregulins,NRGs)及其受体原癌基因人类表皮生长因子受体(human epidermal growth factor receptor,HER,又名ErbB)家族与神经发育有关,影响神经回路产生、轴突代偿、神经传递和突触可塑性[3]。周围神经损伤后,此信号与施万细胞和髓鞘密切相关。本研究建立大鼠坐骨神经损伤模型,通过斜板测试评价后肢肌力的恢复情况,通过透射电镜观察坐骨神经损伤点处髓鞘的变化,通过Western blotting法检测坐骨神经损伤点和L4-6脊髓处NRG1及其受体ErbB2的表达,分析比较“三法三穴”推拿手法干预前后的变化,以完善推拿促进周围神经损伤恢复的可能机理。
1 材料与方法
1.1 实验动物和分组
雄性SPF级Sprague-Dawley大鼠76只,体质量(200±10) g,购自北京维通利华实验动物技术有限公司,合格证号为北京百善SCXK(京)2016-0006,饲养于北京中医药大学屏障环境动物实验室,室温20 ℃,空气相对湿度40%,大鼠自由进食水。实验程序经北京中医药大学动物使用和管理委员会批准,符合动物福利与伦理原则。
采用随机数字法将大鼠分为正常组、假手术组、模型组和推拿组。具体方法:使用Microsoft Excel软件,A列为编号1~76,B列=RAND()并下拉填充,至每个编号都有生成的[0,1]之间一个随机数字,C列为复制数值并升序排列,每组19只动物,记录编号和分组。
1.2 主要仪器与试剂
按摩推拿手法模拟仪:中国专利200710187403.1。自制电动斜板测试仪。Mini-P-2电泳槽、电泳仪:美国BⅠO-RAD公司。MultiSkan3酶标仪:美国THERMO公司。冷冻离心机:德国EPPENDORF公司。水平脱色摇床:海口其林贝尔有限公司。电动组织匀浆器:美国FLUKA公司。预制胶溶液:中国新赛美公司。BCA蛋白定量试剂盒、10X TBST缓冲液、彩虹18-245蛋白Marker、脱脂奶粉、2 mg/ml BSA标准品:中国索莱宝公司。兔源ErbB2抗体、HRP二抗、ECL显影液:英国ABCAM公司。小鼠源NRG1抗体:美国THERMO FⅠSHER公司。戊巴比妥钠:中国国药集团。戊二醛、锇酸、环氧树脂812、醋酸双氧铀、柠檬酸铅:中国中兴百瑞公司。
1.3 造模及干预方法
1.3.1 造模
模型组和推拿组使用坐骨神经夹持损伤法进行造模。造模前12 h禁食,器械消毒。1%戊巴比妥钠溶液3.5 ml/kg腹腔注射麻醉,注意回抽,至疼痛反射消失。备皮并常规消毒手术区域。于大鼠右侧臀股交界处,纵向切口约0.5 cm。眼科剪钝性分离,以弯钩镊找到并暴露、分离坐骨神经。使用同一把特制无齿持针器,于梨状肌下缘5 mm处满扣夹持5 s后松开,满扣力量约6 N,最终形成约2 mm宽的神经损伤点。缝合后碘伏消毒。术后注意护理。假手术组仅分离后暴露坐骨神经5 s,不夹持。
1.3.2 干预
术后7 d推拿组开始干预,干预前适应环境0.5 h。采用按摩推拿手法模拟仪分别于推拿组术侧殷门、承山、阳陵泉三穴,先后施行点、拨、揉三法,每法每穴1 min,力量为4 N。每只大鼠干预9 min,每天1次,每干预10次休息1次,共干预20次。其余组束缚同等时长。
1.4 检测方法
1.4.1 斜板测试
每组取8只大鼠,于造模前、术后7 d、28 d,在室温恒定、安静环境下进行测试。采用自制电动斜板测试仪,使用前校对并归零电子量角器。大鼠适应环境0.5 h后,将头朝向斜板远离轴端平行放置,待其适应后逐渐缓缓抬高斜板,待其发生相对位移并保持5 s后,记录此时角度。每只大鼠按次序重复测量3次,取均数。
1.4.2 Western blotting
分别于术后3 d、7 d、28 d,每组取5只大鼠,1%戊巴比妥钠3.5 ml/kg腹腔注射麻醉后,冰上腹主动脉取血5 ml,后取术侧坐骨神经损伤点上下各1 cm,再取脊髓L4-6节段。将组织分别放于组织裂解混合液(PMSF、蛋白酶抑制剂、磷酸酶抑制剂,1∶100以RⅠPA稀释)300 μl中,冰上研磨。混合液4 ℃、14 000 r/h离心1 h。吸取上清,加5×蛋白上样缓冲液并混匀。封口后100 ℃水浴5 min,后冰上5 min。BCA比色测吸光度并配平。配胶上样后稳压电泳120 V 90 min;冰上电转100 V 120 min。依据marker剪膜,使用5%脱脂奶的TBST溶液室温摇床1 h进行封闭。加一抗(NRG1抗体1∶100,ErBb2抗体1∶1000,β-actin抗体1∶3000)室温摇床孵育1 h后,4 ℃冰箱过夜。1×TBST洗膜3次,每次10 min。加二抗室温摇床孵育1 h。洗膜3次。配好显影液并避光保存,均匀滴在膜上,避光反应1 min后开始显影。
1.4.3 电镜观察
术后28 d,每组取4只大鼠,1%戊巴比妥钠3.5 ml/kg腹腔注射麻醉后,俯卧于冰中,快速取术侧坐骨神经损伤点上下0.5 cm,3%戊二醛溶液中固定2 h,1%锇酸溶液固定1.5 h,醋酸双氧铀染色1 h,50%~100%酒精梯度脱水,每级15 min。分别用无水酒精和无水丙酮等比例混合液、无水丙酮脱水各10 min。环氧树脂包埋,切片厚50~70 nm。铅染色,电镜观察神经损伤点,CCD数码照相系统采集图像。应用Ⅰmage J软件测量轴突直径和有髓纤维总直径,计算g-ratio。

1.5 统计学分析
2 结果
2.1 斜板测试
造模前,各组斜板测试角度无显著性差异(P>0.05)。术后7 d和28 d,模型组和推拿组斜板测试角度均低于正常组和假手术组(P<0.05)。术后28 d,推拿组评分高于模型组(P<0.05)。正常组和假手术组在各时间点斜板测试评分比较无显著性差异(P >0.05)。模型组术后7 d和28 d低于造模前(P<0.05),推拿组术后28 d低于造模前,高于术后7 d (P<0.05)。见表1。
2.2 Western blotting
2.2.1 坐骨神经损伤点
2.2.1.1 NRG1表达
术后3d,模型组和推拿组NRG1表达高于正常组和假手术组(P<0.05)。术后7 d和28 d,各组NRG1表达无显著性差异(P>0.05)。正常组在各时间点NRG1表达无显著性差异(P>0.05)。假手术组和推拿组术后28 d NRG1表达低于术后3 d (P<0.05);模型组术后28 d表达低于术后3 d和7 d (P<0.05)。见表2、图1。
2.2.1.2 ErbB2表达
术后3d和7d,模型组和推拿组ErbB2表达高于正常组和假手术组(P<0.05)。术后28d,各组ErbB2表达无显著性差异(P>0.05),但推拿组ErbB2表达高于模型组(P<0.05)。正常组和假手术组各时间点ErbB2表达无显著性差异(P>0.05)。模型组术后28 d ErbB2表达低于术后3 d(P<0.05);推拿组术后7d和28dErbB2表达低于术后3d (P<0.05)。见表3、图1。

表1 各组斜板测试角度比较(°)

表2 各组坐骨神经中NRG1平均积分光密度
2.2.2 L4-6脊髓
2.2.2.1 NRG1表达
术后3d,模型组和推拿组NRG1表达高于正常组和假手术组(P<0.05)。术后7d,模型组和推拿组NRG1表达高于假手术组(P<0.05)。术后28d,各组NRG1表达无显著性差异(P>0.05),但推拿组NRG1表达高于模型组(P<0.05)。正常组、假手术组和推拿组在各时间点NRG1均无显著性差异(P>0.05)。模型组术后28dNRG1表达低于术后3d和7d (P<0.05)。见表4、图2。
2.2.2.2 ErbB2表达
术后3d和7d,模型组和推拿组ErbB2表达高于正常组和假手术组(P<0.05)。术后28d,各组间ErbB2表达比较无显著性差异(P>0.05)。各组组内各时间点比较也无显著性差异(P>0.05)。见表5、图2。
2.3 电镜观察
2.3.1 形态学
术后28d,假手术组髓鞘致密均匀,结构完整,形态规则并呈板层样结构整齐排列;模型组部分髓鞘轴突可见重度髓鞘崩脱,髓鞘扭曲,偶有髓鞘球,板层间隙扩大、板层分离;推拿组髓鞘部分磷脂脱落,板层略有分离,偶见髓鞘崩脱。见图3。
2.3.2 g-ratio
术后28d,模型组g-ratio值低于假手术组(P<0.05),推拿组高于模型组(P<0.05),且与假手术组比较无显著性差异(P>0.05)。见表6。

表3 各组坐骨神经中ErbB2平均积分光密度
表4 各组L4-6脊髓中NRG1平均积分光密度

表5 各组L4-6脊髓中ErbB2平均积分光密度

图1 术后各时间点各组坐骨神经损伤点中NRG1和ErbB2表达(Western blotting)
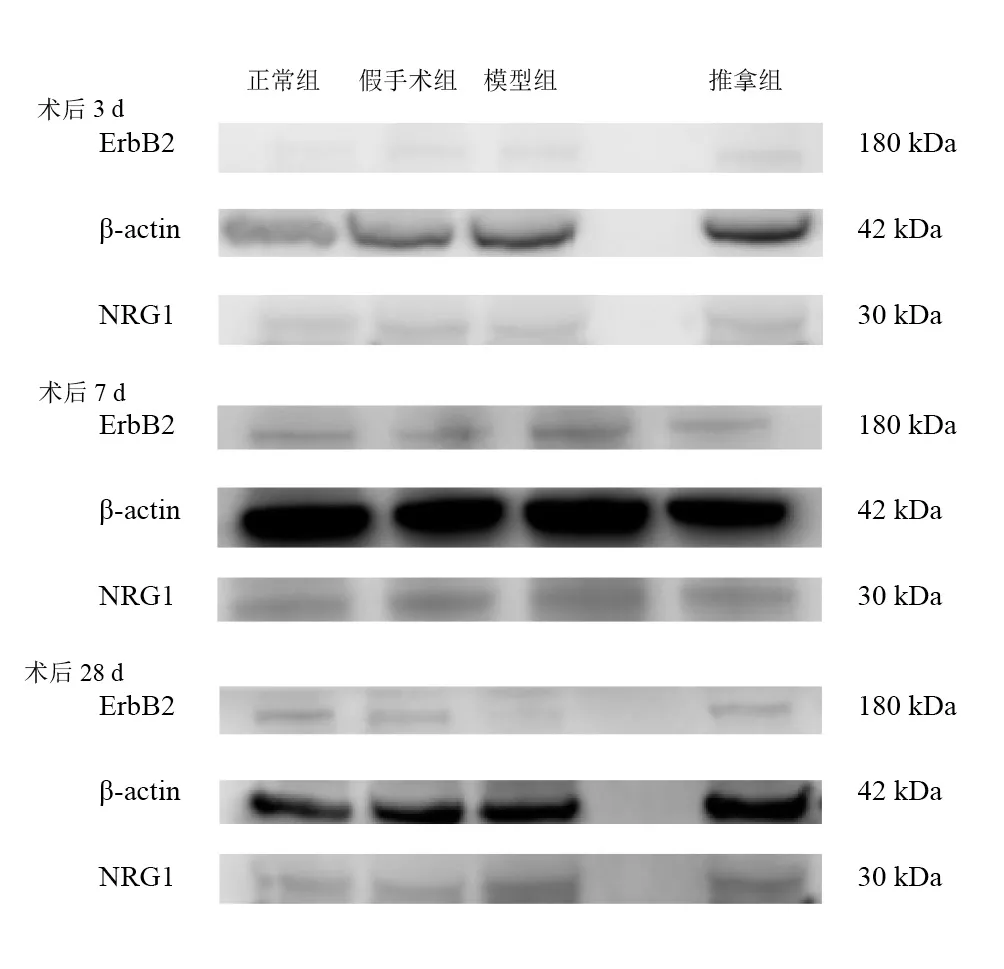
图2 术后各时间点各组L4-6脊髓中NRG1、ErbB2表达(Western blotting)

表6 术后28d各组g-ratio值
3 讨论
周围神经损伤主要表现为运动和感觉功能障碍、肌肉无力和肌肉萎缩,按症状可归于中医的痿证和痹证。前者以痿软无力为主,是功能异常;后者以疼痛麻木为主,是感觉异常[4]。中医论治时,以舒筋活络、扶正祛邪为要,通过口服外用中药、针灸推拿等中医干预手段,改善症状,减轻肌肉萎缩、无力及疼痛、感觉异常,最终通过促进神经恢复、减少细胞凋亡达到疗效。内治以健运脾胃、调补肝肾、养血行瘀为主[5]。外治主要采用针灸推拿,前者侧重经络理论上穴位的主治与特性,后者侧重在解剖层面消除病因,其共同点是舒筋通络、活血止痛,以期恢复正常结构与功能。
痹证中“坐臀风”(又名腿股风)症见臀部疼痛,可连累腰、腿,甚至足跟,这与坐骨神经痛症状极为相似,其治疗侧重放松局部,以膀胱经和胆经为主,点、拿、按环跳、委中、承山、阳陵泉[6]。痿证中下肢症状的选穴除上述穴位外还有心俞、命门、关元等穴。本研究根据经络和解剖理论选取殷门、承山和阳陵泉三穴,对坐骨神经钳夹损伤大鼠进行手法干预。
推拿干预在坐骨神经损伤后修复的过程中,从运动[7]和感觉[8]功能恢复两个方面起效;在脊髓、背根节、坐骨神经损伤点三个水平,多因子共同发挥作用。经推拿手法干预,在脊髓水平,脊髓腹角运动神经元损伤减轻[9],轴突再生加快[10];在背根节水平,可减少神经元变性及肿胀现象[11];在坐骨神经水平,改善神经元凋亡[12],促进神经纤维髓鞘再生与轴突恢复[13]。此外,推拿干预可以调控多种因子的表达,促进受损周围神经的恢复。细胞凋亡相关的Bcl-2、Caspase-3[7],与轴突相关的层黏连蛋白[14],与髓鞘相关的髓鞘碱性蛋白[15],与神经细胞生长增殖相关的降钙素基因相关肽[16]和神经生长因子[17],突触可塑性相关的Synapsin Ⅰ[6],轴浆运输相关的马达蛋白(Dynein、Kinesin、Dynactin)[18],神经元细胞骨架相关的微管相关蛋白2和神经丝蛋白[19]等因子都参与这个过程。

图3 电镜观察结果
在周围神经系统中,施万细胞包绕轴突形成髓鞘,不仅可使电信号跳跃式传导,亦有营养支持、修复受损的作用。周围神经损伤后,Wallerian变性发生,轴突和髓鞘崩解消失。g-ratio值反映髓鞘厚度,数值越大,髓鞘越薄。正常成年大鼠周围神经此比值为0.6[20]。本研究显示,术后28d,假手术组和推拿组g-ratio值与此值接近,模型组降低,说明坐骨神经损伤点处在此时间点超微结构仍显示髓鞘变厚,推拿干预可减轻髓鞘变厚程度,更趋近于正常水平。模型组结果与既往研究[21]不同,其原因可能是术后28d一部分髓鞘板层仍处于分离状态,其间隙仍扩大,亦可能是观察视野距离损伤点远近不同所致。本研究还发现,推拿干预28 d能促进模型动物患侧肢体运动功能恢复。这与本团队前期大量研究的结果相同,说明推拿干预能明显改善患侧后肢肌力,改善其运动功能。推拿治疗坐骨神经损伤疗效显著,且有确切形态学证据。
NRGs是一类细胞生长与分化调节相关蛋白,对神经系统的发育起重要作用,可分为NRG1~NRG4,其中NRG1研究最多。NRG1的表皮生长因子(epidermal growth factor,EGF)样结构可以结合并激活ErbB受体酪氨酸激酶家族(ErbB1~ErbB4)。ErbB2活化需要ErbB3或ErbB4的参与,形成异源性二聚体,激活下游信号分子发挥作用[22]。不同类型的NRG1作用亦不同。当神经损伤后,轴突-施万细胞相互作用中断,轴突跨膜NRG1与胶质ErbB受体的相互作用消失,可溶性NRG1转录被激活[23]。在周围神经系统中,NRG1通过与受体ErbB结合,调控施万细胞行为,调控髓鞘再生。轻度损伤(如挤压伤或切断伤)后,远端神经残端可溶性NRG1表达立即显著增加[24]。此信号可调控神经嵴细胞向施万细胞前体分化[25],并调控后者的增殖和迁移[26]。外源性NRG1干预可防止和降低因轴突切断导致的施万细胞凋亡[27]。轴突源性的NRG1Ⅲ与施万细胞ErbB2/3受体结合发生磷酸化,产生起始信号并激活下游的丝裂原活化蛋白激酶、磷脂酰肌醇3激酶、磷脂酶C、蛋白激酶C等神经修复再生相关的信号通路,在髓鞘化过程中发挥作用[23]。除了神经修复作用,NRG1-ErbB信号亦在精神分裂症[28]、心肌梗死[29]等疾病中通过调控神经胶质细胞、心肌细胞发挥作用。
在坐骨神经损伤点中,模型组和推拿组术后28d NRG1、ErbB2表达低于术后3 d;造模后3 d,模型组和推拿组NRG1、ErbB2表达高于假手术组。提示此信号在神经损伤早期起效。术后7d,各组NRG1无显著性差异,而模型组和推拿组ErbB2表达升高。这说明ErbB2的高表达可能与NRG1信号无关,其原因可能是NRG1通过ErbB3或ErbB4,与ErbB2形成二聚体活化起效,因此推断在此时间点ErbB2的蛋白表达可能有一定时间延后性。术后28d,模型组和推拿组NRG1、ErbB2表达与正常组和假手术组比较均无显著性差异,提示在神经损伤后28d,坐骨神经水平的NRG1-ErbB2信号已完成其对于损伤神经的调节。干预后,推拿组NRG1、ErbB2表达高于模型组,提示推拿干预可以一定程度上提高坐骨神经中NRG1、ErbB2的表达。在不同模型和干预方法的研究中,NRG1、ErbB2亦发挥相似作用。对于糖尿病周围神经病大鼠,电针干预14 d可上调坐骨神经NRG1和ErbB2 mRNA表达,改善坐骨神经功能[30]。对于正中神经受损小鼠,人为促进ErbB2高表达,能显著改善握力,促进轴突末梢的生长[31]。
在L4-6脊髓中,模型组术后28d NRG1水平降低,与其在坐骨神经损伤点处变化趋势相同,亦说明推拿干预可以一定程度上提高脊髓中NRG1表达;各组术后3d、7d、28d比较,ErbB2水平均无显著性差异,其原因可能是NRG1与其他受体结合。造模后3d和7d,模型组和推拿组NRG1、ErbB2表达高于假手术组,提示其与神经损伤密切相关。术后28d,模型组和推拿组NRG1、ErbB2表达与假手术组比较无显著性差异,提示在坐骨神经损伤后28d,脊髓水平的NRG1-ErbB2已完成其对于损伤神经的修复作用。后续研究可细分时间和观察部位,结合感觉和运动功能的恢复进行分析。值得注意的是,推拿干预后,推拿组NRG1表达高于模型组,提示推拿干预可以提高脊髓NRG1的表达。在其他研究中也证实脊髓层面NRG1-ErbB2的作用。在脊神经结扎模型中,造模后14d脊髓背角中NRG1表达升高,与ErbB受体结合,介导星形胶质细胞活化[32]。在骨癌痛模型大鼠中,造模14d后脊髓背角内星形胶质细胞和小胶质细胞被广泛激活,阻断NRG1-ErbB2受体信号通路能有效抑制脊髓胶质细胞的表达和活化[33]。
综上所述,坐骨神经钳夹损伤后,NRG1、ErbB2在坐骨神经损伤点和L4-6脊髓中表达升高;推拿干预可改善模型大鼠的运动功能,调节坐骨神经损伤点处的髓鞘厚度,调节NRG1、ErbB2的表达量,促进受损神经的恢复。
在未来研究中,可以结合形态学、光遗传和慢病毒转染技术,研究NRG1-ErbB2通路对脊髓、背根节、坐骨神经损伤点中不同神经胶质细胞的影响和神经损伤、修复相关细胞(如巨噬细胞)的变化,以及中医干预对此通路和相关神经胶质细胞的影响;亦可过表达或减低甚至阻断此通路,对比中医干预,研究其对于内源性NRG1、ErbB2的影响。
