“三法三穴”推拿手法对坐骨神经损伤大鼠运动功能和转化生长因子β1/Smad2通路蛋白表达的影响
2020-04-26邵帅莫岩君于天源沈熠罗宇婷张羽墨吕桃桃
邵帅,莫岩君,于天源,沈熠,罗宇婷,张羽墨,吕桃桃
北京中医药大学,北京市 100029
周围神经损伤是指周围神经丛、神经干或其分支受外力作用,如锐器伤、牵拉伤、挤压伤等而发生的损伤,会造成受损神经支配区域运动和感觉功能的缺陷。推拿能够有效促进周围神经再生和感觉、运动功能恢复[1-3]。施万细胞是周围神经损伤和修复的主要参与者之一。周围神经损伤后,远端神经施万细胞转变为无髓表型并快速增殖,分泌趋化因子吸引巨噬细胞到达受损神经残端,分泌细胞因子指导轴突再生。推拿能够有效促进神经再生,但推拿对施万细胞增殖的影响尚缺乏定量研究。
转化生长因子β1 (transforming growth factor β1,TGF-β1)作为施万细胞重要的细胞因子,在损伤早期能够促进施万细胞向无髓表型转化,促进施万细胞增殖,同时促进瘢痕形成。脉冲电磁场可通过促进TGF-β1表达以促进神经修复[4],但推拿对TGF-β1表达的影响尚不清楚。本研究观察“三法三穴”推拿手法对坐骨神经损伤(sciatic nerve injury,SNⅠ)大鼠后肢运动功能以及坐骨神经损伤点施万细胞标志物S100、TGF-β1及其下游信号Smad2的表达,以阐释SNⅠ大鼠运动功能恢复机制。
1 材料与方法
1.1 动物分组
清洁级雄性Sprague-Dawley大鼠66只,体质量(200±10) g,由北京斯倍福实验动物中心提供。适应性饲养1周后,按随机数字表随机分为假手术组、模型组和观察组,每组22只。本实验已通过北京中医药大学针灸推拿学院动物实验伦理委员会批准。实验过程对动物的处置遵循科技部颁布的《关于善待实验动物的指导性意见》相关规定。
1.2 主要仪器与试剂
推拿手法模拟仪:中国专利号200710187403.1。CM 1950冰冻切片机:德国LEⅠCA公司。Nikon Eclipse 80i荧光显微镜:日本NⅠKON公司。电子天平:德国塞多利斯科学仪器有限公司。蛋白电泳电转系统、Western blotting成像分析仪:美国BⅠO-RAD公司。SpectraMax M2酶标仪:美国MOLECULAR DEVⅠCES公司。TS-2000A摇床:中国KYLⅠN-BELL公司。
BCA蛋白浓度测定试剂、TBST、电泳缓冲液、电转液:北京索莱宝生物科技有限公司。SDS-PAGE凝胶预混液、超敏化学发光试剂盒:苏州新赛美生物技术有限公司。TGF-β1兔抗大鼠一抗、GAPDH兔抗大鼠一抗、Smad2兔抗大鼠一抗、S100小鼠抗大鼠一抗、山羊抗兔二抗、含DAPⅠ封片剂:美国ABCAM生物科技有限公司。山羊抗兔荧光二抗(绿色)、驴抗小鼠荧光二抗(红色):美国ⅠMMUNOWAY生物科技有限公司。
1.3 模型制备
对模型组和观察组进行坐骨神经夹持手术[3]。1%戊巴比妥钠3.5 ml/kg腹腔注射麻醉,备皮消毒后暴露右侧坐骨神经,用止血钳于梨状肌下缘5mm处满扣夹持坐骨神经5s后缝合。术后每天固定时间观察大鼠排便、排尿和进食情况。造模后大鼠右后肢瘫痪、蜷缩、跛行为坐骨神经夹持损伤模型造模成功的标准。假手术组仅分离后暴露坐骨神经5s,不夹持。
1.4 干预
假手术组和模型组不干预。观察组于造模成功后第8天开始干预。在不影响伤口愈合的前提下,采用“三法三穴”推拿手法干预,即每天用推拿手法模拟仪依次在大鼠手术侧殷门、承山、阳陵泉施行点、拨、揉法,刺激力量为5 N。每法每穴1 min,每只总计9 min。按摩头为光滑的、直径10mm的圆形接触面。每天1次,共21d。
1.5 观察指标
1.5.1 坐骨神经功能指数(sciatic functional index,SFⅠ)[4]
在干预前和干预21d,每组取6只大鼠,双后足染色,放入铺有打印纸的木槽,待大鼠行走留下3~4对足印。标记大鼠手术侧足为E,正常侧足为N。选择印迹清晰的足印分别测量足印长度(print length,PL)、足趾宽度(toe spread,TS)、中间足趾距离(intertoes distance,ⅠT)。代入公式[5]。

1.5.2 斜板测试[6]
于干预前,干预7 d、14 d、21 d,每组取6只大鼠置于25°斜面上适应1 min;之后逐渐增加斜板的角度。当大鼠可在一定角度坚持5 s且不滑落,则继续增加角度,直至无法在该斜板上坚持5 s。记录大鼠所能坚持的最大角度。每只测量3次,取均值。
1.5.3 免疫荧光染色
干预21d,每组取4只大鼠,1%戊巴比妥钠3.5ml/kg腹腔注射麻醉,4%多聚甲醛溶液灌注固定后,取右侧坐骨神经2cm于30%蔗糖水中脱水、OTC包埋、冰冻切片,厚度12μm。取部分切片,干燥,TBS缓冲液漂洗,封闭剂封闭1 h,加入TGF-β1兔抗大 鼠ⅠgG (1∶50)或Smad2兔抗大鼠ⅠgG (1∶500)、S100小鼠抗大鼠ⅠgG(1∶1000),过3夜后,避光加入山羊抗兔ⅠgG (1∶1000,绿 色),驴抗小鼠ⅠgG(1∶500,红色),过夜后漂洗,使用含DAPⅠ的封片剂封片,于显微镜下观察损伤神经的形态结构。
采用Ⅰmage J图像分析软件,在每只大鼠的神经图像中随机选择3个500×500的视野测定积分光密度(integrated optical density,ⅠOD),取平均值;将TGF-β 1与S100共标,观察TGF-β1的表达部位与施万细胞的关系;将Smad2与DAPⅠ共标,观察Smad2表达部位与细胞核的关系。
1.5.4 Western blotting
在干预前,干预7 d、21 d,每组取6只大鼠,1%戊巴比妥钠3.5 ml/kg腹腔注射麻醉,于冰上取损伤点处新鲜坐骨神经组织约2 cm,-80 ℃冰箱保存。取出坐骨神经标本置于研磨棒中,加入组织裂解液,于冰上裂解15min,4 ℃、离心半径9.5cm、1000r/min离心15min后取上清液,BCA法测定样本蛋白浓度。将样品以每孔20μg蛋白为标准进行上样,在10%SDSPAGE胶上以80 V电压电泳至溴酚蓝跑至胶板底部。4 ℃30 V电压转膜12h。室温封闭条带2 h,加入稀释后的一抗(TGF-β1 1∶500、Smad2 1∶4000、p-Smad2 1∶500、GAPDH 1∶3000)于4 ℃冰箱内摇床孵育12 h。TBST洗涤3次,每次5min,加入稀释后的二抗(1∶3000)于室温孵育1 h后,TBST洗涤3次,每次5 min,ECL化学发光液曝光,Ⅰmage J图像分析软件分析目标条带的ⅠOD。以目的蛋白与内参蛋白的比值为相对表达量。
1.6 统计学分析
2 结果
2.1 SFⅠ
干预前,模型组和观察组术后右足不能着地,SFⅠ低于假手术组(P<0.05)。干预21 d,观察组SFⅠ高于模型组(P<0.05)。见表1。
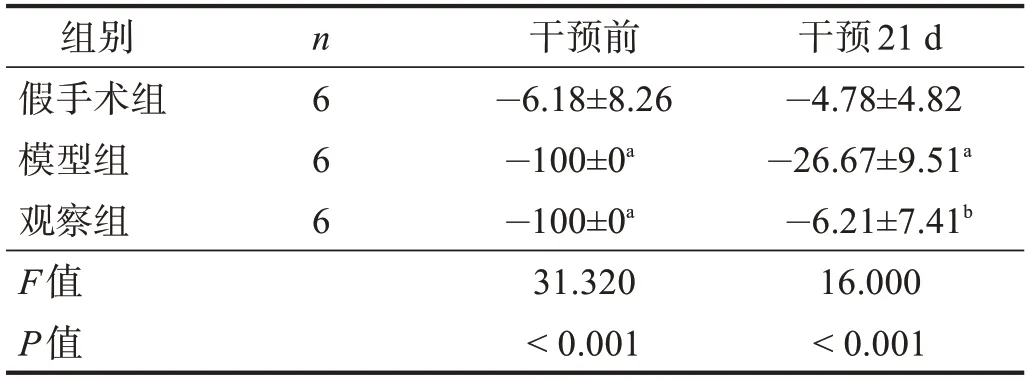
表1 各组不同时间点SFI比较
2.2 斜板测试
各时间点,模型组和观察组斜板测试角度均小于假手术组(P<0.05)。干预21 d,观察组斜板角度高于模型组(P<0.05)。见表2。
2.3 免疫荧光染色
三组坐骨神经TGF-β1和Smad2表达均无显著性差异(P>0.05)。模型组坐骨神经S100表达明显低于假手术组(P<0.01),观察组高于模型组(P<0.05),且与假手术组比较无显著性差异(P>0.05)。见表3。
假手术组和观察组髓鞘排列相较于模型组都更加致密有序。Smad2主要表达在细胞核周围。TGF-β1与S100表达部位存在着较高程度的重合。见图1、图2。
2.4 Western blotting
2.4.1 TGF-β1
干预前和干预7d,模型组TGF-β1表达较假手术组升高(P<0.05)。干预7 d,观察组TGF-β1表达较模型组降低,但无显著性差异(P>0.05)。干预21d,三组TGF-β1表达无显著性差异(P>0.05)。见 表4、图3。
2.4.2 Smad2
干预前和干预7d,模型组Smad2表达较假手术组升高(P<0.05)。干预7d,观察组Smad2表达较模型组降低,但无显著性差异(P>0.05)。干预21d,三组Smad2表达无显著性差异(P>0.05)。见 图4、表5。
2.4.3 p-Smad2
干预前和干预7d,模型组p-Smad2表达较假手术组升高(P<0.05)。干预7d,观察组p-Smad2表达较模型组降低,但无显著性差异(P>0.05)。干预21d,三组p-Smad2表达无显著性差异(P>0.05)。见图5、表6。
3 讨论
周围神经损伤根据受损程度分为Ⅰ~Ⅴ度5个级别,Ⅰ度仅为神经传导障碍,Ⅴ度为神经干完全断裂。目前临床对于周围神经损伤的治疗方法主要包括手术疗法[6]、针灸疗法[7]、推拿疗法[8]和电刺激疗法[9]。其中推拿疗法作为主要的非手术疗法之一,适用于临床最常见的Ⅲ度以内的周围神经损伤,有着无创伤、无痛苦、不受医疗条件限制的优势。多项临床试验表明,推拿治疗周围神经损伤疗效显著。董林林等[10]采用董氏推拿六法(揉法、点法、拿法)治疗神经根型颈椎病,有效率达93.33%。钱俊辉等[11]采用罗氏推拿治疗腰椎间盘突出症,愈显率达90%。
本研究采用坐骨神经挤压损伤模型,模拟临床常见的周围神经卡压损伤,属于推拿治疗适用的Ⅱ度损伤。治疗点选用殷门、承山、阳陵泉三穴,分属足太阳膀胱经和足少阳胆经所过。殷门位于坐骨神经干处,承山位于胫神经,阳陵泉位于腓总神经;殷门位于股二头肌,承山位于腓肠肌,阳陵泉位于胫前肌。这三个穴位是能够同时刺激穴位、神经和肌肉的最佳治疗点。
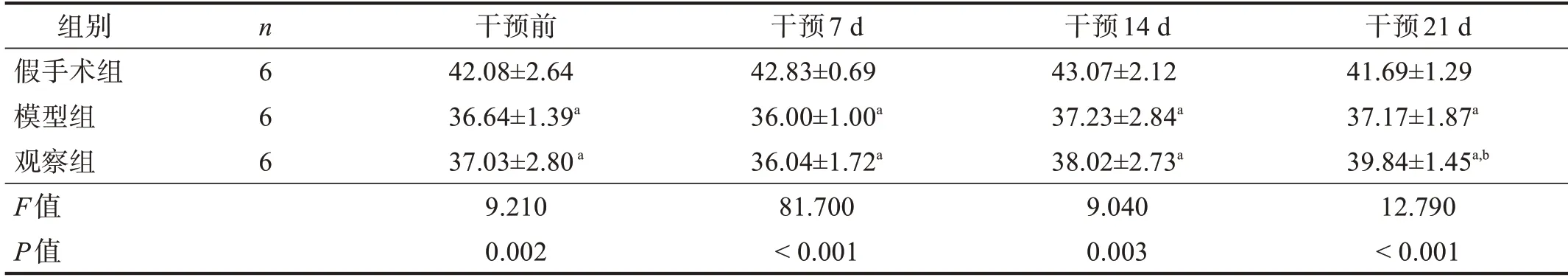
表2 各组不同时间点斜板测试角度比较(°)
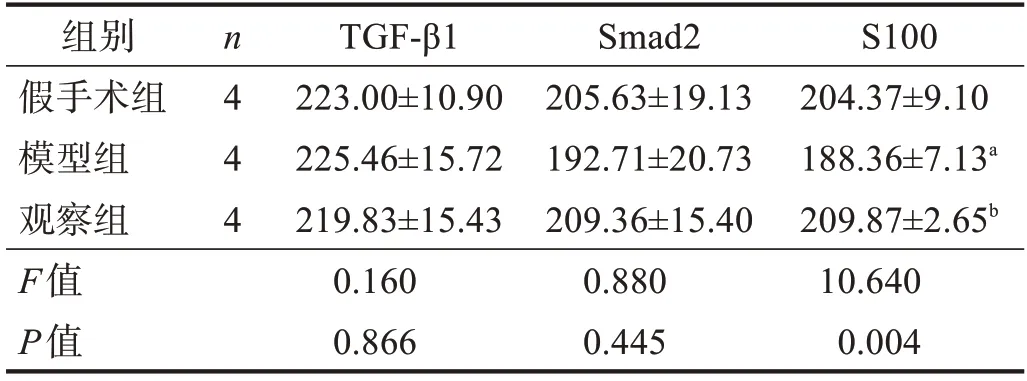
表3 干预21 d各组损伤点TGF-β1、Smad2和S100的表达(ⅠOD)
周围神经损伤后,损伤的远端神经发生Wallerian变性,轴突、髓鞘崩解脱失,远端神经施万细胞转变为无髓表型并快速增殖;增殖的施万细胞形成Bungner带,并通过分泌多种神经营养因子引导轴突生长。王婷等[12]发现,Bungner带数量在损伤后7~15 d到达高峰。当轴突生长进入Bungner带后,施万细胞向有髓表型转化,最终形成髓鞘。
TGF-β 是由两个分子量为12.5 kDa亚单位组成的二聚体,是一种可以调节多种细胞生长、分化等细胞因子。在哺乳动物中,TGF-β1最为普遍。TGF-β1在许多生物学行为中起关键作用,如炎症和免疫反应、胚胎发育、伤口愈合、细胞外基质形成和重塑等[13]。TGF-β1在损伤神经中主要分布于施万细胞和巨噬细胞[14-16]。施万细胞膜表面存在与TGF-β1有高度亲和力的受体TGF-βR。TGF-β1通过与TGF-βR结合发挥调节作用。
TGF-β1与TGF-βR结 合,Smad2磷酸化为p-Smad2,p-Smad2分子穿过核孔进入细胞核,在神经损伤早期发挥促增殖作用[17-18]。TGF-β1能促进体外纯化施万细胞增殖。Einheber等[19]发现,TGF-β1可促进纯化的施万细胞增殖。张平安[20]发现,过表达TGF-β1可以促进纯化的施万细胞分化和增殖。说明在损伤早期,TGF-β1主要发挥促施万细胞增殖作用。
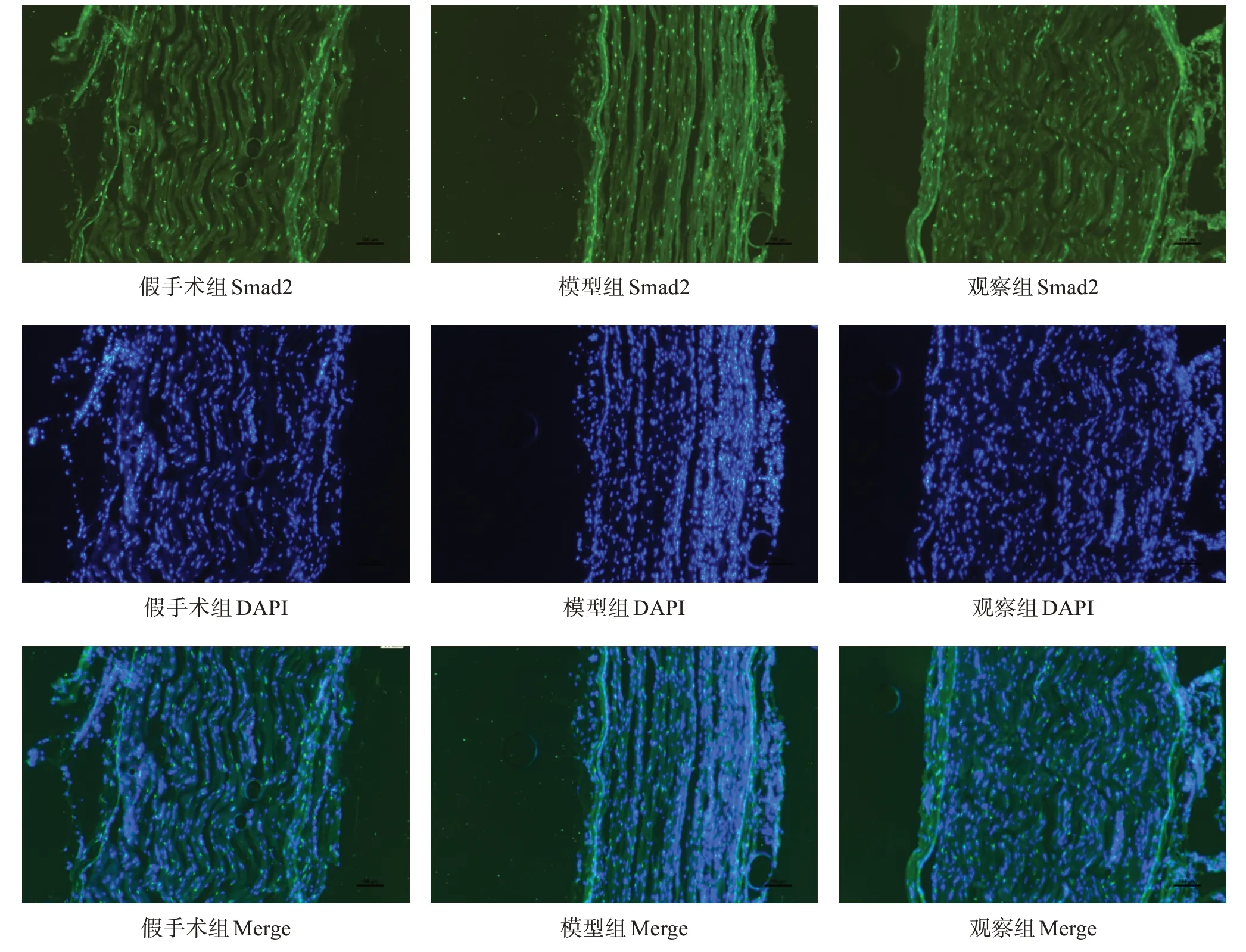
图1 干预21 d各组坐骨神经损伤点Smad2表达(免疫荧光冰冻切片,×400)
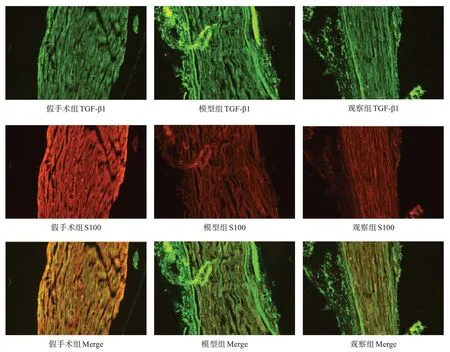
图2 干预21 d各组坐骨神经损伤点TGF-β1、S100表达(免疫荧光冰冻切片,×400)
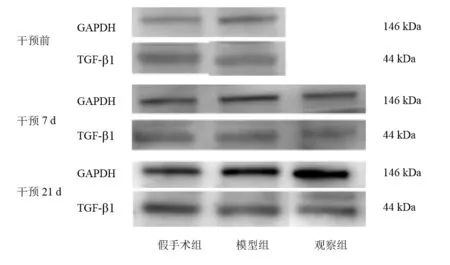
图3 各组神经损伤点TGF-β1蛋白表达(Western blotting)
Chen等[21]发现,外源性TGF-β1对慢性收缩损伤大鼠神经性疼痛具有镇痛作用。Sulaiman等[22]发现,外源性TGF-β 与毛喉素合用能够促进周围神经慢性损伤后修复。裴媛媛等[23]发现,损伤早期给予外源性TGF-β1能够促进SNⅠ大鼠坐骨神经修复。
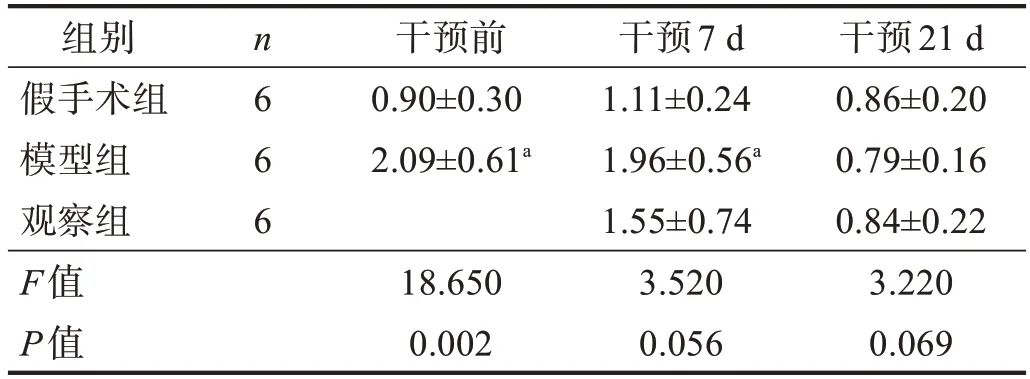
表4 各组神经损伤点TGF-β1的蛋白表达(ⅠOD)
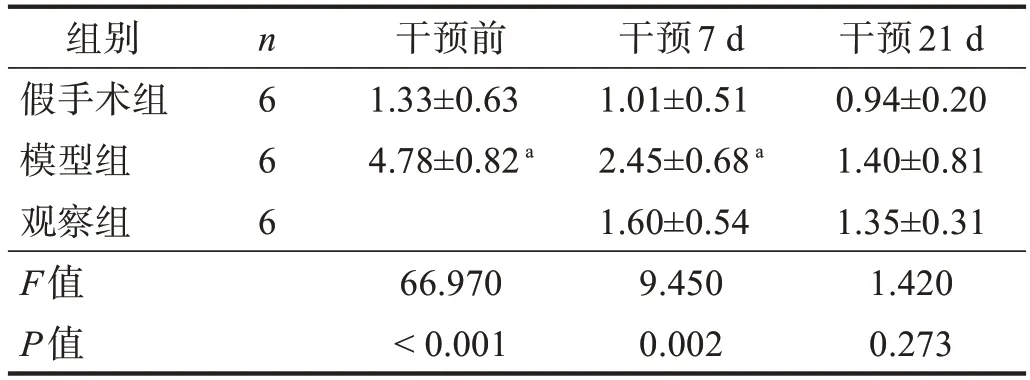
表5 各组神经损伤点Smad2的蛋白表达(ⅠOD)
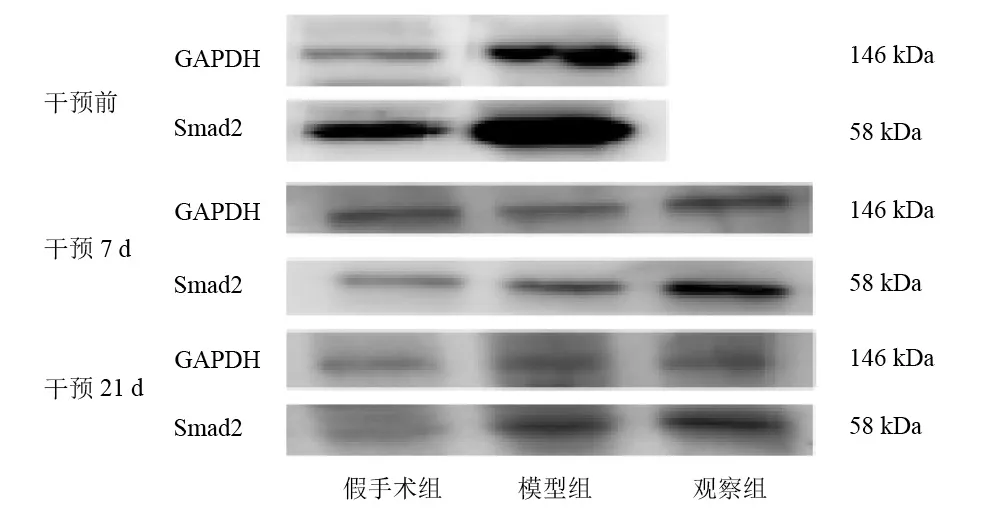
图4 各组大鼠神经损伤点Smad2蛋白表达(Western blotting)
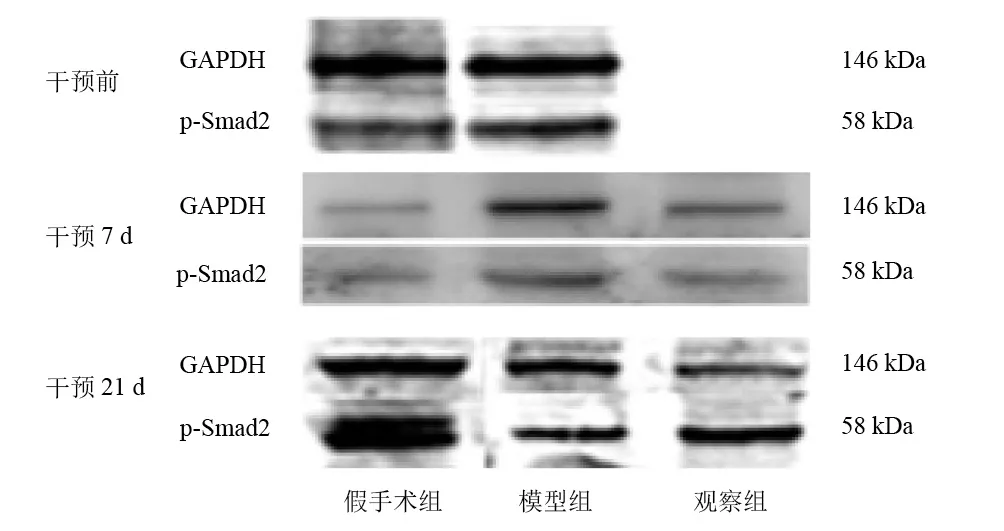
图5 各组神经损伤点p-Smad2蛋白表达(Western blotting)
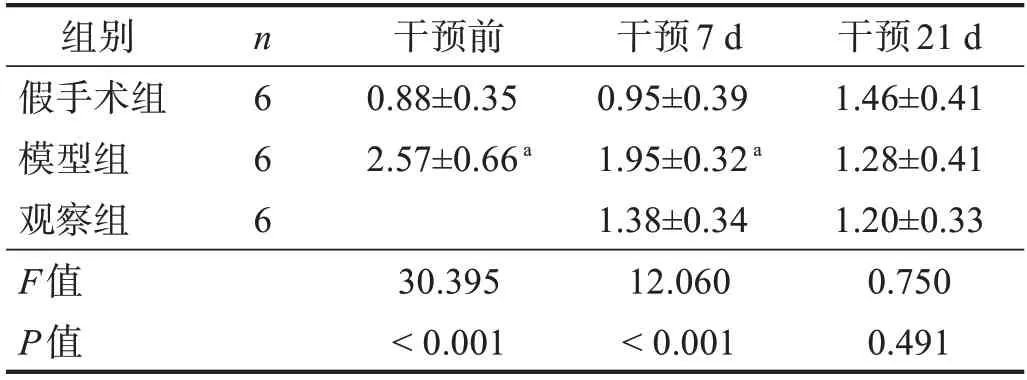
表6 各组神经损伤点p-Smad2的蛋白表达(ⅠOD)
本研究发现推拿能改善SNⅠ大鼠后肢运动功能和精细动作,这与既往研究结果相吻合[24]。
本研究通过免疫荧光法对坐骨神经损伤点处施万细胞标记物S100进行定量分析,发现“三法三穴”能够通过促进施万细胞增殖以促进髓鞘修复。郭汝宝[25]发现,推拿可以促进损伤神经施万细胞的增殖和髓鞘再生。鲁梦倩[26]发现,推拿可明显促进SNⅠ大鼠坐骨神经纤维髓鞘的再生,并且能够促进施万细胞分泌轴突导向因子Netrin1、Slit2。崔旻珍[27]发现,推拿可促进施万细胞分泌层黏连蛋白,降低髓鞘碱性蛋白,促进施万细胞增殖,减少髓鞘脱落,从而加快神经髓鞘的修复进程。
本研究显示,TGF-β1主要表达于坐骨神经纤维髓鞘,且Smad2主要在细胞核周围表达。TGF-β1在损伤神经内表达量的变化趋势也与既往研究结果相吻合。Kim等[28]对SNⅠ大鼠损伤神经近端和远端TGF-β表达进行时相研究,发现远端施万细胞的TGF-β1在受伤后3 d增加,一直持续到损伤后28 d神经再生结束。在本研究中,在损伤后7d,模型组TGF-β1在神经损伤点的表达升高,损伤后28 d,模型组与假手术组无显著性差异。观察组坐骨神经损伤点TGF-β1/Smad2通路蛋白表达在干预后21d与模型组比较无显著性差异,说明推拿的促髓鞘修复作用可能与TGF-β 1/Smad2通路无关。
Western blotting结果显示,坐骨神经损伤点TGFβ1/Smad2通路的蛋白表达出现降低趋势,这可能与神经瘢痕形成有关。周围神经受损后,成纤维细胞活化增殖,产生大量的Ⅰ型和Ⅲ型胶原蛋白,导致瘢痕形成,阻碍神经再生[29-31]。TGF-β1是瘢痕形成的主要影响因子,对神经瘢痕的形成有着促进作用[32-33]。纯化的TGF-β1能够调节与瘢痕形成相关的组织型纤溶酶原激活物(tissue plasminogen activator,tPA)和纤溶酶原激活物抑制剂1 (plasminogen activator inhibitor 1,PAⅠ-1)的表达[34],而推拿干预也能调节坐骨神经损伤点中tPA和PAⅠ-1的含量[35]。还有研究表明[36-37],机械刺激能够通过影响TGF-β1的表达减轻胶原蛋白及瘢痕形成。据此推测,本实验中TGF-β1出现下降趋势是由于推拿能够通过调节TGF-β1的分泌,影响瘢痕形成。
目前,推拿治疗周围神经损伤作用机理的研究主要围绕促进神经再生,对于作为阻碍神经再生因素的研究相对偏少,且在周围神经损伤后瘢痕形成方面尚无相关研究。因此在未来的研究中,除对神经瘢痕进行形态学观察外,还可以从基因水平层面和转录水平进一步探究推拿干预对神经瘢痕形成的影响及机理。
