儿童自身免疫性肝炎的诊治进展
2020-04-21张雪媛王建设
张雪媛, 王建设
复旦大学附属儿科医院 感染传染科, 上海 201102
自身免疫性肝炎(AIH)是一种免疫介导的肝实质慢性进行性炎症性疾病,既影响成人,也可影响儿童。2015年有报道[1]儿童AIH的年发病率约0.23/100 000。英国一项研究[2]显示,AIH发病率正逐步上升,21世纪初青少年AIH的年发病率较20世纪90年代增长6倍。根据血清学特点,AIH分为 2型:1型即抗核抗体(ANA)和(或)抗平滑肌抗体(SMA)和(或)抗可溶性肝抗原(SLA)阳性;2型即抗肝-肾微粒体1型(LKM-1)和(或)抗肝细胞胞质1型(LC-1)抗体阳性。在儿科,AIH-1至少占2/3,通常在青春期发病;而AIH-2可在更小的年龄发病,包括婴儿期。儿童AIH临床表现多样,可隐匿起病、无明显症状,亦可急性起病,甚至表现为急性肝衰竭。相对于大多数成人以疲劳、恶心、腹痛等非特异性症状为表现的慢性病程,儿童和青少年的AIH多呈急性进展性表型。
2018年欧洲儿科胃肠、肝病和营养协会(ESPGHAN)[3]提出了青少年自身免疫性肝病诊断评分标准,这基于综合及简化评分系统[4-5]不适用于青少年AIH,不能区分AIH-1型和自身免疫性硬化性胆管炎(ASC)[6],且青少年诊断AIH相关的自身抗体滴度通常低于成人的阳性临界值。儿童AIH的治疗目前尚存在许多问题[7],相比成人AIH,儿童治疗缓解的标准通常更为严格:除转氨酶和血清 IgG水平正常外,还需达到自身抗体转阴或呈低滴度水平[8]。
1 诊断
1.1 临床特征 儿童AIH的临床表现多样,起病方式包括[3,9]:(1)类似急性病毒性肝炎的表现(40%~50%的AIH-1或AIH-2患者);(2)症状出现后2周~2个月出现暴发性肝衰竭伴肝性脑病(约3%的AIH-1和约25%的AIH-2患者);(3)隐匿起病,表现为非特异性症状,持续6个月至数年后确诊(约40%的AIH-1和约25%的AIH-2患者);(4)既往无黄疸或肝病病史,以肝硬化和门静脉高压的并发症就诊(约10%的两类AIH);(5)偶然发现的转氨酶水平升高,无任何症状或体征。因此,在除外已知的病毒性肝炎病因后,所有存在长期或严重肝病症状和体征的儿童都应怀疑并除外AIH。1/3的AIH患者在诊断时已有肝硬化[10],急性起病的患者在肝活检中也常发现有进展性的纤维化或肝硬化。
AIH患者往往有自身免疫性疾病家族史[11]。约20%的患者在诊断时或随访期间并发其他自身免疫性疾病(EHAD),常见的有甲状腺炎、炎症性肠病等,应积极及时治疗相关疾病[12](表1)。此外,部分对免疫抑制治疗有应答的AIH-2可以是自身免疫性多内分泌腺病-念球菌病-外胚层发育不良综合征,而该病约20%~30%的病例合并AIH-2型[13]。
1.2 免疫球蛋白(Ig)与自身抗体 IgG和(或)γ-球蛋白水平升高是AIH特征性的血清免疫学改变之一。血清IgG水平可反映肝内炎性反应的活动程度,经免疫抑制剂治疗后可逐渐恢复正常。因此,该项指标不仅有助于AIH的诊断,而且对检测治疗应答具有重要的参考价值。血清IgG水平的正常范围较宽,约15%的AIH-1和25%的AIH-2的儿童IgG水平在正常范围内。此外,约40%的AIH-2可见部分IgA缺乏。
AIH诊断的关键是循环中存在自身抗体,自身抗体在区分AIH和其他肝病中亦有重要作用[14]。大多数AIH患者血清中存在一种或多种自身抗体,病程中抗体效价可发生波动,但自身抗体效价并不能可靠地反映疾病的严重程度。其可在发病初期呈低滴度甚至阴性,特别是在急性或爆发性起病的情况下,而在随访过程中检测到。根据自身抗体的不同,AIH分为两型:ANA和(或)SMA/或抗-SLA阳性为AIH 1型;抗LKM-1和(或)抗LC-1阳性为AIH 2型[15]。与成人不同,在儿童,ANA和SMA≥1∶20,或抗LKM-1≥1∶10即有临床意义[16]。
临床上,70%~80%的AIH患者呈ANA阳性, 20%~30%呈SMA阳性(国内报道阳性率多低于欧美国家),ANA和(或)SMA阳性者为80%~90%[17]。间接免疫荧光仍是ANA检测的金标准,ANA在AIH中通常呈核均质型。SMA的免疫荧光染色有3种类型:V(血管)、G(肾小球)和T(小管)。VG和VGT型是AIH的标志,VGT型对应F-actin。高效价抗F-actin诊断AIH的特异度较高。
3%~4%AIH患者呈抗LKM-1和(或)抗LC-1阳性。抗LKM-1阳性患者常呈ANA和SMA阴性,抗LKM-1的检测可避免漏诊AIH。在10%的2型AIH患者中,抗LC-1是唯一可检测到的自身抗体,且抗LC-1与AIH的疾病活动度和进展有关[17]。
其他不常检测但具有重要诊断价值的自身抗体包括抗-SLA和非典型抗中性粒细胞胞浆抗体(pANCA)。抗-SLA对AIH的诊断具有高度特异性[18],但检出率较低,其阳性可提示病情更重和预后更差[19]。pANCA[例如外周抗核中性粒细胞抗体(pANNA),即非典型pANCA]的存在,可以诊断AIH[20]。pANCA经常在AIH-1中检测到,而AIH-2中几乎没有。
1.3 病理特征 AIH的诊断离不开肝组织学检查,其典型组织学特征是界面性肝炎。界面性肝炎是由淋巴细胞和浆细胞为主的炎性浸润,穿过界板并侵入实质周围;被炎症细胞包围的肝细胞肿胀并发生坏死。界面性肝炎可分为轻、中、重度:(1)轻度,即局部或少数门管区破坏;(2)中度,即<50%的门管区或纤维间隔破坏;(3)重度,即>50%的门管区或纤维间隔破坏。中、重度界面性肝炎支持AIH的诊断。界面性肝炎并非AIH所特有,轻度界面性肝炎也可存在于其他慢性肝病如病毒性肝炎、药物性肝损伤、Wilson病等。浆细胞浸润是AIH另一特征性组织学改变,主要见于门管区和界面处,有时也可出现在小叶内。但浆细胞缺如并不能排除AIH。其他可能提示AIH诊断的非特异性特征有淋巴细胞穿入现象和肝细胞玫瑰花环[21]。穿入现象是指淋巴细胞进入肝细胞胞质,而玫瑰花环是指由数个水样变性的肝细胞形成的假腺样结构,周围可见淋巴细胞包绕。有研究认为其比界面性肝炎或富浆细胞浸润提示AIH的意义更强[22],65%的AIH患者存在穿入现象,而仅33%存在玫瑰花环[23]。儿科队列研究[24]发现,与非AIH的肝病患者相比,56%的AIH的患者存在典型的组织学表现(包括界面性肝炎、门管区淋巴浆细胞浸润、玫瑰花环形成和穿入现象)。有研究[25]发现,在Kupffer细胞中发现透明液滴是区分AIH与其他慢性肝炎有用的诊断标记,且与血清IgG水平升高2倍以上相关。
肝脏病理学也可评价纤维化程度,有助于识别重叠综合征以及可能存在的伴发疾病,如非酒精性脂肪肝[26]。尽管在少数典型AIH患者中,胆管周围也存在炎症改变,但当炎症明显时,提示重叠硬化性胆管炎[27]。
AIH急性发病以及复发期间,病理常表现为伴有桥接坏死的全小叶性肝炎。与隐匿起病的患者相比,急性肝衰竭(ALF)起病的患者病理主要表现为小叶中心区的损伤,常伴有大量坏死和多小叶塌陷[28]。一项关于儿科患者的研究[29]提示,组织学不能区分自身免疫性与不明原因的ALF。当肝活检存在风险时,组织学检查的缺失不应妨碍立即开始免疫抑制治疗,而当凝血指标等允许的情况下应尽快进行肝活检。

表1 AIH患者及其一级亲属中并发的EHAD的类型和比例[11-12]
1.4 诊断标准 AIH的诊断基于患者的临床表现、生化指标、血清学检查和病理表现。国际自身免疫性肝炎小组(IAIHG) 分别于 1993年和1999年制定并更新了 AIH 描述性诊断标准和诊断积分系统,具有良好的敏感性和特异性,但较为复杂,多用于科研;于2008年提出简化积分系统,简单易行,但可能漏诊部分不典型患者。最近一项关于儿童AIH的荟萃分析[30]显示,简化积分标准敏感度为77%,特异度为95%。AIH-1型和青少年ASC常有类似的自身免疫特征,上述评分系统不能区分,只有胆管造影才能明确。为此,2018年ESPGHAN[3]提出了新的青少年自身免疫性肝病诊断评分标准,增加了pANNA、抗LC-1和胆管造影的评分项目和权重,是否能够提高儿童AIH的诊断效率尚需增加样本量以验证(表2)。
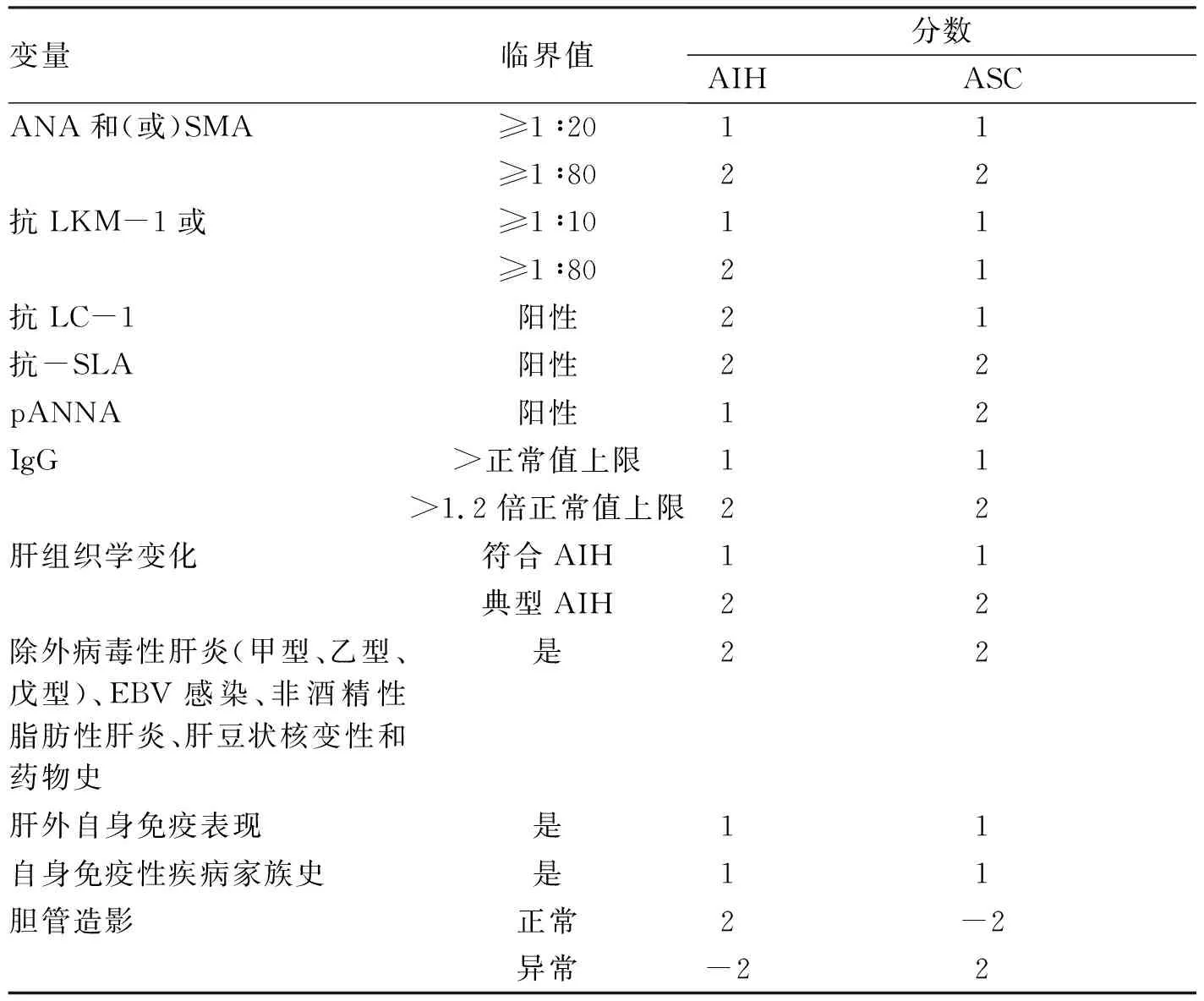
表2 ESPGHAN关于青少年自身免疫性肝病诊断的评分标准
注:应用间接免疫荧光法在复合的啮齿动物基质(肾、肝、胃)上测定抗体。AIH评分≥7,可能为AIH;评分≥8,确诊为AIH;ASC评分≥7,可能为ASC;评分≥8,确诊为ASC。ANA、SMA、抗LKM-1、抗LC-1和抗-SLA获得的积分最多不超过2分。
2 治疗
儿童AIH对免疫抑制剂敏感,确诊后应立即开始治疗避免疾病进展。除以脑病为表现的爆发性病例外,AIH对免疫抑制治疗有满意的效果。据报道[1],无论肝损伤程度如何,缓解率高达90%。儿童AIH的治疗缓解标准较成人严格:当转氨酶和IgG水平正常,ANA和SMA呈阴性或低滴度(<1∶20),抗LKM-1和抗LC-1呈<1∶10或阴性时,认为病情完全缓解。复发定义为缓解后血清转氨酶水平升高。治疗过程约40%的患者出现复发。
2.1 标准治疗 泼尼松(龙)起始剂量1~2 mg·kg-1·d-1(最大60 mg/d),在4~8周随着转氨酶水平的下降而逐渐减量,维持剂量为2.5~5 mg/d[31]。在大多数患者中,前2个月转氨酶水平下降80%,但完全正常可能需要几个月的时间。在治疗的前6~8周,应每周检查肝功能,并相应调整药物剂量,避免严重的副作用。单独的泼尼松(龙)治疗用于合并血细胞减少、巯基嘌呤甲基转移酶(TPMT)功能缺陷、肝硬化及疑似AIH患者。
大多数AIH需要泼尼松(龙)联合硫唑嘌呤(AZA)治疗。AZA在体内TPMT等作用下转化为6-甲基巯基嘌呤、6-硫鸟嘌呤核苷酸等代谢产物,通过干扰淋巴细胞DNA合成而发挥作用。添加时间根据不同中心的方案而不同。在某些中心,只有在出现严重的类固醇副作用,或单用类固醇治疗转氨酶水平停止下降时会添加AZA,起始剂量为0.5 mg·kg-1·d-1,如无毒副作用,可逐步加至2.0~2.5 mg·kg-1·d-1,直到生化控制;而在其他中心,应用类固醇治疗2周后,以0.5~2 mg·kg-1·d-1的剂量添加AZA。不管方案如何,85%的患者最终都需要AZA。随着AZA剂量调至2 mg·kg-1·d-1,泼尼松(龙)的剂量逐渐降到最低甚至完全停药[32]。应注意AZA可能的肝毒性,尤其是在肝硬化和严重黄疸的患者。一项回顾性分析[33]显示,早期联合应用AZA和泼尼松(龙)治疗AIH的副作用(93%)和复发率(67%)均高于激素诱导仅在需要时添加AZA治疗的AIH患儿(复发率33%~36%;副作用18%~38%)。已有研究者[34-35]提出,开始AZA治疗前进行TPMT活性测定,作为药物代谢和毒性的预测,但预测价值需要进一步研究。
布地奈德是第2代糖皮质激素,在肝脏的首过清除率约 90%,抗炎疗效相当于泼尼松(龙)的 5 倍,而代谢产物无糖皮质激素活性,代表一种理想的肝脏“局部”治疗。但布地奈德不适用于对泼尼松(龙)应答欠佳[36-37]及肝硬化患者。一项关于儿童AIH前瞻性研究[38]显示,布地奈德与AZA联合应用可诱导和维持病情缓解,布地奈德可作为泼尼松(龙)的替代治疗。该疗法副作用少,但在诱导缓解方面可能不如泼尼松有效。参照国内外指南[3,17,39],标准治疗的流程如图1所示。
2.2 二线疗法
AIH二线治疗方案一方面用于疾病发作时诱导缓解以减少类固醇副作用;另一方面治疗难治性患者,即那些对标准免疫抑制不耐受或无反应的患者。
2.2.1 用于诱导缓解 钙调磷酸酶抑制剂包括环孢素、他克莫司,主要通过抑制T淋巴细胞信号转导发挥免疫抑制作用。环孢素的起始剂量为4 mg·kg-1·d-1,分3次使用,必要时每2~3 d增加1次,以达到全血浓度250±50 ng/ml持续3个月。如果在第1个月出现临床和生化的缓解,在接下来的3个月将环孢素浓度降低至200±50 ng/ml。该方法在部分AIH的儿童中得到成功应用[40]。长期随访环孢素对儿童AIH的生化缓解效果良好[41]。他克莫司是一种药物毒性与环孢素类似,但更有效的免疫抑制剂。荟萃分析[42]提示所有二线治疗中,他克莫司与泼尼松联合使用对转氨酶的恢复最有效。儿童 AIH 患者对他克莫司长期耐受良好,在对标准治疗不耐受或失败的患者中,其大部分有效[43]。单用他克莫司在大多数情况下不足以达到完全缓解,但可用来减少泼尼松龙和AZA的剂量,避免其副作用。他克莫司的目标浓度为2.5~5 ng/ml。
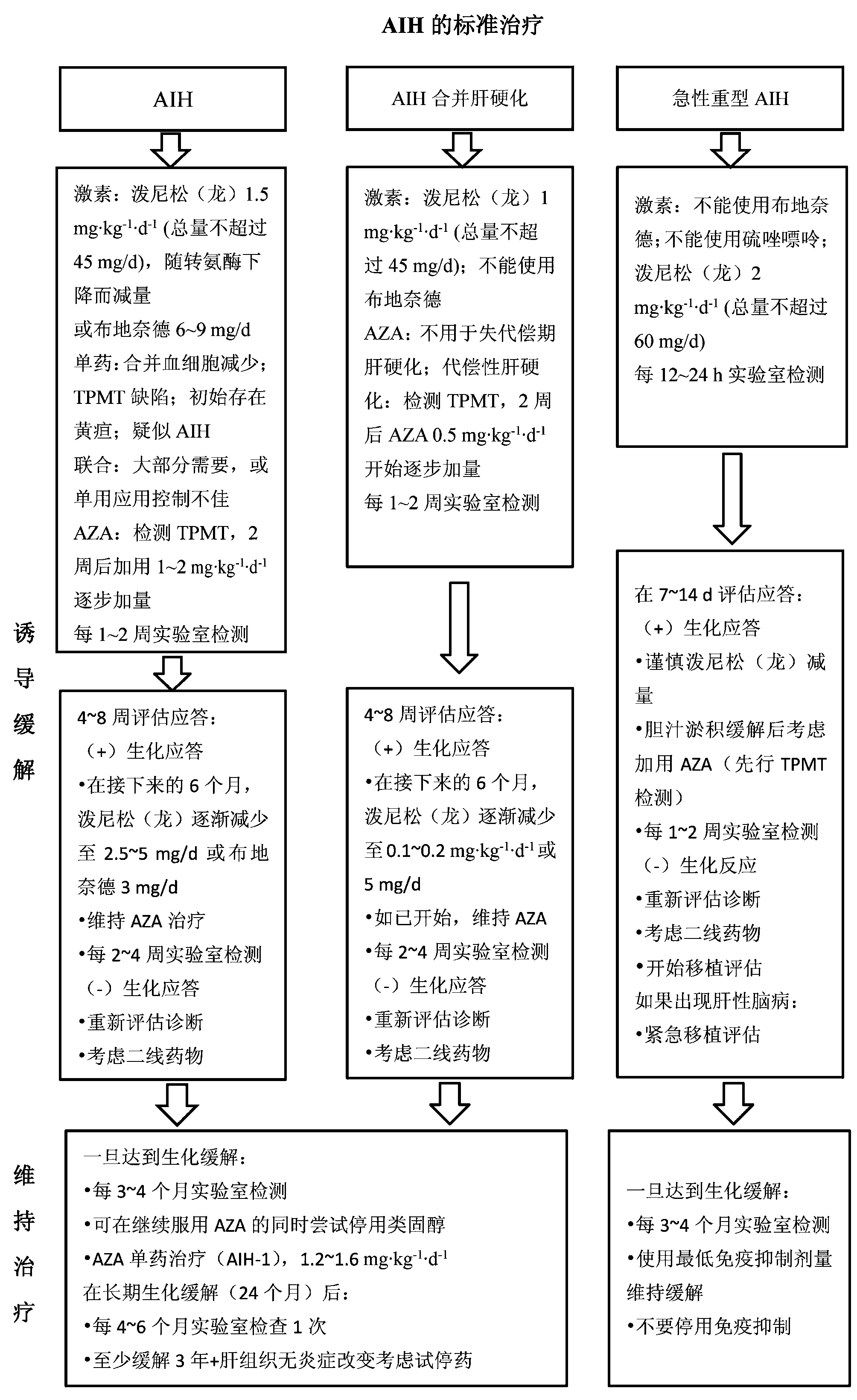
图1AIH标准治疗流程图
2.2.2 用于难治病例 霉酚酸酯(MMF)通过抑制淋巴细胞嘌呤从头合成抑制淋巴细胞增殖,诱导活化的T淋巴细胞凋亡,抑制黏附分子和诱导性一氧化氮合酶表达,抑制成纤维细胞增殖,促进Treg增殖和活化。MMF具有免疫抑制、抗炎及抗纤维化的作用。MMF作为AIH二线治疗总体疗效高,耐受性良好[44]。一项Meta分析[45]支持MMF作为对标准治疗无效的儿童AIH二线治疗的有效选择,不良反应低。MMF用法为20 mg·kg-1·d-1, 2次/d。如果持续缺乏反应或对MMF不耐受(头痛、腹泻、恶心、头晕、脱发和中性粒细胞减少),应考虑使用钙调磷酸酶抑制剂。
利妥昔单抗是一种人鼠嵌合抗CD20单克隆抗体,抑制B淋巴细胞增殖,抑制自身反应性B淋巴细胞、T淋巴细胞应答,促进调节性T淋巴细胞增殖。个别报道[46]应用利妥昔单抗治疗2例难治性AIH患儿成功的经验。尽管该药物的不良事件相对较低,但报道[47]与2.4%的AIH患儿败血症发生率相关。
英夫利昔单抗作为一种TNFα中和性抗体,拮抗TNFα的促炎作用,抑制细胞毒性T淋巴细胞增殖,诱导激活的淋巴细胞凋亡,减少记忆性CD8+T淋巴细胞数量,并且抑制T淋巴细胞分泌粒细胞巨噬细胞集落刺激因子。据报道[48],英夫利昔单抗治疗部分儿童难治性AIH有效,应注意严重感染的副作用及肝毒性。此外,TNFα抗体可引起类似于AIH的肝损伤[49]。推荐其应用于AIH之前,需更好地了解TNFα在AIH发病机制中的作用。
西罗莫司即一种在体内和体外选择性地扩增调节性T淋巴细胞的药物。AIH患者存在影响调节性T淋巴细胞的免疫调节缺陷。西罗莫司已用于4例难治性AIH患者,其中2例有短期疗效[50]。
2.3 爆发性肝衰竭 美国儿科研究发现,ALF儿童常存在自身抗体,阳性率为28%(自身抗体在AIH、不明原因的ALF、Wilson病均可存在)。自身抗体阳性和自身抗体阴性的患儿预后相似。在AIH中,抗LKM-1阳性的儿童发病年龄更小,更多接受肝移植[51]。爆发性肝衰竭起病的AIH的治疗是有争议的。在最近的一项儿科队列研究[29]中,泼尼松治疗使9例AIH-FHF患儿中的4例康复,另外5例尽管使用了类固醇,仍需要肝移植。印度的一项研究[52]报道了类固醇治疗的良好效果,13例急性重症AIH中10例(包括6例脑病患者)被泼尼松治疗挽救。
2.4 肝移植 肝移植对于有终末期慢性肝病的AIH以及对类固醇治疗无反应的严重ALF的AIH患者是一种治疗选择。2019年美国肝病学会[39]推荐急性重症AIH患者在糖皮质激素治疗1~2周内无实验室检查改善或临床恶化,应进行肝移植评估。AIH占儿童肝移植的4.9%[53]。AIH的移植率从9%~55%不等,出现症状和移植之间的间隔短至数天,长至诊断后数年[54]。近年美国儿童AIH移植的患者和移植物的5年存活率分别为91%和84%[55]。即使在使用免疫抑制剂的情况下,疾病仍可能复发[56],复发的平均时间为5年[57]。复发性AIH的诊断标准与原发性AIH相同,但因同时进行免疫抑制治疗或病程短而有些特征可能较少或不明显[58]。据报道[59]与移植后AIH再发相关的特征包括:受体拥有HLA-DR3或HLA-DR4、移植后停止使用皮质类固醇、自体肝在移植时炎症坏死的严重程度。大多数AIH复发的移植受者对再次应用或增加皮质类固醇的剂量和AZA有反应。其成功治疗在很大程度上依赖于早期诊断和及时治疗,而AIH肝移植后是否需要长期维持类固醇治疗存在争议[60]。
2.5 何时以及如何停止治疗 2年以上稳定的生化缓解是试验性停药的前提[7]。对于儿童的AIH,目前的建议是治疗至少2~3年,只有当转氨酶和IgG水平正常和自身抗体阴性至少1年方可尝试停止治疗。在决定停止治疗之前,应重复肝活检,因为如果有残余的炎症改变,即使血液检查正常,也可能复发[32]。按照这个标准,20%的AIH-1患者可以成功地长期完全停药,AIH-2患者则不能停药,45%的患儿停药可复发[34]。儿童AIH 患者诊断后5年内达到持续无免疫抑制剂下的缓解的可能性为41.6%,不能达到生化缓解的患者的基线特征为:国际标准化比值升高、pANCA阳性、肝硬化和有自身免疫性疾病肝外表现[61]。
儿童AIH的治疗除了标准的诱导缓解、维持治疗及对于不耐受或难治性患者的二线治疗方案外,还应重视治疗过程中的心理效应。研究[62]发现,儿童AIH患者的生活质量较正常儿童下降.与腹痛、激素的剂量密切相关。该病无肝硬化的生存期与普通人群相比差异无统计学意义,但有肝硬化的AIH患者的病死率和肝移植风险则显著升高[63]。
3 小结
综上所述,儿童AIH的诊断与治疗已取得了一定的进展。但是多中心大样本的中国儿童AIH的特点有待总结,新的诊断标准需要验证。AIH的发病机制有待进一步阐明,从而进一步建立儿童规范化、个体化的治疗方案。
