GRHL2沉默对肺癌A549细胞增殖及凋亡的影响
2020-04-20魏明莉黄娜
魏明莉 黄娜
成都医学院第一附属医院呼吸内科610500
肺癌是全球头号癌症杀手,严重威胁着人类的生存健康。2018年Bray等[1]对全球癌症数据的统计表明,肺癌是发病率和病死率第1位的恶性肿瘤。同时,肺癌的发病率和病死率居我国所有恶性肿瘤之首[2]。其中肺腺癌的发病率越来越高,是我国最常见的肺癌病理类型。肺癌是一种基因性疾病,癌基因的激活或抑癌基因的失活导致细胞异常增殖和凋亡障碍是肺癌发生的关键,也是癌细胞产生耐药性的机制之一[3]。近年来,越来越多的研究发现GRHL2在乳腺癌、结直肠癌、胃癌等肿瘤的发生、发展中起着重要的调节作用[4-6],但GRHL2在肺癌细胞中的作用尚未完全明确。为进一步阐明GRHL2在肺癌中的作用,本研究通过慢病毒介导的GRHL2沉默表达,初步探讨GRHL2沉默对肺癌A549细胞细胞增殖及凋亡的影响。
1 材料与方法
1.1 材料 肺癌A549细胞株及293T细胞由成都医学院第一附属医院中心实验室惠赠。胎牛血清购自美国Thermo Scientific公司。GRHL2兔多克隆抗体购自英国Abcam公司,β-actin兔多抗购自美国CST公司,辣根过氧化物酶标记的山羊抗兔二抗购自武汉博士德公司。CCK-8试剂盒购自日本Dojindo公司。Annexin V-APC/PI细胞凋亡检测试剂盒购自中国南京凯基生物科技公司。实时定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qRT-PCR)逆转录及荧光定量试剂盒购自美国BIO-RAD公司。GRHL2及β-actin引物由上海生物工程有限公司合成。
1.2 方法
1.2.1 GRHL2沉默慢病毒稳定细胞株的构建根据Genebank中报道的人GRHL2基因的核苷酸序列(NM_024915),参照siRNA设计原则,设计一条19 nt寡核苷酸的特异性siRNA靶序列(5'-TTCAAAGCAGATGAAAGAA-3'),合成sh RNA,sh RNA转录模板如下。正向引物:5'-CCGGCCTTCAAAGCAGATGAAAGAACTCGAGTTCTTTCATCTGCTTTGAAGGTTTTTG-3',反向引物:5'-AATTCAAAAACCTTCAAAGCAGATGAAAGAACTCGAGTTCTTTCATCTGCTTTGAAGG-3'。sh RNA模 板中的loop结 构选用CTCGAG,sh RNA的转录终止序列采用T6结构。正向引物模板5'端添加了CCGG,与AgeⅠ酶切后形成的粘端互补;反向引物模板5'端添加了AATT,与EcoRⅠ酶切后形成的粘端互补。采用GV248干扰载体构建GRHL2-sh RNA表达载体,使用AgeⅠ和EcoRⅠ双酶切GV248载体以使其线性化,之后利用T4连接酶将其与退火的双链oligo于16℃连接过夜,之后转化大肠杆菌菌株DH5α,挑取重组阳性克隆行PCR及测序鉴定,然后将GV248重组载体、p GC-LV载体、p Helper 1.0载体、p Helper 2.0载体制备慢病毒包装系统,转染293T细胞,包装成GRHL2沉默慢病毒,其对应的空载慢病毒由上海吉凯基因化学技术有限公司提供。
1.2.2 细胞培养及慢病毒感染 将A549细胞分为3个组,实验组:GRHL2沉默慢病毒感染的A549细胞系;阴性对照组:空载慢病毒感染的A549细胞系;空白对照组:不给予任何处理的A549细胞系。在感染前24 h,将处于对数生长期的A549细胞接种于6孔板中,培养过夜,待细胞的汇合度为30%~40%后,根据A549细胞的复感染指数,在实验组和阴性对照组中分别加入相应的病毒上清液,同时加入终浓度为8 mg/L的凝聚胺以增加感染效率,感染24 h后更换为含1 mg/L嘌呤霉素的培养基继续培养,每24 h采用倒置荧光显微镜观察绿色荧光的强度和细胞存活状态,在荧光显微镜下检测感染率,收取感染效率在80%以上的细胞作为目的细胞。
1.2.3 GRHL2表达的检测
1.2.3.1 q RT-PCR检 测GRHL2 mRNA表 达 取空白对照组、阴性对照组、实验组中细胞各1×106个,按照Trizol试剂盒说明提取总RNA,采用反转录试剂盒合成cDNA,然后以c DNA为模板,采用qRT-PCR检测3组细胞GRHL2 m RNA的表达水平,以β-actin为内参。反应条件:95℃30 s;95℃10 s,60℃30 s,40个循环。GRHL2正向引物5'-AGCCTGAGCACTGTGGAGTT-3',GRHL2反向引物5'-GCTGCTGGCCTGAATGTAAT-3';β-actin正 向 引 物5'-CCTGGCACC-CAGCACAAT-3',β-actin反向引物5'-GGGCCGGACTCGTCATAC-3'。相对基因表达水平用2-ΔΔCt分析法进行分析,ΔCt=目的基因Ct值-β-actin Ct值;ΔΔCt=各样品ΔCt-空白对照组ΔCt平均值。重复3次,取均值。
1.2.3.2 蛋白质印迹法(Western blot)检测GRHL2蛋白质的表达 收取空白对照组、阴性对照组、实验组中细胞各1×106个,提取总蛋白。通过BCA法进行蛋白定量,然后经常规10%SDS-PAGE凝胶电泳、转PVDF膜和蛋白印迹反应。GRHL2抗 体(1∶2 000)和 β-actin抗 体(1∶1 000)4℃孵育过夜,辣根过氧化物酶标记的山羊抗兔二抗(1∶2 000)室温孵育1 h后用ECL显色液曝光。重复3次,取均值。
1.2.4 CCK-8法检测细胞增殖 将处于对数生长期的3组细胞经胰酶消化后,完全培养基重悬制备成细胞悬液,每孔100μl细胞悬液接种于96孔板上(细胞计数:2×103/孔),每组3个复孔。将96孔板置于37℃、5%CO2培养箱培养1~6 d,每天固定时间于酶标仪下测量细胞生长状况。测量前,将10μl CCK-8试剂加入待测孔,轻轻振摇96孔板后,放入5%CO2细胞培养箱培养1.5 h。酶标仪测定在450 nm处的吸光度值。重复3次,取均值。
1.2.5 流式细胞术检测细胞凋亡 用不含EDTA的胰酶消化收集3组细胞,用冷PBS轻轻洗涤细胞2次,离心半径7 cm,2 000 r/min离心5 min,弃培养基后收集5×105个细胞,加入500μl的连接缓冲液用于重悬收集的细胞。先后加入5μl Annexin V-APC和5μl PI染液后混匀。室温下避光反应15 min。流式细胞仪检测细胞凋亡。重复3次,取均值。
1.3 统计学分析 采用Origin 8.0统计软件,计量资料以表示,多组间比较用单因素方差分析,2组间比较用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 慢病毒稳定细胞株荧光显微镜下观察结果各组细胞荧光显微镜下观察绿色荧光蛋白(green fluorescent protein,GFP)表达结果见图1。阴性对照组、实验组的细胞中GFP表达比例达80%以上,而空白对照组细胞中无GFP表达。
2.2 qRT-PCR、Western blot验证GRHL2在人肺腺癌A549细胞中沉默表达成功 各组细胞中GRHL2的m RNA表达水平如图2所示,结果发现:实验组中A549细胞的GRHL2 mRNA表达水平较空白对照组显著下降(t=0.48,P<0.05),而阴性对照组中A549细胞的GRHL2 m RNA表达水平无明显变化(t=0.81,P>0.05)。通过Western blot分析,同样发现实验组中GRHL2的蛋白质表达水平相比空白对照组和阴性对照组均明显下降(F=42.57,P<0.05),而空白对照组和阴性对照组GRHL2蛋白质表达水平差异无统计学意义(t=1.24,P>0.05),见图3。

图1 各组细胞绿色荧光蛋白的表达情况 ×200

图2 各组A549细胞中GRHL2 m RNA的表达变化
2.3 GRHL2沉默抑制人肺腺癌A549细胞增殖 采用CCK-8检测细胞的生长情况,根据细胞的生长状况,绘制细胞增殖曲线图(图4)。结果显示,A549细胞培养2 d,实验组细胞的增殖速度下降,但3组比较差异无统计学意义(F=2.13,P>0.05),而在3~6 d,实验组较阴性对照组、空白对照组细胞生长明显抑制(F=65.64,P<0.05)。在3~6 d,阴性对照组与空白对照组细胞增殖速度差异无统计学意义(t=0.75,P>0.05)。

图3 各组A549细胞中GRHL2蛋白的表达变化
2.4 GRHL2沉默促进人肺腺癌A549细胞凋亡 采用流式细胞仪对3组细胞凋亡率进行检测,实验组细胞凋亡率明显高于阴性对照组及空白对照组,差异有统计学意义(F=56.76,P<0.05),见图5、6。阴性对照组和空白对照组细胞凋亡率较低,2组之间差异无统计学意义(t=1.08,P>0.05)。
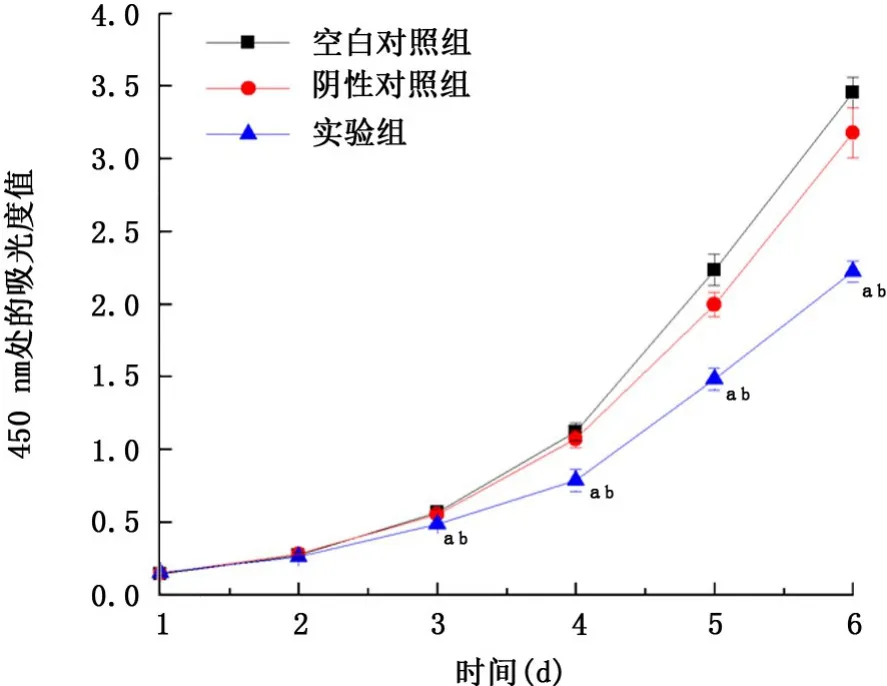
图4 GRHL2沉默对A549细胞增殖能力的影响

图6 GRHL2沉默对A549细胞凋亡的影响
3 讨论

图5 流式细胞术检测3组细胞凋亡情况 A:空白对照组;B:阴性对照组;C:实验组
肺癌早期症状不典型,大部分在确诊时已处于中晚期,失去手术治疗的机会,化疗及放疗是目前肺癌治疗的主要方法,但已达瓶颈期,无突破性进展。基因靶向治疗为肺癌治疗提供了新的方式。慢病毒是一种功能强大逆转录病毒,它可以将目的基因安全有效的植入到宿主细胞DNA中,可感染或转染几乎所有的哺乳类动物细胞,并在其中持续稳定的表达[7],起到了很好的基因治疗效果。因此,在各种体内外实验中,它成为了基因递送最有效的载体之一,在肿瘤的分子靶向研究方面获得了广泛的应用[8-10],为肿瘤的基因靶向治疗提供了更广阔的前景。
GRHL是哺乳动物所具有的一种似果蝇粒状头样转录因子,目前发现,GRHL家族包括GRHL1/2/3 3种亚型,它们表现出序列和生物化学方面的相似性[11-12]。其中GRHL2参与多种肿瘤的发生、发展。GRHL2通过转录调控靶基因,如端 粒 酶、P63、Wnt、TGF-β、mir200、ZEB1、OVOL2、p300等,在细胞增殖和分化中起到独特作用[13]。GRHL2沉默表达显著抑制体外细胞增殖和体内肿瘤的发生,其分子机制涉及对ZEB1和E-cadherin的调控作用[14]。目前GRHL2与肺癌的研究较少,有文献报道GRHL2通过调节RhoG转录活性抑制非小细胞肺癌转移[15]。
本研究将GRHL2沉默慢病毒感染肺腺癌A549细胞,通过荧光显微镜观察GFP表达情况,表明GRHL2沉默慢病毒及其空载慢病毒成功感染A549细胞并稳定表达,并经q RT-PCR和Western blot验证,对照组慢病毒感染A549细胞对GRHL2表达无明显影响,建立了GRHL2沉默慢病毒A549稳定细胞株。同时,本研究通过体外实验证实对照组慢病毒感染对A549细胞增殖、凋亡无明显影响,而GRHL2沉默抑制A549细胞的增殖,促进其凋亡。Paltoglou等[16]研究表明,GRHL2促进前列腺癌的生长,敲低GRHL2抑制前列腺癌细胞增殖。Kang等[17]发现敲除GRHL2基因使h TERT启动子活性显著降低,减少端粒酶活性和抑制口腔鳞状细胞癌的增殖能力。Faddaoui等[18]研究表明,抑制GRHL2基因的表达,抑制卵巢癌细胞的增殖、侵袭、迁移。但是,Xiang等[19]研究表明,GRHL2明显降低c-Myc和Bcl-2蛋白的表达水平,抑制胃癌细胞增殖。Werner等[20]研究表明,GRHL2在乳腺癌中具有双重调节作用,既可以促进乳腺癌细胞的增殖,又可以抑制EMT相关乳腺癌细胞的生长。本研究结果与前三项研究[16-18]一致,而与Werner等[20]相悖。产生这一差异的原因可能是GRHL2在不同肿瘤细胞中,甚至在同一肿瘤细胞中发挥不同的作用,其具体机制仍有待进一步研究。
综上,本研究发现,慢病毒介导的GRHL2沉默表达抑制了肺癌A549细胞的增殖,促进其凋亡,由此可见GRHL2对肺癌细胞的生长具有重要的调节作用,但其作用机制尚不明确。笔者将进一步通过体内实验验证GRHL2对肺癌的影响,以期为肺癌的治疗提供新的分子靶标。
利益冲突所有作者均声明不存在利益冲突
