NADPH氧化酶4与非小细胞肺癌上皮间质转化的相关性研究
2020-04-20李艳胡进秀崔节达郝斌威郝永发张红陈娟
李艳 胡进秀 崔节达 郝斌威 郝永发 张红 陈娟
1宁夏医科大学,银川750004;2宁夏医科大学总医院呼吸与危重症医学科,银川750004;3广州医科大学510000
根据2014年恶性肿瘤死亡数得出死亡前十位恶性肿瘤依次是肺癌、肝癌、胃癌、食管癌、结直肠癌、胰腺癌、乳腺癌、脑肿瘤、白血病、淋巴瘤。肺癌是最常见的死亡原因,2014年,我国新发肺癌约78.1万,死亡病例约62.6万,居同期恶性肿瘤死亡原因第1位[1]。2017年全球预计新增癌症病例16.8万,癌症死亡60万例,其中肺癌死亡人数占全部癌症死亡总数的12%左右[2]。非小细胞肺癌(non-small-cell lung cancer,NSCLC)是肺癌的主要组成部分,对于晚期NSCLC,化疗、靶向治疗和新兴免疫治疗仍是主要治疗手段,但5年相对生存率仅为19.7%[3-4]。造成肺癌患者死亡的主要原因之一是肺癌的远隔脏器的转移[5-6]。研究发现相比局部和/或远隔转移的早期肺癌相比,晚期肺癌的生存率仅为19.7%[4],明显降低。因此深入研究肺癌的转移机制,探索可能的早期干预靶点是肺癌防控工作的重点,也是改善肺癌生存率的关键。
上皮间质转化(epithelial mesenchymal transformation,EMT)是上皮细胞失去细胞与细胞间连接,丧失上皮细胞的极性,细胞失去上皮细胞特性而获得间质细胞的特质,具备迁移和侵袭能力的一个过程[6-8]。EMT是胚胎发育、创伤愈合重要的组织修复过程,同时也是器官纤维化和癌症进展的重要过程[6-8]。在肿瘤细胞的发生发展中,癌细胞可以通过EMT逃离原有的癌灶,侵入周围组织,并通过血液或淋巴途径在远处定植,从而产生转移[6,9-10]。EMT的发生和发展使肿瘤细胞极性丧失,降低细胞与细胞间黏连,细胞骨架重组,上皮表型的标志物如E-钙粘连蛋白(E-cadherin,E-Ca)下调,间质表型的标志物如N-钙粘连蛋白(N-cadherin,N-Ca)等上调,增强了肿瘤细胞抵御凋亡的能力。越来越多的证据表明EMT在许多病理生理过程中发挥重要作用[11]。转化生长因子β1(transforming growth factor-β1,TGF-β1)及其下游信号通路是EMT重要的诱导因子[12]。TGF-β1在肿瘤进展中有两方面作用,在肿瘤起始,TGF-β1作为抑制因子诱导细胞分化和凋亡,阻止不可控的增殖和凋亡;而在癌症晚期,TGF-β1/TGF-β受体Ⅱ型/TGF-β受体Ⅰ型复合体诱导smad依赖和smad非依赖通路驱动EMT重构,导致肿瘤转移[13-14]。
正常条件下,细胞内活性氧(reactive oxygen species,ROS)在细胞生长、分化等生理过程中起着重要的作用,并且作为第二信使参与信号传导机制。但过量的ROS聚集就会造成氧化/抗氧化失衡并由此产生氧化损伤[15-16]。NADPH氧化酶(nicotinamide adenine dinucleotide phosphate oxidase,NOX)是体内ROS的主要来源,是一类质膜相关的酶蛋白家族,由DUOX1-2、NOX1-5 7个家族成员组成,其中NOX4分布最为广泛,尤其在肺脏表达尤为丰富,研究证明:NOX4在人肺成纤维细胞、肺动脉血管平滑肌细胞、肺气道平滑肌细胞及肺泡上皮细胞中均有不同程度的表达[17-18]。研究表明,TGF-β1在人类胰腺癌细胞中表达升高,进而诱导NOX1和NOX4的表达,增加细胞内ROS的水平。与此同时,伴随E-Ca表达降低和N-Ca表达升高,以及EMT进程相关的转录因子如Snail等的表达变化,提示EMT参与胰腺癌的发生、发展,且NADPH氧化酶与EMT相关[19]。此外,多量研究发现,TGF-β介导的细胞EMT与ROS的产生相关[19-21]。因此,本研究拟探讨:NSCLC是否存在EMT现象及肺癌EMT的发生与NOX4的相关关系。
1 对象与方法
1.1 研究对象与分组 选取2015~2018年在宁夏医科大学总医院年龄范围为38~75岁病理确诊的NSCLC患者的石蜡包埋手术标本和或纤支镜取材肺组织标本为肺癌组(29例),病理切片HE染色后,再经2名病理执业医师双盲法二次复核诊断。肺癌的分类依据最新(2015)WHO肺癌分类方法,相关分期按照IASLC分期方法[22]。选取同期入院年龄范围为30~80岁病理确诊的肺部良性病变石蜡包埋手术标本和或纤支镜取材组织标本为对照组(20例),经HE染色病理切片证实为良性病变。所有石蜡包埋标本均取自宁夏医科大学病理科。
本研究经宁夏医科大学总医院科研伦理委员会批准(2019-447),获得患者知情同意书。
1.2 试剂 兔抗NOX4抗体购自美国Novus公司,兔抗E-Ca抗体购自美国CST公司,兔抗Vimentin抗体购自美国Abcam公司,山羊抗兔、兔辣根过氧化物酶抗体、血清封闭液等免疫组化试剂购自北京中杉金桥生物有限公司。
1.3 研究方法 免疫组织化学检测肺组织内NOX4、E-Ca、波形蛋白(Vimentin)的表达,肺组织切片经脱蜡、水化、高压修复5 min后待修复液自然冷却,3% H2O2清除内源性过氧化物酶,山羊血清封闭1 h,一抗4℃过夜孵育(1∶200稀释NOX4抗体,1∶200稀释E-Ca抗体,1∶250稀释Vimentin抗体);次日37℃复温1 h后,滴加二抗37℃孵育30 min,DAB显色(显微镜下监测)、苏木素复染、梯度酒精脱水、二甲苯透明、封片、镜下采图。阴性对照以PBS代替一抗。每张切片随机选取5个视野,采用Image.J软件对肺组织切片进行分析,求得每个视野下NOX4、E-Ca及Vimentin蛋白着色的平均光密度值(average optical density,AOD)后进行统计学分析。
1.4 统计学分析 应用SPSS 22.0软件进行统计学分析。计量资料以表示,方差齐性检测后结果比较采用两组独立样本t检验;计数资料以例数(百分比)表示,结果比较采用χ2检验、Fisher确切概率法及Spearman相关分析。检验水准P<0.05为差异有统计学意义。
2 结果
2.1 肺癌组与对照组一般情况比较 收集2015~2018年宁夏医科大学总医院病理确诊的NSCLC 29例。其中,男21例,女8例;年龄(54.67±8.63)岁,年龄范围为38~75岁(其中<60岁者15例,≥60岁者14例);吸烟者16例,不吸烟者13例;无淋巴结转移者18例,有淋巴结转移者11例;组织学分型腺癌13例(其中高中分化4例,低分化9例),鳞癌16例(其中高中分化3例,低分化13例)。选取同期病理确诊的20例肺部良性病变组织作为对照(其中肺结核6例,炎性肿块8例,良性囊变2例,3例血管瘤,1例错构瘤)。2组一般情况比较见表1。
2.2 肺癌组及对照组EMT相关蛋白及NOX4蛋白的表达情况 免疫组织化学结果示:E-Ca主要表达部位为细胞的胞膜,E-Ca蛋白在肺癌组及对照组肺组织中表达的平均光密度值分别为(5.15±6.67)和(14.97±7.68),2组比较差异有统计学意义(t=-4.819,P<0.001);Vimentin主要表达部位为细胞胞浆及间质,Vimentin在肺癌组及对照组肺组织中表达的平均光密度值分别为(26.42±8.40)和(11.66±8.30),2组比较差异有统计学意义(t=6.078,P<0.001)。NOX4主要表达部位为细胞胞浆及胞核,NOX4在肺癌组及对照组肺组织表达的平均光密度值分别为(29.36±11.60)和(11.27±7.36),2组比较差异有统计学意义(t=6.160,P<0.001)。见图1。
2.3 NOX4蛋白表达与NSCLC患者临床参数之间的相关关系 肺癌组NOX4蛋白表达的阳性率为79.3%(23/29),阴性率为20.7%(6/29),NOX4蛋白的表达与肿瘤分化程度密切相关(P=0.018);而与性别、年龄、吸烟史、肿瘤分期及淋巴结转移无相关性(P值均>0.05),表2。
2.4 2组NOX4与E-Ca及Vimentin蛋白表达的相关性 肺癌组NOX4蛋白的表达与E-Ca的表达呈负相关性(r=-0.612,P=0.001),NOX4的表达与Vimentin的表达呈正相关性(r=0.593,P=0.001);在对照组,NOX4蛋白的表达与E-Ca的表达无相关性(r=0.101,P=0.671),NOX4与Vimentin的表达无相关性(r=0.109,P=0.649),见图2。

表1 肺癌组及对照组一般情况比较

表2 非小细胞肺癌患者中NOX4表达与临床病理参数之间的关系(例)
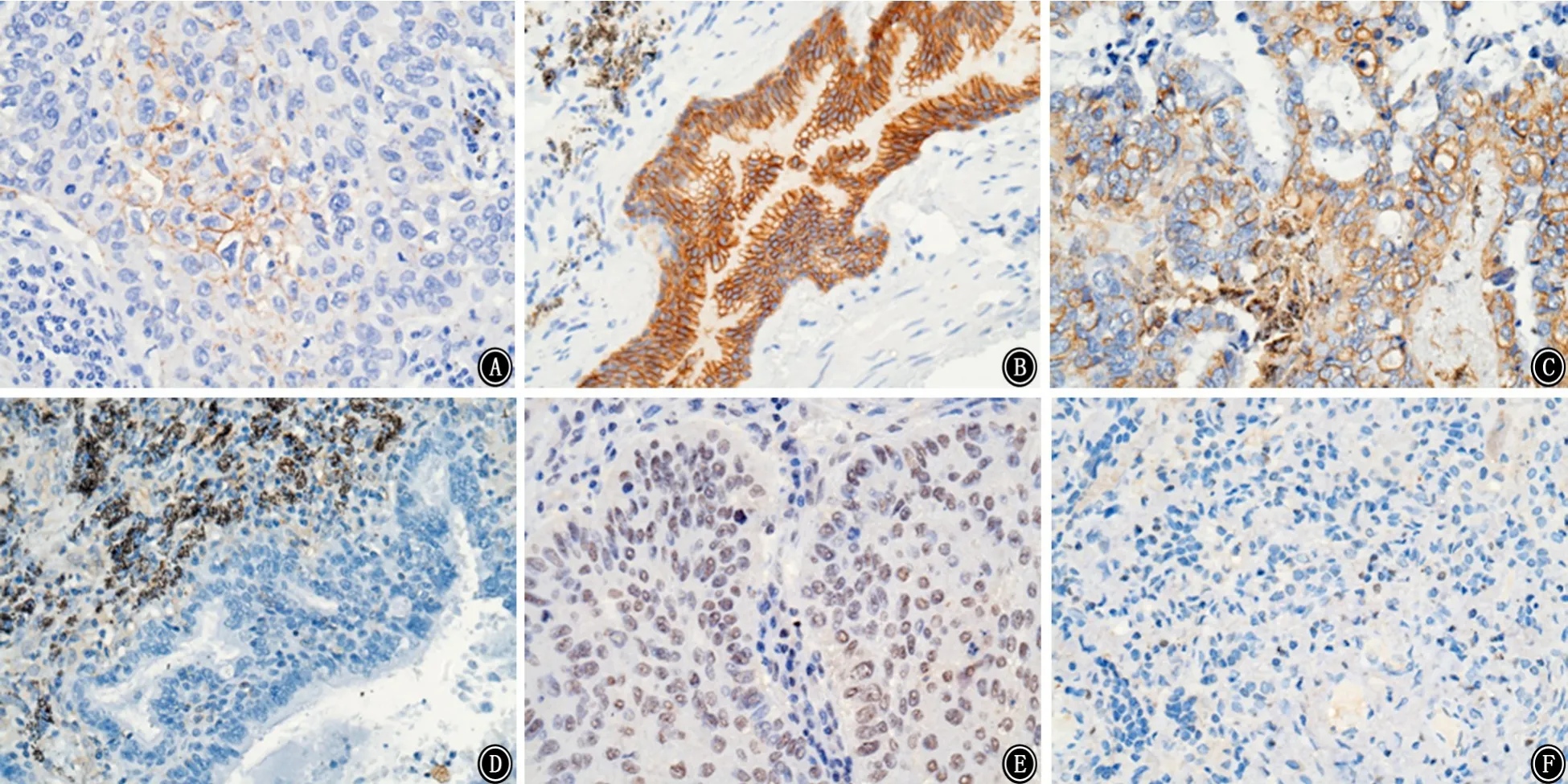
图1 2组肺组织上皮间质转化相关蛋白及NADPH氧化酶4表达的病理图片 免疫组织化学染色 ×400 A:肺癌组E-钙粘连蛋白的表达;B:对照组E-钙粘连蛋白的表达;C:肺癌组波形蛋白的表达;D:对照组波形蛋白的表达;E:肺癌组NADPH氧化酶4的表达;F:对照组NADPH氧化酶4的表达

图2 2组NOX4与E-Ca、Vimentin表达的相关性 A:肺癌NOX4与Vimentin表达的相关性;B:肺癌组NOX4与E-Ca表达的相关性;C:对照组NOX4与Vimentin表达的相关性;D:对照组NOX4与E-Ca表达的相关性
3 讨论
肺癌是严重危害人类生命健康的恶性肿瘤之一,也称为当今世界范围内最常见的恶性肿瘤。虽然NSCLC的治疗在手术、放疗、化疗与靶向治疗中都取得了一定的进展,但五年生存率仍低,由于NSCLC缺乏典型的临床表现,往往在初次诊断时多已经是晚期[2]。
越来越多的证据表明EMT参与肿瘤的复发和转移[11]。EMT可分为3型,其中Ⅰ型EMT,主要发生在胚胎和胎儿发育期间,诱发上皮胚胎细胞发育进入间充质结构反映其在胚胎发生[23-24]。Ⅱ型EMT是自然发生的正常伤口愈合,本质上不是病理性的过程[25]。Ⅲ型EMT本质上是具有病理性的,由于新生血管的形成而与Ⅱ型EMT有过不同。Ⅲ型EMT与许多纤维化疾病有关,如肺纤维化[26]、肾纤维化[27]和眼纤维化[28];同时与乳腺癌、肺癌、和胃癌等癌症疾病也密切相关[29]。肺组织上皮细胞在受到外界因素比如空气污染中的苯并芘、PM2.5以及香烟中的尼古丁等致癌物质刺激后,细胞在癌变的过程中经历EMT进程,细胞表型发生变化[30],上皮细胞标志比如E-Ca、紧密连接蛋白等表达下降甚至丢失,同时间质细胞标志蛋白比如N-Ca、Vimentin、纤连蛋白、细胞角蛋白等表达升高,上皮细胞更多的具有间质细胞的特征[31-32],本研究结果显示上皮表型的标志物E-Ca在NSCLC患者肿瘤组织中表达降低,而间质表型的标志物Vimentin在NSCLC患者肿瘤组织中表达增高,且E-Ca和Vimentin的异常表达与NSCLC肿瘤病理类型无关,提示EMT参与了NSCLC不同类型肿瘤的发生、发展。
ROS在肿瘤的发生、生长、增殖、凋亡和迁移中起着重要的作用,ROS在体内的作用主要分为两方面:有益的一方面是其可以作为第二信使,传递转导细胞内的生物信号,调节细胞的增殖、凋亡、分化、迁移以及黏附等生理过程,还可以清除入侵体内的微生物,起到防御功能;有害的一方面是大量ROS使机体组织遭受氧化损伤,造成疾病发生[33]。在哺乳动物机体细胞内,ROS主要来源于NADPH氧化酶[34]。研究发现,在TGF-β过量存在时,NOX家族蛋白高表达以及ROS水平增加,细胞会发生EMT进程,最终促进细胞的迁移[35-37]。研究表明:氧化剂可以诱导TGFβ1上调NOX4,进而再产生ROS,诱导肺纤维母细胞向肌成纤维细胞转化进而引起纤维化进程[32]。本研究结果显示:NOX4在NSCLC患者肿瘤组织中表达增高。并且NOX4蛋白表达与患者肿瘤低分化程度有显著相关性,NOX4蛋白的表达与E-Ca的表达呈负相关性,NOX4的表达与Vimentin的表达呈正相关性,以上实验结果说明NOX4可能在NSCLC EMT的发生、发展中发挥重要作用。
综上,NSCLC组织存在以上皮表型向间质表型转化的EMT。同时,伴有NOX4的高表达,且NOX4的表达与肿瘤分化程度相关。提示NOX4介导的ROS可能参与到肺癌细胞EMT的发展过程。
利益冲突所有作者均声明不存在利益冲突
