羊肚菌液体发酵的集硒特性及生物活性物质研究
2020-01-21向戌莲周大寨冉青刘信平张驰
向戌莲 周大寨 冉青 刘信平 张驰


摘要:【目的】研究羊肚菌液体发酵培养条件,以及随硒浓度变化菌丝中活性物质的变化规律,为羊肚菌的集硒特性及其生物活性物质研究提供参考依据。【方法】以亚硒酸钠为无机硒源,以羊肚菌菌丝将无机硒转化为有机硒的硒源利用率为评价指标,采用正交试验对液体培养条件进行优化。利用水提醇沉法和Sevage法对多糖进行提取及纯化,蛋白质采用磷酸缓冲液提取,并对不同溶解性蛋白进行提取,以硫酸铵沉淀和透析法进行纯化;使用原子荧光法测定硒含量。采用试剂盒测定菌丝总超氧化物歧化酶(T-SOD)活力、过氧化物酶(POD)活性、多酚氧化酶(PPO)活性及脯氨酸(Pro)含量。【结果】羊肚菌菌丝富集有机硒深层发酵的最佳培养条件为:硒浓度25 μg/mL、培养温度24 ℃、培养时间5 d、装液量200 mL,在此条件下,亚硒酸钠转化为菌丝有机硒的硒源利用率为1.85%。4个因素影响排序为:硒浓度>培养天数>培养温度>装液量。硒浓度为20 μg/mL时多糖集硒效果较好,硒浓度为30 μg/mL时蛋白集硒效果较好。碱溶性和盐溶性蛋白的集硒能力更强,且集硒蛋白大多在30%硫酸铵饱和度时沉淀。相较于未加硒组(0 μg/mL),加硒组菌丝有更强的抗氧化活性。硒浓度在50 μg/mL以内,硒浓度的增加促使T-SOD活力不断增强;硒浓度的增加则抑制POD活性,但硒浓度超过30 μg/mL后POD活性略有回升;硒浓度对PPO活性有一定的抑制作用,且随硒浓度的增加呈先升后降的变化趋势。补硒能提高菌丝Pro含量,从而提高抗逆性,但超过30 μg/mL也会对其抗逆性产生负面影响。【结论】羊肚菌液体发酵菌丝的集硒特性良好,能产生更有利的活性物质,是一种有效的羊肚菌集硒方法。
关键词: 羊肚菌;菌丝;硒源利用率;硒多糖;硒蛋白;酶活性
中图分类号: S646 文獻标志码: A 文章编号:2095-1191(2020)10-2523-09
Selenium collecting characteristics and biological active substances in liquid fermentation of Morchella esculenta
XIANG Xu-lian, ZHOU Da-zhai, RAN Qing, LIU Xin-ping, ZHANG Chi*
(College of Biological Science and Technology,Hubei University for Nationalities/Key Laboratory of Biological Resources Conservation and Utilization of Hubei Province, Enshi, Hubei 445000, China)
Abstract:【Objective】This paper studied the liquid fermentation culture conditions of Morchella esculenta and the corresponding changes of the active substances in the mycelium with the change of selenium concentration,so as to provide reference for the research on the selenium collecting characteristics of M. esculenta and the research methods of their bioactive substances. 【Method】Sodium selenite was used as the inorganic selenium source,and the selenium source utilization rate of the transformation of inorganic selenium into organic selenium by the mycelium of M. esculenta was used as the index. Orthogonal analysis method was used to optimize the liquid culture conditions. Polysaccharides were extracted and preliminarily purified by water extraction,alcohol precipitation and Sevage,proteins were extracted by phosphoric acid buffer,and proteins with different solubilities were extracted by ammonium sulfate precipitation and dialysis. Sele-nium content was determined by atomic fluorescence spectrometry. The activity of mycelium of total superoxide dismutase(T-SOD),peroxidase(POD),polyphenol oxidase(PPO) and proline(Pro) were determined by kit method. 【Result】The optimum culture conditions for deep fermentation of organo-selenium-rich mycelium of M. esculenta were as follows:selenium concentration of 25 μg/mL,culture time of 5 d,culture temperature of 24 ℃,and loading volume of 200 mL. Under these conditions,the selenium source utilization ratio of sodium selenite to organic selenium in mycelium was 1.85%. And the order of the factors influencing the size was as follows: selenium concentration>culture days>culture temperature> loading liquid amount. When the selenium concentration was 20 μg/mL, selenium collecting ability of polysaccharide was strong, and when the selenium concentration was 30 μg/mL, selenium collecting ability of of protein was strong. Alkali-soluble and salt-soluble proteins had stronger selenium collecting ability,and most of the selenium protein precipitated at the saturation of 30% ammonium sulfate. Compared with the selenium-free group(0 μg/mL),selenium group showed stronger antioxidant activity. Within 50 μg/mL of selenium concentration,the increasing concentration of selenium conti-nuously enhanced the activity of T-SOD. The increase of selenium concentration inhibited the POD activity,but when the selenium concentration exceeded 30 μg/mL,the POD activity recovered. Selenium concentration had a certain inhibition on PPO activity,the inhibition effect with the increase of selenium concentration first increased and then decreased. Selenium supplementation could improve the content of mycelium Pro,thus improving the stress resistance,but the selenium supplementation concentration over 30 μg/mL would also have negative impact on its stress resistance. 【Conclusion】The liquid fermentation mycelium of M. esculenta has good selenium collecting characteristics and can produce more favora-ble active substances,which is an effective selenium collecting method of M. esculenta.
Key words: Morchella esculenta; mycelium; selenium source utilization rate; selenium polysaccharide; selenoprotein; enzyme activity
Foundation item: National Natural Science Foundation of China(81402225); Special Project of the Central Government to Guide Local Science and Technology Development(2016); Key Science and Technology Project of Enshi(D2017 0039); Open Fund Project of Hubei Engineering Research Center for Selenium Food Nutrition and Health(PT082008)
0 引言
【研究意义】羊肚菌是子囊菌中最著名的美味食用菌,有“素中之荤”的美称(刘书畅等,2018)。羊肚菌富含多糖和蛋白,可有效抑制脂褐质的形成,具有增强机体免疫力、抗疲劳、抗病毒和抑制肿瘤等多种功效(段巍鹤等,2015;李卫东,2018)。硒的生物有机化主要通过动物、植物和微生物转化无机硒生产有机硒(梁克红等,2018;赵谋明等,2019)。对于羊肚菌富硒,生物吸附硒元素并通过菌丝细胞内的物质代谢转化,将无机硒吸收并与大分子活性物质结合,最终以硒蛋白或硒多糖等有机硒的形式存在(胡海涛等,2012;徐巧林等,2017;朱燕云等,2018)。硒多糖兼具硒和多糖的生理功能,硒蛋白兼具硒和蛋白的生理功能。羊肚菌在自然条件下较易富硒,相对于其他食用菌其具有更强的集硒能力,氨基酸含量为食用菌之首(丁健峰等,2013)。羊肚菌子实体较难培育,可培育种类较少,相较于羊肚菌大规模人工栽培,羊肚菌菌丝体液体培养具有生长速度快、高效经济、适合工业化生产等特点,因此更适合液体发酵大量培育发酵产物。此外,液体发酵培养的食用菌菌丝体与其子实体在化学組成和生理功能方面均很相似(李文佳等,2017)。因此,通过菌丝液体发酵得到羊肚菌有效物质,并研究硒对其活性物质的影响,对开展羊肚菌精深加工具有重要意义。【前人研究进展】至今,国内已有不少学者对其影响羊肚菌生物量的培养条件及其抗氧化活性等进行探索、优化和研究。孟凡云(2010)对羊肚菌胞内硒多糖的抗氧化活性进行研究,结果表明胞内硒多糖具有较强的体内和体外抗氧化能力。丁建峰(2014)以羊肚菌富硒深层发酵技术优化了羊肚菌生物量的工艺参数,并初步分析其硒多糖的结构。张丽(2014)、侯玉艳等(2015)对黑脉羊肚菌抗氧化指标的酶性质进行研究,根据热稳定性、pH稳定性和敏感性可推断超氧化物歧化酶(SOD)的类型。何亚(2015)提取了羊肚菌蛋白,测定其溶解度随温度、pH的变化,以及乳化和起泡随pH的变化;同时发现分离蛋白对DPPH自由基的清除效果最佳。冮洁等(2016)在优化羊肚菌菌丝富硒培养条件的同时,证实羊肚菌多糖具有较强的体外抗氧化活性。张强等(2017)将提取的羊肚菌蛋白在菌体外进行硒化修饰,得到具有更高体外抗氧化活性的羊肚菌硒蛋白。【本研究切入点】羊肚菌富硒的液体发酵技术虽然日渐成熟,但鲜见探究无机硒对羊肚菌菌丝生长发育及生理生化特性影响的研究报道,因此有必要在研究深度上更进一步,为富硒羊肚菌液体培养条件优化及其功能活性物质研究提供数据基础。【拟解决的关键问题】研究外源无机硒添加量与羊肚菌菌丝液体培养获得有机硒的关系,确定最佳硒源利用率下的液体培养条件,并探究不同硒浓度对羊肚菌活性物质的影响,为羊肚菌高效富硒分子领域研究及精深加工方面提供科学参考。
1 材料与方法
1. 1 试验材料
羊肚菌斜面菌种购自周玉麟食用菌技术研究所。马铃薯为市购;葡萄糖、磷酸二氢钾和硫酸镁均为国产分析纯,琼脂粉为生物试剂,亚硒酸钠、硝酸、盐酸、氢氧化钾和硼氢化钾均为国产优级纯;硒标液购自中国计量科学研究所,试剂盒购自南京建成生物工程研究所。主要仪器设备:样品粉碎机(台湾弘荃机械企业有限公司);单通道可调节移液[大龙兴创实验仪器(北京)有限公司];GXZ-9140数显鼓风干燥箱、DGX型电热鼓风干燥箱、HHS型电热恒温水浴锅和BOXUN立式压力蒸汽灭菌锅(上海博迅实业有限公司医疗设备厂);TDL-802B低速台式离心机(上海安亭科技仪器公司);ME204E电子天平(梅特勒—托利多仪器有限公司);MARS6微波消解仪(美国CEM公司);UPH-I-20T型超纯水制造系统(成都超纯科技有限公司);DF-101S恒温加热磁力搅拌器(巩义市英峪仪器厂);SPX-30085H-11生化培养箱(上海新苗医疗器械制造有限公司);ZWYR-2102恒温振荡器(上海智城分析仪器制造有限公司);SJ-CJ-2FDQ超净工作台(苏州苏洁净化设备有限公司);真空冷冻干燥机(上海精宏实验设备有限公司);CARY 300Conc紫外可见分光光度计(美国Varian公司);AvantiRJ-30I高速冷冻离心机(美国Beckman公司);AFS-9760双道原子荧光光谱计(北京海光仪器公司);MuLtiskan Go-1510酶标仪(赛默飞世尔科技有限公司)。
1. 2 试验方法
1. 2. 1 菌种活化 羊肚菌斜面菌种置于25 ℃生化培养箱中培养24 h后,接种于固体综合PDA培养基上,于25 ℃生化培养箱中培养3~4 d。
1. 2. 2 硒母液配制 称取亚硒酸钠(纯度98%)1.1185 g,溶于100 mL超纯水中,配制成硒浓度为5000 μg/mL的亚硒酸钠母液,母液和PDA液体培养基分别灭菌后混匀。
1. 2. 3 单因素试验设计 进行10、20、30、40和50 μg/mL硒浓度预试验,以菌丝干重不低于未加硒组(0 μg/mL)为标准,确定硒浓度10~30 μg/mL为最终选择范围。以硒源利用率为评价指标进行单因素液体培养,设硒浓度10、15、20、25和30 μg/mL,培养温度24、25、26、27和28 ℃(李红等,2018),装液量100、150、200、250和300 mL(冮洁等,2016),培养时间2、3、4、5和6 d(丁健峰,2014)。培养完成后过滤菌丝,蒸馏水洗涤2遍,真空冷冻干燥,称重。根据GB 1903.22—2016《食品安全国家标准 食品营养强化剂 富硒食用菌粉》,用AFS-9760双道原子荧光光谱计测定羊肚菌粉中的有机硒含量(徐元芬,2017),再计算无机硒转化为菌丝有机硒的硒源利用率。计算公式如下:
硒源利用率(%)=[(C1-C2)×MC3×V]×100
式中,C1为总硒含量(μg/g),C2为无机硒含量(μg/g),C3为硒浓度(μg/mL),M为菌丝干重(g),V为装液量(mL)。
1. 2. 4 正交试验设计 采用4因素3水平正交试验优化羊肚菌的富硒培养条件。每个试验处理3次重复。正交试验因素与水平见表1。
1. 2. 5 硒多糖提取与测定 硒多糖提取:干燥菌丝→粉碎过筛→热水浸提(2次)→离心→醇沉过夜→沉淀复溶→Sevage法除蛋白→上清液即为硒多糖溶液。
硒多糖含量:采用硫酸蒽酮法进行测定。
多糖硒含量:取多糖待测液1 mL置于消解管中,按1.2.3中总硒的测定方法进行测定。
1. 2. 6 硒蛋白提取与测定 硒蛋白粗提取:干燥菌丝→粉碎过筛→加磷酸缓冲液→磁力搅拌→离心→上清液分级沉淀→静置过夜→离心→沉淀复溶→透析→得硒蛋白粗液。
不同溶解性硒蛋白提取:未加硒组和正交最优组的干燥菌丝→粉碎过筛→分别加蒸馏水、0.5 mol/L氯化钠溶液、0.1 mol/L氢氧化钾溶液和75%乙醇溶液→磁力搅拌→滤液酸化(醇提不酸化)→加硫酸铵沉淀(醇提加等体积水)→静置过夜→离心→沉淀复溶→透析→得不同溶解性(水溶性、盐溶性、碱溶性和醇溶性)硒蛋白溶液。
硒蛋白含量:采用考马斯亮蓝G-250法进行测定。
蛋白硒含量:取蛋白待测液1 mL置于消解管中,按1.2.3中总硒的测定方法进行测定。
1. 2. 7 不同硒浓度下活性物质特性测定 采用试剂盒对0、10、20、30、40和50 μg/mL硒浓度培养下的新鲜菌丝进行总超氧化物歧化酶(T-SOD)、过氧化物酶(POD)、多酚氧化酶(PPO)和脯氨酸(Pro)等物质活性或含量测定。
1. 3 统计分析
采用WPS Office 2020和SPSS 6.0对试验数据进行统计、制图和方差分析。
2 结果与分析
2. 1 单因素试验结果
2. 1. 1 硒浓度对羊肚菌菌丝培养的影响 硒浓度对羊肚菌菌丝干重的影响见图1。硒浓度低于20 μg/mL时,菌丝干重随硒浓度的增加而增加;硒浓度超过20 μg/mL后,菌丝干重呈下降趋势,且30 μg/mL后的菌丝干重低于未加硒组。说明在本研究条件下培养,羊肚菌菌丝的最大耐硒度在30 μg/mL左右,故选择10、15、20、25和30 μg/mL硒浓度进行硒源利用率的单因素试验。硒浓度对羊肚菌菌丝硒源利用率的影响见图2。随着硒浓度的增加,硒源利用率呈先上升后下降的变化趋势,在20 μg/mL时达最大值(0.29%),故确定20 μg/mL为最佳硒浓度。
2. 1. 2 培养温度对硒源利用率的影响 温度对氧气的溶解度会造成影响,与菌体的代谢及菌体代谢产物有着紧密联系。由图3可知,随着培养温度不断升高,羊肚菌菌丝硒源利用率呈先升后降的变化趋势,且在25 ℃时达最大值(0.17%)。此后培养温度越高,硒源利用率下降越快,说明高温致使溶氧下降,代谢产物的堆积抑制菌丝生长,与羊肚菌喜凉的特性吻合。因此,确定25 ℃为最佳培养温度。
2. 1. 3 培养天数对硒源利用率的影响 菌丝生长随培养时间的推移对应出现适应、对数生长、平衡和内代谢4个阶段,内代谢阶段甚至会发生自溶现象(丁建峰,2014)。由图4可知,培养前4 d羊肚菌菌丝硒源利用率不断升高,此阶段菌丝正生长,物质利用活跃,硒源利用率高;培养4 d后菌丝硒源利用率急剧下降,此阶段菌丝可能因为出现自溶现象,物质利用下降;培養6 d时自溶产生的少量空间促使硒源利用率略有回升。总体来看,培养4 d时硒源利用率最高,为0.82%,故确定培养4 d为最佳培养天数。
2. 1. 4 装液量对硒源利用率的影响 装液量不仅影响基础物质的提供,还影响液体培养过程中发酵液的溶氧状态。由图5可知,装液量在200 mL以下时,羊肚菌菌丝硒源利用率不断上升,在200 mL时达最大值(0.20%);装液量大于200 mL后,溶氧量减少,限制菌丝代谢,硒源利用率开始下降。故确定200 mL为最佳装液量。
2. 2 正交试验结果
根据单因素试验结果,对影响羊肚菌菌丝硒源利用率的4个因素进行3水平的正交优化试验。由表2可知,羊肚菌菌丝富硒培养条件优化方案为A3B1C3D2,即硒浓度25 μg/mL、培养温度24 ℃、培养天数5 d、装液量200 mL,在此条件下,硒源利用率为1.85%。各因素对羊肚菌菌丝富硒影响排序为:硒浓度>培养天数>培养温度>装液量,4个因素对羊肚菌菌丝硒源利用率均有极显著影响(P<0.01)(表3)。
2. 3 多糖试验结果
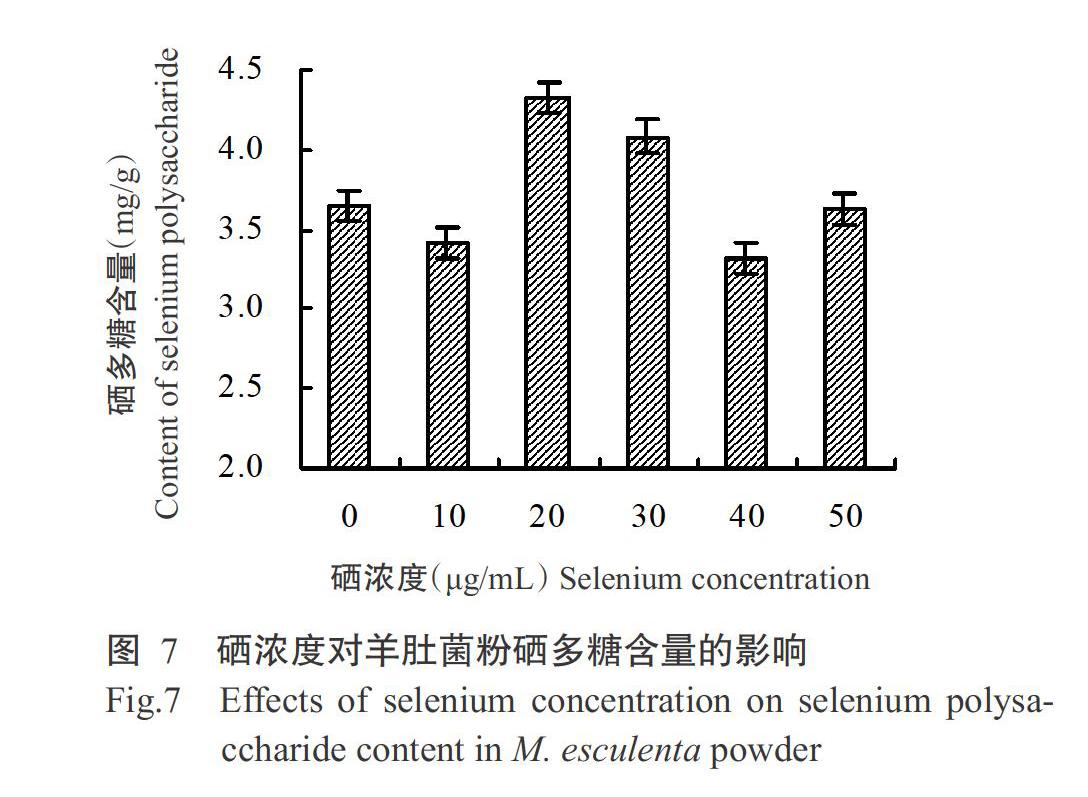
2. 3. 1 硒浓度对硒多糖含量的影响 以标准品葡萄糖浓度为横坐标,620 nm下测得的吸光值为纵坐标绘制标准曲线(图6)。相对于未加硒组而言,羊肚菌粉硒多糖含量有增有减,但随着培养液硒浓度的增加,菌粉硒多糖含量基本呈先升后降的变化趋势,硒浓度为20 μg/mL时,硒多糖含量达最大值(图7)。说明硒浓度变化在一定程度上会影响硒多糖含量变化。
2. 3. 2 硒浓度对多糖硒含量的影响 随着培养液硒浓度的增加,羊肚菌粉多糖硒含量呈先升高后降低的变化趋势,但均比未加硒的多糖硒含量高,说明硒浓度的增加,可使硒与更多的多糖结合,但多糖硒含量并非呈线性比例增加,可能是硒与不同种多糖结合的缘故。综合来看,硒浓度为20 μg/mL时对羊肚菌粉多糖集硒有较好效果。
2. 4 蛋白质试验结果
2. 4. 1 硒浓度对菌丝蛋白含量的影响 以标准品牛血清白蛋白浓度为横坐标,595 nm下测得的吸光值为纵坐标绘制标准曲线(圖9)。由图10可知,就蛋白含量而言,无机硒的添加会限制蛋白积累,但随着硒浓度的升高,菌丝硒蛋白含量呈先升后降的变化趋势。说明硒的添加虽然整体上会减少蛋白含量,但可能对某些可利用硒的蛋白形成有促进作用。在硒浓度小于30 μg/mL时,这种促进作用占优势;硒浓度超过30 μg/mL后,则对蛋白的抑制成主导作用,从而使得蛋白含量降低。
2. 4. 2 硒浓度对蛋白硒含量的影响 由图11可知,随着硒浓度的升高,羊肚菌菌丝蛋白硒含量呈先升后降的变化趋势,在30 μg/mL时富集量最高。相对于未加硒组而言,菌丝蛋白硒含量均有所提高,说明硒浓度对硒蛋白的形成有一定促进作用。此外,蛋白硒含量的增加和减少均呈线性趋势,即等比例增减,说明羊肚菌菌丝蛋白中的硒结合位点较固定,很可能是与某种氨基酸结合造成的结果。
2. 4. 3 不同溶解性蛋白硒含量的比较 从图12可看出,未加硒组羊肚菌菌丝醇溶性蛋白硒含量最高,加硒的正交最优组羊肚菌菌丝则以碱溶性蛋白硒含量最高;正交最优组羊肚菌菌丝的4种溶解性蛋白硒含量均比未加硒组有所提高,且主要是碱溶性和盐溶性蛋白,说明碱溶性和盐溶性蛋白含有更多的含硒氨基酸。
2. 4. 4 不同硫酸铵饱和度下蛋白硒含量的比较
从图13可看出,相对于未加硒组,正交最优组的羊肚菌菌丝蛋白硒含量在各硫酸铵饱和度下均有所提高;未加硒组在低于40%硫酸铵饱和度和高于70%硫酸铵饱和度时,蛋白硒含量均≤0.02 μg/g,在50%~70%硫酸铵饱和度下蛋白硒含量有所增加;而正交最优组在30%、50%、70%和80%硫酸铵饱和度下均具有较高蛋白硒含量,且在30%饱和度时最高。说明含硒量高的蛋白在较低饱和度下就能被沉淀分离出来。
2. 5 抗氧化指标测定结果
2. 5. 1 T-SOD活力 由图14可知,随着硒浓度的增加,羊肚菌菌丝T-SOD活力不断增强,说明在50 μg/mL硒浓度以内,硒浓度对T-SOD活力均有促进作用。可能是因为菌丝中的硒能清除自由基及抑制自由基生成,使得T-SOD活力增强。
2. 5. 2 POD活性 从图15可看出,在硒浓度低于30 μg/mL时,随着硒浓度的增加,羊肚菌菌丝POD活性不断降低,可能是因为硒能保护酚类物质不被氧化成醌类,说明硒的添加能抑制POD活性;当硒浓度超过30 μg/mL后,由于较高硒浓度开始抑制菌丝生长,继而相应的POD活性开始增强。
2. 5. 3 PPO活性 从图16可看出,随着硒浓度的增加,羊肚菌菌丝PPO活性呈先升后降的变化趋势,当硒浓度小于40 μg/mL时,PPO活性逐渐增强,硒浓度为20 μg/mL时已超过未加硒组;但硒浓度超过40 μg/mL后,PPO活性急剧下降,在硒浓度为50 μg/mL时小于未加硒组。说明添加较低硒浓度对羊肚菌菌丝PPO活性有明显的促进作用,但硒浓度超过40 μg/mL后,对PPO活性则呈抑制效果。
2. 5. 4 Pro含量 由图17可知,硒浓度30 μg/mL是Pro积累的最佳浓度;低于30 μg/mL时,Pro含量随着硒浓度的增加而提高;硒浓度超过30 μg/mL后,Pro含量呈下降趋势。在浓度较低时,硒浓度的增加对菌丝抗逆性有不断促进作用,高硒浓度促进作用反而减小,但在50 μg/mL以下仍较未加硒组有更好的抗逆作用。说明补硒能提高羊肚菌菌丝Pro含量,从而提高其抗逆性,但过高的补硒浓度也会对其抗逆性产生负面影响。
3 讨论
丁建峰(2014)研究表明,优化的工艺参数(摇床转速100 r/min、培养基装料量150 mL、培养温度25.73 ℃、发酵时间5.22 d、硒浓度86.67 μg/mL)能促使羊肚菌菌丝生物量达10.339 g/L、硒含量达18.6 μg/mL。冮洁等(2016)以优化后的条件(亚硒酸钠浓度10 mg/L、pH 7.0、装液量100 mL/250 mL、温度25 ℃)培养得到羊肚菌菌丝生物量为8.27 g/L、硒含量为0.13 mg/g。在硒与羊肚菌的探索上,大多研究者以探析硒浓度对羊肚菌生物量或硒含量的影响为目的,且基本测定的是总硒含量,其有机硒和无机硒含量无法确定。本研究以亚硒酸钠添加量中转化为有机硒的有效利用率为考察指标,更加明确有机硒的获得条件,通过单因素和正交试验确定最大利用率的条件:硒浓度25 μg/mL、培养温度24 ℃、培养天数5 d、装液量200 mL,在此条件下测得无机硒转化为有机硒的硒源利用率为1.85%。本研究依据羊肚菌液体发酵时对硒的科学利用,使得正交最优组在有机硒得率方面更高效,且硒浓度适中,既能获得较高的有机硒,又能节约亚硒酸钠添加量。
前人对于羊肚菌活性物质的探究主要集中在对提取工艺进行优化和改良,抗体外氧化活性方面基本是以超氧阴离子、羟自由基和DPPH自由基试验为主(何亚,2015;冮洁等,2016)。本研究分析了不同硒浓度对液体发酵产物多糖和蛋白及其硒含量、T-SOD活力、POD活性、PPO活性、Pro含量多种生理生化指标的影响,着重反映硒浓度对羊肚菌菌丝的生理生化作用效果。发酵物中硒蛋白和硒多糖含量均有不同程度的增加,且酶活性等其他指标表明在培养液中添加硒能促使菌丝抗氧化性能增强,说明硒的添加在一定程度上能增强羊肚菌菌丝本身活性物质的优势。
本研究結果表明,硒浓度在羊肚菌菌丝的液体培养中具有重要研究价值,在液体培养基中加入适宜无机硒,可有效增加菌丝中有机硒含量,无机硒通过羊肚菌菌丝自身转化与多糖、蛋白结合,同时对菌丝内的多种成分起不同作用。下一步将着力于对羊肚菌富硒机理和功能性产品方面进行深入研究。
4 结论
羊肚菌液体发酵菌丝的集硒特性良好,且能产生更有利的活性物质,是一种有效的羊肚菌集硒方法。
参考文献:
丁健峰,孙永海,付天宇,谢高鹏. 2013. 响应曲面法优化羊肚菌富硒深层发酵条件[J]. 吉林大学学报(工学版),43(S1):557-563. [Ding J F,Sun Y H,Fu T Y,Xie G P. 2013. Optimization of deep fermentation conditions of morel selenium enriched by response surface method[J]. Journal of Jilin University(Engineering and Technology Edition),43(S1):557-563.]
丁健峰. 2014. 羊肚菌富硒深层发酵工艺及产物功能性研究[D]. 长春:吉林大学. [Ding J F. 2014. Study on sele-nium-enriched deep fermentation process of Morchella esculenta and its functional properties[D]. Changchun:Jilin University.]
段巍鹤,郭瑞,张起莹,刘建,孙桦楠,王一东. 2015. 羊肚菌活性成分应急性抗疲劳功能的研究[J]. 安徽农业科学,43(8):1-3. [Duan W H,Guo R,Zhang Q Y,Liu J,Sun H N,Wang Y D. 2015. Study on quick anti-fatigue function of Morchella active ingredients[J]. Anhui Agricultural Sciences,43(8):1-3.]
冮洁,麦海美,解彬,韩琳,冀春阳,曹蕾. 2016. 羊肚菌菌丝体富硒条件优化及其硒多糖抗氧化活性研究[J]. 食品与发酵工业,42(9):120-125. [Gang J,Mai H M,Xie B,Han L,Ji C Y,Cao L. 2016. Optimization of Se-rich culture conditions and antioxidant activities of polysaccharides from Morchella esculenta mycelium[J]. Food and Fermentation Industries,42(9):120-125.]
何亚. 2015. 羊肚菌的蛋白提取及其抗氧化性研究[D]. 太原:山西大学. [He Y. 2015. Study on extraction and antio-xidant activity of Morchella protein[D]. Taiyuan:Shanxi University.]
侯玉艳,吴素蕊,张丽,赵天瑞,邰丽梅. 2015. 黑脉羊肚菌SOD的纯化及特性研究[J]. 食品工业科技,36(15):147-151. [Hou Y Y,Wu S R,Zhang L,Zhao T R,Tai L M. 2015. Purification and characteristics of SOD in Morchella angusticeps[J]. Science and Technology of Food Industry,36(15):147-151.]
胡海涛,袁林喜,尹雪斌,郑璞,朱元元,刘志奎,焦文宁. 2012. 耐硒驯化灵芝菌种的液态发酵中硒的富集特征[J]. 食品与发酵工业,38(8):7-11. [Hu H T,Yuan L X,Yin X B,Zheng P,Zhu Y Y,Liu Z K,Jiao W N. 2012. Characterization of selenium accumulation on domestica-ted Ganoderma iucidum in liquid fermentation[J]. Food and Fermentation Industries,38(8):7-11.]
李红,张敏,李超,张季军. 2018. 羊肚菌液体培养工艺研究[J]. 沈阳农业大学学报,49(2):227-233. [Li H,Zhang M,Li C,Zhang J J. 2018. Optimal techniques for the mycelium liquid culture conditions of Morchella importuna[J]. Journal of Shenyang Agricultural University,49(2):227-233.]
李卫东. 2018. 羊肚菌生物活性成分及药理作用的研究进展综述[J]. 食药用菌,26(3):157-160. [Li W D. 2018. A review of research progress on biological active ingre-dients and pharmacological effects of morel[J]. Edible and Medicinal Mushrooms,26(3):157-160.]
李文佳,田野,高昊,甄达明,董彩虹,钱正明. 2017. 羊肚菌化学成分及药理活性研究进展[J]. 菌物研究,15(2):144-150. [Li W J,Tian Y,Gao H,Zhen D M,Dong C H,Qian Z M. 2017. The research progress on chemical constituents and pharmacological activities of Morchella[J]. Journal of Fungal Research,15(2):144-150.]
梁克红,卢林纲,朱宏,朱大洲,王晓红. 2018. 食物中硒的研究进展[J]. 中国粮油学报,33(3):134-138. [Liang K H,Lu L G,Zhu H,Zhu D Z,Wang X H. 2018. Research progress of selenium in foods[J]. Journal of the Chinese Cereals and Oils Association,33(3):134-138.]
刘书畅,马布平,周忠发,杨林雷,李荣春. 2018. 富硒食用菌的研究进展(综述)[J]. 食药用菌,26(2):74-78. [Liu S C,Ma B P,Zhou Z F,Yang L L,Li R C. 2018. Research progress on selenium-enriched edible fungi(review)[J]. Edible and Medicinal Mushrooms,26(2):74-78.]
孟凡云. 2010. 羊肚菌胞外多糖与胞内硒多糖抗氧化活性研究[D]. 泰安:山东农业大学. [Meng F Y. 2010. Antioxidant activity of extracellular polysaccharides and intracellular selenium polysaccharides of Morchella edulis[D]. Taian:Shandong Agricultural University.]
徐巧林,吴文良,赵桂慎,朱燕云,郭岩彬. 2017. 微生物硒代谢机制研究进展[J]. 微生物学通报,44(1):207-216. [Xu Q L,Wu W L,Zhao G S,Zhu Y Y,Guo Y B. 2017. Selenium metabolism in microorganisms[J]. Microbiology China,44(1):207-216.]
徐元芬. 2017. HG-AFS测定食品中硒元素的因素优化及干扰控制[D]. 恩施:湖北民族学院. [Xu Y F. 2017. Factors optimization and interference control of determination of selenium in food by HG-AFS[D]. Enshi:Hubei University for Nationalities.]
张丽. 2014. 黑脉羊肚菌中PPO、POD、SOD三种酶的性质研究[D]. 昆明:昆明理工大学. [Zhang L. 2014. Study on the properties of PPO,POD,SOD enzymes in Morchella nigrum[D]. Kunming:Kunming University of Science and Technology.]
张强,王松华,孙玉军,吴志远,乔楚潇,吴彩娥. 2017. 羊肚菌蛋白的硒化修饰及其体外抗氧化活性[J]. 精细化工,34(11):1252-1259. [Zhang Q,Wang S H,Sun Y J,Wu Z Y,Qiao C X,Wu C E. 2017. Selenylation modification of Morchella esculenta proteins and their antioxidant activity in vitro[J]. Fine Chemicals,34(11):1252-1259.]
赵谋明,郑泽洋,刘小玲. 2019. 食品中硒的总量及化学形态分析研究进展[J]. 南方农业学报,50(12):2787-2796. [Zhao M M,Zheng Z Y,Liu X L. 2019. Total content determination and chemical speciation analysis of selenium in food:A review[J]. Journal of Southern Agriculture,50(12):2787-2796.]
朱燕云,吴文良,赵桂慎,郭岩彬. 2018. 硒在动植物及微生物体中的转化规律研究进展[J]. 农业资源与环境学报,35(3):189-198. [Zhu Y Y,Wu W L,Zhao G S,Guo Y B. 2018. Progress of selenium biological transformation in animals,plants,and microorganisms[J]. Journal of Agricultural Resources and Environment,35(3):189-198.]
(責任编辑 罗 丽)
