STAT3诱捕寡核苷酸经STAT3/IRF-1通路抑制肿瘤细胞PD-L1的表达①
2019-12-27黄建胜朱乃硕
依 含 黄建胜 李 雪 朱乃硕
(复旦大学生命科学学院,上海 200438)
近年来,肿瘤发病率逐年上升,已成为一类严重危害公众健康的疾病。与传统的肿瘤治疗手段相比,免疫疗法更具有特异性,毒副作用更小。因此针对免疫检查点(Immune checkpoint)的调节或阻断剂在肿瘤免疫治疗中的应用受到学界的高度重视,其中程序性细胞死亡蛋白1(Programmed cell death-1,PD-1,CD279)与CTLA-4(CD152)的发现被授予2018年诺贝尔生理学和医学奖。1992年,免疫检查点PD-1首次被发现[1],与其配体PD-L1 (B7-H1或CD274)为一对重要的介导免疫耐受的分子[2,3]。PD-L1可表达在抗原递呈细胞或肿瘤细胞表面,可与活化的T细胞、B细胞表面的PD-1结合,抑制免疫应答,促进肿瘤细胞免疫逃逸[4,5],PD-1/PD-L1引起的免疫抑制机制包括促使T细胞凋亡、失活或者耗竭,上调IL-10的表达等[6-9];目前,抗PD-1/PD-L1单克隆抗体药物,如Nivolumab、Keytruda、Pembrolizumab和Avelumab等已在抗肿瘤治疗效果上取得重大突破[6,10-12]。然而,PD-L1不仅表达在肿瘤细胞表面,也表达在树突状细胞、巨噬细胞和间充质干细胞等细胞表面[13,14],单克隆抗体对PD-1或PD-L1非选择性的阻断作用可能会引起机体免疫系统功能紊乱、自身免疫疾病,同时抗体作为异源性生物大分子,长期用药则会引发机体产生抗体,引起药物耐受,使得抗体药物的长效性受限。目前抗体药物价格昂贵,普通患者及其家庭也难以承受。因此,研发新型的、更加安全有效的小分子药物依然十分必要。
诱捕寡核苷酸(Decoy oligonucleotide,Decoy-ON)[15]是一类20 bp以下的短链DNA或RNA,可以高特异性、高亲和性地结合目标蛋白、多肽或胞内大分子,通常以内吞途径快速进入细胞,免疫原性小,成本低,是理想的靶向性药物材料。
人源STAT3 Decoy-ON是15 bp的双链DNA,序列为CATTTCCCGTAAATC。其5′端与3′端分别有三个核苷酸经硫代磷酸酯修饰,通过内吞途径进入细胞后高效地结合pSTAT3(KD=122 nmol/L),并且抑制pSTAT3激活其下游基因表达[16,17]。STAT3属于信号转导和转录激活因子(Signal transducer and activator of transcription,STAT)蛋白家族,该蛋白家族是一类调节细胞增殖、存活和分化的转录因子,STAT3是致癌信号传导的关键介质[18],被认为是癌基因,可以激活下游IRF-1、cyclin D1、IL-10、survivin等基因的表达[19-21]。在大量人类癌症组织中可以检测到STAT3被激活,体外研究表明抑制STAT3的表达会降低多种癌细胞系的增殖和存活能力[22,23],而正常细胞中STAT3处于未激活状态,因此它被认为是更具特异性且更安全的抗肿瘤治疗靶点。此外,STAT3能够调控树突状细胞(DCs)、人多能间充质基质细胞(hMSCs)中PD-L1的表达[14,24-26]。STAT3 Decoy-ON靶向作用于pSTAT3后,可阻断pSTAT3与下游基因启动子上的识别位点结合,抑制cyclin D1、Bcl-xL等肿瘤相关基因的活化,并增强癌细胞对化疗药物的敏感性[16,27],且免疫原性小,无明显毒副作用。以往研究提示,STAT3 Decoy-ON可能是一种具有潜力的抗肿瘤小分子药物,而在肿瘤细胞中,其是否能够通过靶向pSTAT3而行使对PD-L1的调控鲜有报道。本研究以前列腺癌细胞DU145为模型,对STAT3及其下游相关因子IRF-1对肿瘤细胞PD-L1的表达影响进行了研究,证明STAT3 Decoy-ON对DU145细胞中免疫调控分子PD-L1的表达具有显著抑制作用,并初步明确其作用机制,进一步揭示了STAT3 Decoy-ON的抗肿瘤功能。
1 材料与方法
1.1材料 人前列腺癌细胞DU145购自ATCC网站,细胞基础培养基DMEM,×100青链霉素合剂、2.5%EDTA胰酶(Gibco公司),TRIzon无酶分离液(Life公司),PBS、胎牛血清(维森特公司),10×电转缓冲液、20×TBS、SDS-PAGE凝胶试剂盒(上海雅酶生物科技有限公司),PD-L1-FITC荧光抗体(Biolegend公司),RIPA(Beyotime公司),抗STAT3抗体、抗PD-L1抗体、抗IRF-1抗体(Abcam公司),抗GAPDH抗体、兔抗鼠HRP抗体、5×SDS蛋白上样缓冲液(Beyotime公司),cDNA反转录试剂盒、SYBN荧光定量试剂盒(Roche公司),ECL显色试剂盒(ThermoFisher公司),Dual-Luciferase Reporter Assay System(Prome-ga公司),以上试剂均为商品化产品。STAT3诱捕寡核苷酸由铂尚生物技术有限公司合成。其他常用试剂为国产分析纯试剂。
1.2方法
1.2.1细胞培养 DU145细胞使用添加10%胎牛血清、100 μl/ml双抗的DMEM培养基,在37℃、5% CO2的恒温箱中进行培养,细胞密度约为80%~90%时,以2.5%EDTA的胰酶进行细胞消化,按照1∶(2~3)的比例进行传代。
1.2.2流式细胞仪检测细胞表面STAT3 Decoy-ON或PD-L1阳性率 6孔板内准备每孔1×106个肿瘤细胞,与200 nmol/L FAM标记的STAT3 Decoy-ON(PBS稀释)在37℃、5%CO2恒温细胞培养箱中孵育2 h,以仅加PBS组细胞为空白对照组,无酶分离液消化细胞5 min,1 500 r/min离心2 min收集细胞,弃去上清细胞培养基,并用PBS充分洗涤细胞,再次离心收集细胞,用PBS制成400 μl细胞悬液,流式细胞仪上机检测波长为488 nm激发光通道的荧光强度。准备每孔1×106个肿瘤细胞,与500 nmol/L的STAT3 Decoy-ON在37℃、5%CO2恒温细胞培养箱中孵育48 h,按照上述步骤收集并洗涤细胞,100 μl PBS重悬细胞,加入1 μl PD-L1流式荧光抗体,室温下避光孵育20 min,PBS洗涤3次,制成400 μl 细胞悬液,流式细胞仪上机检测波长为488 nm激发光通道的荧光强度。
1.2.3细胞免疫荧光 将盖玻片在无菌PBS中浸泡洗涤,放入75%酒精中浸泡24 h,无菌环境下晾干玻璃片,放入12孔细胞培养板,铺入每孔1×105个肿瘤细胞进行贴壁培养,加入500 nmol/L FAM标记的STAT3 Decoy-ON,避光在37℃、5% CO2的恒温培养箱中孵育2 h,避免晃动细胞培养板使盖玻片移位。在避光环境下,弃去细胞培养上清液,用PBS轻柔冲洗细胞,加入4%多聚甲醛室温下固定细胞10 min,PBS洗涤细胞后加入10 μl DAPI(1∶1 000稀释),避光染核20 min,PBS充分洗涤细胞,将盖玻片移动到载玻片上进行封片,激光扫描共聚焦显微镜下进行镜检,以紫外光定位DAPI的蓝色荧光,以蓝光观察FAM的绿色荧光。
1.2.4Western blot检测蛋白表达 无酶分离液消化并收集500 nmol/L STAT3 Decoy-ON干预后肿瘤细胞,加入200 μl RIPA在冰上裂解细胞抽提蛋白质并定量。蛋白经10% SDS-PAGE电泳后,180 V、35 min电转至PVDF膜。将PVDF膜置于摇床上,室温下在含有5%脱脂奶粉的TBST溶液中封闭2 h,根据说明书比例稀释STAT3、PD-L1、IRF-1或内参GAPDH一抗,4℃冰箱孵育过夜,按照说明书比例稀释HRP二抗,室温下孵育1 h,避光环境下在PVDF膜上滴加ECL显色试剂并立即曝光。曝光后的条带应用Image J软件进行灰度值分析,结果应用GraphPad Prism5软件进行绘图。
1.2.5qRT-PCR检测目的基因mRNA 收集500 nmol/L STAT3 Decoy-ON干预后的肿瘤细胞,利用TRIzon法抽提细胞总RNA,测定RNA浓度,并立即用Roche反转录试剂盒将RNA反转为cDNA,-80℃保存待用。应用Roche公司SYBN荧光定量试剂盒进行相关基因的定量分析,反应条件为:变性95℃ 3 min,扩增95℃ 10 s、57℃ 20 s、72℃ 30 s、40个循环,溶解曲线测定95℃ 15 s、60℃ 15 s、梯度升温到100℃。以β-actin的Ct值为内参计算目的基因Ct值的2-ΔΔCt,得到目的基因的相对表达量,结果应用GraphPad Prism5软件进行绘图。qPCR使用引物见表1。
1.2.6PD-L1启动子突变荧光素酶质粒的构建与转染 将PD-L1起始密码子ATG上游的启动子序列(-599 bp至0 bp)克隆至萤火虫荧光素酶(Firefly luciferases)质粒pGL4.18 [luc2P/Neo]荧光素酶基因的上游。应用单引物循环PCR技术和环状质粒PCR技术将PD-L1启动子上STAT3与IRF-1识别位点进行突变或缺失改造[28]。以海肾荧光素酶(Renilla luciferases)质粒pGL4.74[hRluc/TK]的荧光强度作为实验内参。将DU145细胞铺入96孔板,应用Lipo3000脂质体转染试剂将100 ng重组pGL4.18质粒与5 ng pGL4.74质粒共转染进肿瘤细胞,空白pGL4.18质粒作为阴性对照。36 h后,吸去培养基,PBS洗涤1次,应用Dual-Luciferase Reporter Assay System试剂盒检测细胞中两种荧光素酶的荧光强度:每孔细胞加入20 μl PLB溶液,再加入100 μl LARⅡ,延迟10 s后上机检测Firefly荧光强度,加入100 μl Stop & Glo Reagent,检测内参Renilla荧光强度,计算每孔细胞Firefly与Renilla荧光强度比值,得到相对荧光活性(RLAs),结果应用GraphPad Prism5软件进行绘图。
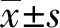
2 结果
2.1STAT3诱捕寡核苷酸对DU145细胞的亲和性探究 将FAM荧光标记的STAT3 Decoy-ON与DU145细胞孵育2 h,流式细胞仪检测细胞表面STAT3 Decoy-ON的阳性率(图1),图中红色曲线表示STAT3 Decoy-ON实验组细胞群,黑色曲线为空白对照组细胞群,结果显示DU145细胞表面STAT3 Decoy-ON阳性率为(50.93±4.47)%,表明STAT3 Decoy-ON可以有效吸附在DU145细胞表面。将STAT3 Decoy-ON-FAM与DU145细胞孵育2 h后激光扫描共聚焦显微镜下观察,DAPI定位细胞核(蓝色荧光),DU145细胞质中存在大量的STAT3 Decoy-ON-FAM(绿色荧光)(图2),说明STAT3 Decoy-ON能够有效亲和并进入DU145细胞。

图1 流式细胞仪检测STAT3 Decoy-ON与DU145细胞亲和性Fig.1 Affinity of STAT3 Decoy-ON with DU145 detected by Flow cytometryNote:The STAT3 Decoy-ON-FAM was detected in the FL1 channel.***.P<0.001 vs Blank control.

图2 激光扫描共聚焦显微镜检测STAT3 Decoy-ON与DU145细胞亲和性(×100)Fig.2 Affinity of STAT3 Decoy-ON with DU145 detected by laser scanning confocal microscopy (×100)
表1 qRT-PCR检测引物
Tab.1 Primers of qRT-PCR

GeneForward(5′→3′)Reverse(5′→3′)STAT3GGAGCAGAGATGTGGGAATGCTTGGTGGTGGAGGAGAACTPD-L1GTGGCATCCAAGATACAAACTCTCCTTCCTCTTGTCACGCTCAIRF-1GTAAGGAGGAGCCAGAAATTGACAGCCTACGGTGCACAGGGAATGGCCTGβ-actinAGCAAGCAGGAGTATGACGGTGGGGTGGCTTTTAGGA
2.2STAT3诱捕寡核苷酸对DU145细胞STAT3的调控 将DU145细胞与STAT3 Decoy-ON进行孵育,分别收集干预24 h、36 h、48 h与72 h 后的细胞,检测STAT3在不同时间段的mRNA与蛋白质的表达量。相对于对照组细胞,实验组细胞干预24 h后STAT3 mRNA水平下调10.0%,36 h下调28.1%,48 h下调33.3%,72 h 下调8.0%(图3A),36 h与48 h下调作用最显著(P<0.001)。蛋白质Western blot检测结果经Image J软件计算条带相对灰度,36 h与48 h时STAT3 Decoy-ON对STAT3蛋白表达的抑制性显著(P<0.05),分别下调表达33%与21%(图3B、C)。说明STAT3 Decoy-ON可以下调STAT3本身的表达。

图3 STAT3 Decoy-ON干预后DU145细胞STAT3的表达情况Fig.3 Result of STAT3 expression in DU145 after STAT3 Decoy-ON administrationNote:A.STAT3 mRNA qRT-PCR analysis.B.STAT3 protein Western blot analysis;C.Relative band grey value of Western blot.*.P<0.05 **.P<0.01,***.P<0.001 vs Blank control.
2.3STAT3诱捕寡核苷酸对DU145细胞PD-L1的表达调控 以500 nmol/L STAT3 Decoy-ON干预DU145细胞48 h,无酶分离液消化并收集细胞,孵育PD-L1-FITC荧光抗体,流式细胞仪检测细胞表面PD-L1的阳性率,图4中红色曲线表示寡核苷酸实验组PD-L1阳性细胞群体,黑色曲线表示空白对照组PD-L1阳性细胞群体,结果显示,DU145细胞表面PD-L1阳性率下降11.3%,相对于空白对照组PD-L1下调44.5%(P<0.001)。说明经过STAT3 Decoy-ON干预后,DU145细胞表面的PD-L1表达量可以被显著下调。

图4 流式细胞仪检测STAT3 Decoy-ON干预后DU145细胞表面PD-L1表达情况Fig.4 Flow cytometry analysis of PD-L1 expression on DU145 after STAT3 Decoy-ON administrationNote:The FITC was detected in the FL1 channel.***.P<0.001 vs Blank control.
用500 nmol/L的STAT3 Decoy-ON与DU145分别孵育24 h、36 h、48 h和72 h,检测干预后的PD-L1 mRNA转录量。结果表明(图5A)24 h后,STAT3 Decoy-ON显著下调DU145细胞PD-L1的转录(P<0.05),直到干预后的72 h 下调作用依旧显著。4个时间段相对于对照组,STAT3 Decoy-ON组PD-L1的mRNA表达量分别下调9.2%、61.7%、62.1%与64.6%,其中36 h、48 h与72 h 下调作用最为显著(P<0.001)。细胞经干预后进行Western blot分析(图5B、C),结果经Image J软件进行条带相对灰度值计算,4个时间段PD-L1蛋白表达分别下调16.1%(P<0.05)、64.3%(P<0.001)、71.1%(P<0.001)与75.0%(P<0.001)。证明STAT3 Decoy-ON可显著抑制DU145细胞中PD-L1的表达。
表2 位点突变质粒
Tab.2 Plasmids of sites mutation

PlasmidMutation siteBanding site sequence(5′to 3′)Mutation sequence(5′to 3′)pGL599---pGL383STAT3x--599 bp to -384 bppGL252STAT3x--599 bp to -253 bppGL222STAT3x/a--599 bp to -223 bppGL131STAT3x/a;IRF-1α/β--599 bp to -132 bppGL599-mIRF1αIRF-1αTTTCACTTTCTGTTTCATTTCTGTAACCTTCTGTTTCATTTCpGL599-mIRF1βIRF-1βATACCTAAACTGAAAGCTTCCATACCTAAGCTTACAGCTTCCpGL599-DmIRF1IRF-1α/βTGTTTCACTTTCTGTTTCATTTCTAAACTGAAAGCTTCCTGTGTAACCTTCTGTTTCATTTCTAAGCTTACAGCTTCCpGL599-mSTATaSTAT3aTTTACAAGAAATCGACAACTCApGL252-mSTATaSTAT3aTTTACAAGAAATCGACAACTCApGL599-mSTATxSTAT3xTTTATCAGAAAGGGGGACGCCTTTCTGATAAATAGATCACTCAGGGGGACGCCTAGCTGATGCA

图5 STAT3 Decoy-ON干预后DU145细胞PD-L1的表达情况Fig.5 Result of PD-L1 expression in DU145 after STAT3 Decoy-ON administrationNote:A.PD-L1 mRNA qRT-PCR analysis;B.PD-L1 protein Western blot analysis;C.Relative grey value of Western blot.*.P<0.05 or ***.P<0.001 vs Blank control.
2.4STAT Decoy-ON调控PD-L1表达的机制探究 干扰素调节因子1(Interferon regulatory factor-1,IRF-1)与PD-L1的表达密切相关。以JASPAR软件(85%阈值)预测PD-L1转录起始位点上游1 000 bp范围内STAT3和IRF-1识别位点(图6),在-208 bp至-188 bp、-151 bp至-131 bp处分别存在两个IRF-1识别位点,将-208 bp至-188 bp位点称为IRF1α位点,将-151 bp至-131 bp位点称为IRF1β。在-415 bp至-405 bp、-394 bp至-384 bp、-233 bp至-223 bp处分别存在三个STAT3识别位点,将-233 bp至-223 bp位点称为STAT3a,-415 bp至-405 bp与-394 bp至-384 bp两个位点称为STAT3x。将PD-L1启动子序列(-599 bp至0 bp)克隆至Firefly荧光素酶质粒pGL4.18中,并分别构建STAT3a、STAT3x、IRF1α和IRF1β识别位点突变或截短的PD-L1启动子荧光素酶质粒(表2),利用双荧光素酶报告系统分析STAT3和IRF-1对PD-L1的表达调控作用。
由图7A可见,IRF1α和IRF1β单识别位点突变(pGL599-mIRF1α和pGL599-mIRF1β)时, PD-L1启动子活性分别下调37.6%与29.7%(P<0.01与P<0.05);当IRF-1双识别位点突变(pGL599-DmIRF1)时,PD-L1启动子活性下降80.9%(P<0.001)。该结果说明IRF-1是PD-L1表达的关键转录因子,其识别位点的突变显著抑制PD-L1的转录活性。

图6 PD-L1启动子STAT3、IRF-1结合位点预测Fig.6 Prediction of STAT3,IRF-1 binding site on PD-L1 promoter
STAT3x位点突变(pGL559-mSTAT3x、pGL383或pGL252)分别显著下调PD-L1启动子活性达41.5%、48.6%与41.9%(P<0.01、P<0.001与P<0.01)(图7B)。STAT3a位点突变(pGL599-mSTAT3a)显著下调启动子活性51.0%(P<0.001)。STAT3a/x识别位点同时突变(pGL252-mSTAT3a或pGL222)分别下调启动子活性41.5%与63.1%(P<0.01与P<0.001)。证明STAT3x或STAT3a识别位点的缺失或突变皆可显著下调PD-L1启动子活性。STAT3与IRF-1识别位点全部突变(pGL131)下调启动子活性达70.6%(P<0.001)。由以上结果可推论,阻断STAT3结合其PD-L1启动子上的识别位点可以直接抑制PD-L1的表达,同时也证实IRF-1对PD-L1的表达有着重要的调控作用。

图7 STAT3与IRF-1结合位点突变或缺失PD-L1启动子的活性Fig.7 Activity of PD-L1 promoter with mutation or deficiency of STAT3 and IRF-1 binding sitesNote:A.PD-L1 promotor activity with mutation or deficiency of IRF-1 binding site;B.PD-L1 promotor activity with mutation or deficiency of STAT3x and STAT3a binding site.*.P<0.05,**.P<0.01 or ***.P<0.001 vs pGL599.
将STAT3 Decoy-ON与DU145细胞孵育48 h后,检测IRF-1的表达情况。通过qRT-PCR检测发现(图8A)IRF-1的mRNA表达量显著下调59.5%(P<0.001),同时,通过Western blot检测发现(图8B)IRF-1的蛋白质表达量有明显下降。说明STAT3Decoy-ON可调控DU145细胞中IRF-1的表达。由此证明,在DU145细胞内STAT3 Decoy-ON可能通过对STAT3的下调或阻断直接抑制PD-L1的表达,同时,还可以介导IRF-1的信号通路对PD-L1进行调控(图9)。

图8 STAT3 Decoy-ON干预后DU145细胞IRF-1的表达情况Fig.8 Result of IRF-1 expression after STAT3 Decoy-ON ad ministrationNote:A.IRF-1 mRNA qRT-PCR analysis,***.P<0.001 vs Blank control;B.IRF-1 protein Western blot analysis.

图9 STAT3 Decoy-ON调控前列腺癌细胞(DU145)中PD-L1表达的机制模式图Fig.9 Proposed regulatory mechanism of PD-L1 expression with the STAT3 Decoy-ON in Prostate cancer (DU145) cells
3 讨论
免疫逃逸是肿瘤治疗的一大难点,PD-1/PD-L1是肿瘤免疫耐受形成的关键分子,现已证实PD-L1可在多种实体肿瘤中过度表达并帮助肿瘤进行免疫逃逸,如头颈部鳞癌、乳腺瘤、肺癌、胃癌、前列腺癌、霍奇金淋巴瘤和黑色素瘤等[4,29-31],因此,PD-1/PD-L1免疫检查点阻断剂在肿瘤免疫治疗方面被寄予厚望;美国食品和药物管理局(FDA)已经批准了多种抗PD-1/PD-L1抗体药物,然而单克隆抗体对PD-1/PD-L1无差别的阻断很可能会打破机体自身免疫平衡引发免疫系统疾病[3]。正因如此,开发一种更安全的PD-L1靶向抑制药物是十分必要的。Decoy-ON作为短链的DNA或RNA,开发为小分子药物具有以下几个优势:①可与目标蛋白质高度特异性结合;②分子量小,更易突破组织屏障到达病灶处;③免疫原性小,不刺激机体产生抗体,无明显毒副作用;④易于合成与制备,且生产成本低廉。其中STAT3 Decoy-ON与pSTAT3可以高效亲和,抑制pSTAT3激活下游癌基因的表达,发挥一定的抗肿瘤功效,是一个极具开发潜力的新型抗肿瘤小分子药物。
本研究中发现STAT3 Decoy-ON可以有效地进入前列腺癌细胞DU145,显著下调DU145细胞STAT3癌基因的表达,在干预36 h与48 h下调作用最显著。经STAT3 Decoy-ON干预后,DU145细胞表面的PD-L1显著下调,给药后24 h、36 h、48 h与72 h 均可显著抑制DU145细胞中PD-L1的表达,结合寡核苷酸药物本身优势,提示STAT3 Decoy-ON可能具有被开发为针对PD-L1免疫检查点抗肿瘤药物的潜力。而STAT3 Decoy-ON作为寡核苷酸小分子,如何使其功能更具长效性,其在动物模型中能否有效抑制PD-L1的表达有待继续研究,可下一步的讨论。
IRF-1是一个重要的多功能转录因子,在肺癌、黑色素瘤等细胞中IRF-1与 PD-L1的高表达密切相关[32,33],后续研究证实在多种肿瘤细胞中interferon gamma-JAK1/JAK2-STAT1/STAT2/STAT3-IRF1是调控PD-L1表达的重要信号通路之一[34,35]。本研究构建了PD-L1启动子上STAT3与IRF-1识别位点缺失或突变的荧光素酶报告质粒,发现STAT3识别位点缺失或突变时,PD-L1启动子活性显著下调,提示STAT3 Decoy-ON可能通过阻断pSTAT3结合PD-L1启动子上的识别位点直接下调PD-L1的表达。当IRF-1识别位点缺失或突变时皆显著下调PD-L1启动子活性;以STAT3 Decoy-ON干预细胞后,发现IRF-1的表达量被显著下调,证实IRF-1是前列腺癌细胞株中STAT3下游影响PD-L1表达的关键转录因子,证明了STAT3 Decoy-ON介导STAT3与IRF-1协同调控DU145细胞中PD-L1的表达,进一步揭示了STAT3 Decoy-ON抗肿瘤的功能与机制。
STAT3 Decoy-ON作为一种新的研究方向与技术路线,尽管仍有许多问题尚待探究,但其作为小分子候选药物的优势不容忽视,在治疗实体肿瘤方面可能具有很大的潜力。
猜你喜欢
——一道江苏高考题的奥秘解读和拓展
