miR-206靶向调控活化的T细胞核因子对人前列腺癌细胞增殖和侵袭的影响①
2019-12-27郭小鹏
崔 崎 韩 玲 郭小鹏
(新疆医科大学附属中医医院泌尿科,乌鲁木齐 830000)
前列腺癌是西方国家发病率和死亡率较高的男性恶性肿瘤,近些年来,随着工作压力的增加,前列腺癌的发病率逐年升高[1]。目前临床上前列腺癌主要的治疗方式是外科手术,但对于转移性前列腺癌主要方法是保守治疗,预后较差,因此需要寻找一些转移分子标志物,改善预后[2]。MircoRNA可通过多种方式调节肿瘤细胞的增殖与转移,发挥致癌基因或抑癌基因的作用。MircoRNA-206(miR-206)是MircoRNA家族成员之一,有学者发现其可抑制结直肠癌细胞增殖,抑制乳腺癌细胞迁移和侵袭能力[3,4]。目前关于miR-206在前列腺癌中的作用报道较少,因此本研究主要探讨miR-206在前列腺癌中的表达水平及其对增殖与侵袭的影响,并初步研究其分子机制。
1 材料与方法
1.1材料
1.1.1细胞株 PC-3细胞和RWPE-1细胞购自中国科学院细胞库。
1.1.2主要试剂和仪器 Trizol试剂购自生工生物工程(上海)股份有限公司;Gibco胎牛血清购自上海素尔生物科技有限公司;RPMI1640培养基、胎牛血清购自Gibco公司;DMSO、蛋白双染marker、显影液、5%脱脂奶粉、NFAT5、PCNA、Vimentin、E-cadherin、GADPH单克隆抗体及辣根过氧化物酶标记的山羊抗人IgG二抗购自上海生工公司;双荧光素酶检测报告系统试剂盒购自Promega公司;TransScript Ⅱ All-in-One First-Strand cDNA Synthesis SuperMix for qPCR (One-Step gDNA Removal)购自北京全式金生物技术有限公司;2× SYBR Green qPCR Master Mix购自北京冬歌博业生物科技有限公司;日本同仁CCK8试剂盒购自北京百奥莱博科技有限公司;Transwell小室购自上海子起生物科技有限公司;前列腺癌细胞株PC-3购自上海奥陆生物科技有限公司;胰蛋白酶-EDTA消化液(0.25%)含酚红购自金克隆(北京)生物技术有限公司;脂质体LipofectamineTM2000 Transfection Reagent购自上海广锐生物科技有限公司;miR-206模拟物(mimics)及无关序列对照购自上海吉玛公司;pultton超微量分光光度计购自北京五洲东方科技发展有限公司,实时荧光定量PCR仪购自云南临康生物科技有限公司;Thermofisher梯度PCR仪购自上海恒斐生物科技有限公司;德国CO2培养箱WCI-180购自苏州贝锐仪器科技有限公司;Thermo-80℃低温冰箱购自北京乾明基因技术有限公司。
1.2方法
1.2.1细胞培养 使用10%胎牛血清的RPMI1640完全培养基培养PC-3细胞和RWPE-1细胞,放置于37℃,5%CO2的细胞培养箱中培养。
1.2.2RT-qPCR检测组织与细胞中miR-206和NFAT5的表达 使用液氮研磨前列腺癌患者和前列增生患者的前列腺组织,加入适量Trizol试剂提取组织总RNA。使用pultton 超微量分光光度计测定总RNA的纯度和浓度。依据TransScript Ⅱ All-in-One First-Strand cDNA Synthesis SuperMix for qPCR (One-Step gDNA Removal)试剂盒说明书将组织总RNA逆转录为总cDNA。依据2×SYBR Green qPCR Master Mix试剂说明书进行荧光反应。反应条件:94℃ 2 min;95℃ 10 s;58℃ 30 s,40个循环。以U6为参照,进行数据统计学分析。使用磷酸缓冲液洗涤细胞后,采用胰酶消化液对细胞进行消化后提取RNA,步骤同上。
1.2.3荧光素酶报告基因检测miR-206和NFAT5的结合 将pmir-GLO荧光素酶载体分别插入NFAT5的野生型3′-UTR和突变型(不能再与miR-206结合)3′-UTR,构建成重组NFAT5野生型3′-UTR质粒和NFAT5突变型3′-UTR质粒。在6孔板中培养PC-3后,将以下四种组合miR-206模拟物和NFAT5野生型3′-UTR质粒、miR-206模拟物 (miR-206 mimics)和NFAT5突变型3′-UTR质粒、miR-206对照 (miR206-NC)和NFAT5野生型3′-UTR质粒、miR-206对照和NFAT5突变型3′-UTR质粒通过脂质体共转染293T细胞,培养36 h后根据双荧光素酶报告基因检测试剂盒测定荧光素酶活性 。
1.2.4细胞转染 取对数生长期的PC-3细胞,使用RPMI1640完全培养基将细胞浓度调整为3×106个/ml,接种200 μl细胞培养液至康宁六孔板中,放置于细胞培养箱中培养48 h。使用LipofectamineTM2000 Transfection Reagent分别转染miR-206模拟物和miR-206对照于细胞中,每组设置3个复孔。
1.2.5RT-qPCR检测转染后的细胞miR-206的表达 具体方法参照1.2.2。
1.2.6CCK8检测细胞增殖 吸去转染48 h后的PC-3细胞上清液,细胞消化后离心弃上清液,使用RPMI1640完全培养基调整细胞浓度为2×104个/ml,接种200 μl细胞培养液至康宁96孔板中,放置细胞培养箱中培养24 h。弃掉细胞上清液,使用磷酸缓冲液洗涤细胞,每孔加入配置好的CCK8 混合液(10 μl CCK8试剂和90 μl RPMI1640完全培养基),置于细胞培养箱中孵育2 h后,使用酶标仪测定OD450。
1.2.7Transwell小室检测细胞侵袭 将转染48 h的PC-3细胞消化后,用无血清RPMI1640培养基将细胞浓度调整至4×105个/ml,取100 μl转染后的细胞液接种于Transwell上室,下室加入600 μl含20%胎牛血清的RPMI1640完全培养基,并在Transwell上室与下室间的聚碳酸酯膜上铺一层基质胶。然后放置于细胞培养箱中培养48 h。取出Transwell培养板,吸去小室上层中的液体并擦拭,倒扣小室,室温放置8 min。采用4%甲醛固定15 min 并使用1%结晶紫进行染色,染色时间为5~10 min。最后置于光学显微镜下观察并拍照。
1.2.8NFAT5、PCNA、E-cadherin和Vimentin蛋白水平的测定 将转染48 h的PC-3细胞消化后,加入RIPA蛋白裂解液提取细胞蛋白并测定蛋白浓度。调整蛋白浓度后进行电泳过程,电泳结束后将蛋白转印至PVDF膜中。转膜结束后取出PVDF膜采用5%脱脂牛奶-TBST进行封闭,洗涤后分别与β-actin、NFAT5、PCNA、E-cadherin和Vimentin单克隆抗体孵育4℃ 12 h,洗涤后使用HRP标记的山羊抗人lgG二抗室温孵育2 h,洗涤后进行ECL发光鉴定,扫描条带后,使用ImageJ软件分析条带。
1.2.9NFAT5、PCNA、E-cadherin和Vimentin mRNA表达水平检测 具体步骤参照1.2.2。引物见表1。
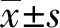
2 结果
2.1细胞和组织中miR-206和NFAT5的表达水平比较 前列腺癌组织miR-206表达水平显著低于前列腺增生组织(图1A),而前列腺癌组织NFAT5表达水平显著高于前列腺增生组织(图1B),并且两者呈负相关关系(r=-0.934,P<0.000 1),见图1C。

图1 细胞和组织中miR206和NFAT5的表达水平比较Fig.1 Comparison of expression levels of miR-206 and NFAT5 in cells and tissuesNote:A.The relative expression of miR-206;B.The relative expression of NFAT5;C.The relationship between the expressions of NFAT5 and miR-206.Compared with miR-206-NC,***.P<0.000 1.
2.2NFAT5是miR-206的靶向基因 生物信息学网站(http://starbase.sysu.edu.cn/agoClipRNA.php?source=mRNA)预测NFAT5与miR-206的结合位点,序列见图2A。结果显示,NFAT5野生型3′-UTR组中,与miR-206对照的PC-3细胞相比,miR-206模拟物组荧光素酶的活力值明显降低(t=7.842,P=0.001 4)。但在NFAT5突变型3′-UTR组中,荧光素酶的活性无明显变化(图2B),证明miR-206靶向调控NFAT5的3′-UTR,降低了荧光素酶的表达。
表1 RT-qPCR引物
Tab.1 Primer of RT-qPCR

Primer nameSequence(5′ to 3′)miR-206p FTGCTTCCCGAGGCCACATGCmiR-206 RGTGTGTGGTTTCGGCAAGTGU6 FGCTTCGGCAGCACATATACTAAAATU6 RCGCTTCACGAATTTGCGTGTCATNFAT5 FCTGCTGGGATCCCTGAGATGTTCNFAT5 RGGTTTTCCAATGTTCCCCACGPCNA FAGCAGAGTGGTCGTTGTCTTTPCNA RTAGGTGTCGAAGCCCTCAGAE-cadherin FCATTTCTTGGTCTACGCCTGE-cadherin RGAGAGGAGTTGGGAAATGTGVimentin RGAGCAGCAGAATAAGATCCTGVimentin FCTTTGTCGTTGGTTAGCTGG
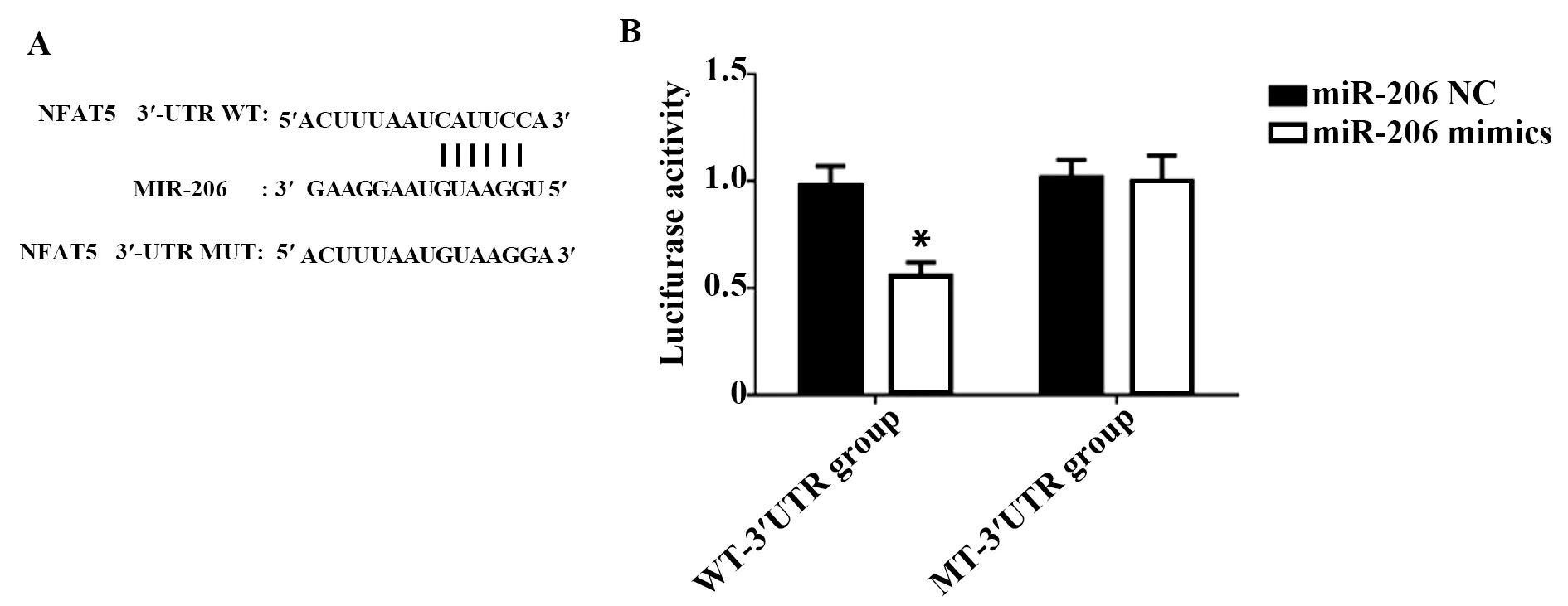
图2 NFAT5是miR-206的靶向基因Fig.2 NFAT5 is a targeted gene of miR-206Note:A.Binding sites and sequences of NFAT5 to miR-206;B.Relative activity of luciferase.Compared with miR-206-NC,*.P<0.05.
2.3细胞增殖速率的比较 与miR206-NC比较,细胞转染miR-206-mimics后,miR-206的表达水平显著升高,转染miR-206-mimics48和72 h后,PC-3细胞的增殖速率显著降低(P<0.05),见图3。
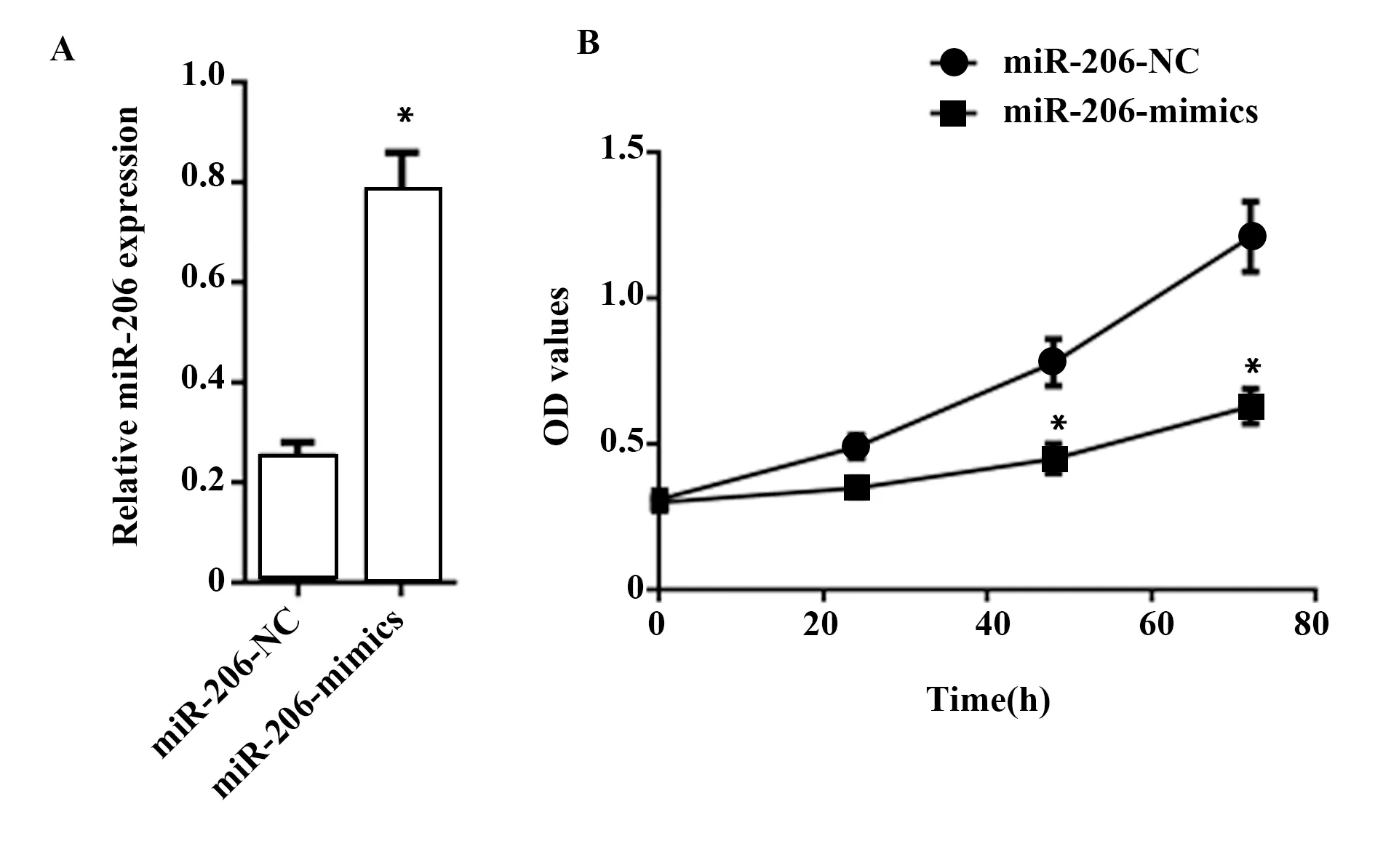
图3 细胞增殖速率的比较Fig.3 Comparison of cell proliferation rateNote:A.Relative expression of miR206;B.miR206 expression (OD) curve with time.Compared with miR-206-NC,*.P<0.05.
2.4细胞侵袭能力的比较 转染miR-206-mimics后,与miR206-NC组比较,侵袭性PC-3细胞的数量明显降低(P<0.05),见图4。
图4 细胞侵袭能力的比较Fig.4 Comparison of cell invasion abilityNote:A.Cell invasion map;B.Comparison of the number of cell invasion.Compared with miR-206-NC,*.P<0.05.
2.5NFAT5、PCNA、E-cadherin和Vimentin蛋白水平比较 与miR-206-NC组比较,miR-206-mimics组E-cadherin蛋白水平显著升高,NFAT5、PCNA和Vimentin蛋白水平显著降低(P<0.05),见图5。

图5 NFAT5、PCNA、E-cadherin和Vimentin蛋白水平Fig.5 NFAT5,PCNA,E-cadherin and Vimentin protein levels
2.6NFAT5、PCNA、E-cadherin和Vimentin mRNA水平比较 与miR-206-NC组比较,miR-206-mimics组E-cadherin mRNA水平显著升高,NFAT5、PCNA和Vimentin mRNA水平显著降低(P<0.05),见图6。
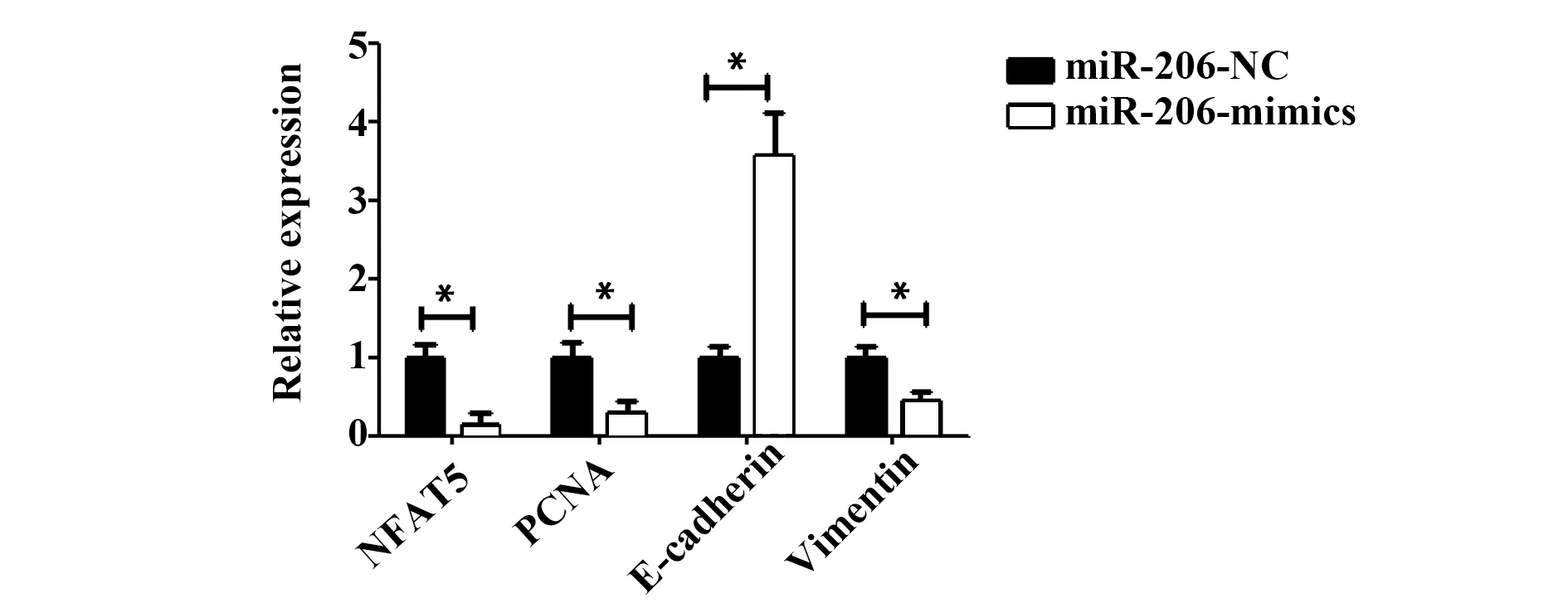
图6 NFAT5、PCNA、E-cadherin和Vimentin mRNA水平比较Fig.6 Comparison of NFAT5,PCNA,E-cadherin and Vimentin protein levelsNote:Compared with miR-206-NC,*.P<0.05.
3 讨论
前列腺癌是发生于前列腺上皮的恶性肿瘤,主要包括腺癌、腺鳞癌及导管腺癌等,发病高峰年龄为55~70岁。由于前列腺癌生长速度缓慢,早期症状轻微,容易误诊、漏诊和耽误治疗,导致五年生存率较低。前列腺癌的发生发展与mircoRNA密切相关。在前列腺癌中,mircoRNA在肿瘤发生发展中发挥了重要作用。研究报道,miR-221和miR-222促进PC-3细胞增殖及转移的作用;miR-101抑制LNCap细胞增殖和转移,并下调EZH2的表达[5,6]。目前,已有学者研究表明,miR-206可通过干扰CDK4和GAK的表达显著抑制前列腺癌细胞的生长,也有学者研究表明,miR-206通过靶向Annexin A2调控上皮-间质转化,抑制前列腺癌细胞的侵袭转移[7,8]。由此可知,miR-206可以靶向结合调控多个mRNAs,通过不同途径参与前列腺癌的发生发展。本文结果显示,转染miR-206后,前列腺癌PC-3细胞的增殖与侵袭能力显著降低。
应用生物信息学数据库(http://starbase.sysu.edu.cn/agoClipRNA.php?source=mRNA)预测,NFAT5存在miR-206的潜在的结合位点。本研究通过双荧光素酶证实了miR-206和NFAT5的靶向关系。NFAT5,属于NF-κB/Rel家族,是一种渗透压转录因子,参与维持肾脏内髓部细胞内外渗透压的平衡。目前研究表明,NFAT5在多种肿瘤中异常表达,参与了肿瘤发生发展[9]。并且很多研究都证实了NFAT5在肿瘤的促血管新生因子及血管新生的表达中发挥重要作用[10]。本文经研究发现NFAT5在前列腺癌中异常高表达,并与miR-206呈负相关关系。再次验证了miR-206和NFAT5存在的靶向关系。
EMT被认为是前列腺癌发生骨转移的主要原因。上皮细胞向间质细胞转变(Epithelial-mesenchymal transition,EMT)被激活后,细胞侵袭、迁移能力明显增强,在体外则主要表现为Transwell透膜能力提高。有文献报道,EMT是一个复杂的动态过程,N-cadherin、vimentin的表达水平增加,E-cadherin的低表达均可诱导EMT的发生[11]。E-cadherin是一类重要的细胞表面黏附分子,其主要功能是介导细胞黏附与迁移。近年来的研究表明,E-cadherin在肺癌等多种肿瘤中异常表达,对肿瘤的侵袭和转移中起重要作用[12]。李俊堂等[13]发现NFAT5能够结合在肿瘤转移促进分子S100A4的启动子区上,上调S100A4表达及活性。S100A4是Ca2+结合蛋白家族的成员之一,常被作为间质细胞的标志物,文献报道在食管鳞状细胞癌细胞中过表达S100A4可以抑制E-cadherin和促进vimentin的表达[14]。PCNA与细胞DNA合成关系密切,主要表达于G1期至S期的增殖细胞。越来越多的研究证实,其表达量是反应细胞增殖状态的理想评价指标。沈薇等[15]研究表明,通过siRNA下调S100A4基因的表达能够抑制U251细胞的增殖。因此本文检测NFAT5、PCNA、E-cadherin和Vimentin蛋白表达水平,考察miR-206抑制前列腺癌细胞的增殖与侵袭作用机制。结果显示,与miR-206-NC组比较,miR-206-mimics组E-cadherin 蛋白和mRNA水平显著升高,NFAT5、PCNA、Vimentin蛋白和mRNA水平显著降低,与上述文献报道一致。
综上所述,miR-206还有可能会通过调控NFAT5抑制前列腺癌细胞的增殖与侵袭的作用。本实验的不足之处仅在细胞水平中研究miR-206的作用,后续将通过动物实验探讨miR-206在体内的作用。
