基于miRNA-30b-5p/TLR4/NF-κB轴探究针灸改善大鼠膝骨关节炎损伤的实验研究
2019-12-27林道冠徐桂丽
林道冠 徐桂丽
(三亚市人民医院康复医学科,三亚 572000)
骨关节炎(Osteoarthritis,OA)是一种同时影响软骨及邻近组织的退行性疾病,膝骨关节炎(Knee osteoarthritis,KOA)是OA的最常见类型,并伴有软骨下骨板、关节边缘骨质增生及局部炎症等临床症状[1]。软骨细胞是关节软骨中唯一的细胞成分,软骨细胞的老化、凋亡在关节软骨的维持、再建、塑形、更新中起重要的作用[2]。流行病学调查结果显示,KOA的病因可能与包括遗传、软骨代谢、炎症和免疫调节紊乱等在内的一些风险因素有关[3]。近年来,microRNAs因其在基因转录过程中的重要作用而备受关注,其已逐步成为一种新的生物标志物,在KOA的早期诊断中发挥重要作用[4]。TLR4/NF-κB信号通路已被证明在KOA的发生发展过程中起促进作用[5]。针灸疗法属于中医外治法,包括针法和灸法,其治疗机制多与刺激腧穴、调动经络及通调脏腑气血有关[6]。近些年,针灸治疗KOA的实验研究多见且临床疗效显著,但其具体作用机制尚未阐明。因此本研究采用大鼠KOA模型探究单一针灸及针灸联合miRNA-30b-5p-mimics或siRNA-TLR4治疗的疗效,旨在为针灸治疗KOA提供更科学、严谨的理论基础。
1 材料与方法
1.1材料
1.1.1主要试剂及仪器 ①主要试剂:大鼠TNF-α(No.PT518)、IL-1β(No.PI303)、IL-6(No.PI303)ELISA试剂盒购自上海碧云天生物技术有限公司;大鼠MMP-13(No.RA20501)ELISA试剂盒购自中国Bio-Swamp公司;RNA提取试剂盒、反转录试剂盒购自TaKaRa公司;SYBR Green染料购自Lumiprobe Corporation公司;全蛋白提取、BCA蛋白浓度检测试剂盒及高灵敏ECL化学放光试剂盒均购自南京建成生物技术有限公司;兔抗TLR4抗体(No.19811-1-AP;稀释比:1∶500)、兔抗NF-κB抗体(No.14220-1-AP;稀释比:1∶500)、兔抗IL-6抗体(No.21865-1-AP;稀释比:1∶1 000)、兔抗MMP-13抗体(No.18165-1-AP;稀释比:1∶1 000)、兔抗GAPDH抗体(No.10494-1-AP;稀释比:1∶2 500)购自武汉三鹰生物技术有限公司;HRP标记的山羊抗兔二抗IgG(No.ab97051;稀释比:1∶5 000)购自英国Abcam公司;TUNEL细胞凋亡检测试剂盒(显色法)(No.PAB180028)购自中国Bio-Swamp公司;艾条购自南京同仁堂药业有限公司(国药准字Z32020034);脂质体2000和HEK-293T细胞购自美国Thermo Fisher Scientific;pGL3双荧光素酶报告载体由广州锐博生物科技有限公司提供;其余常见试剂均购自国药集团。②主要仪器:华佗牌针灸针购自苏州市南方医疗器械有限公司;荧光定量PCR仪购自美国BIO-RAD;全自动化学发光分析仪购自上海天能;凝胶处理分析系统购自美国ABI;低温冷冻离心机购自德国Eppendorf;酶标仪购自美国Bio-Tek。
1.1.2实验动物 40只雄性SPF级Wistar大鼠(200±20)g购自湖南斯莱克景达实验动物有限公司,动物许可证号:SCXK(湘)2013-0004。动物室内环境温度为21±2℃,湿度(50±15)%,12 h明暗交替,自由饲养,暂养一周后开始实验。
1.2方法
1.2.1实验动物分组及大鼠KOA模型构建 采用随机数字分组法将暂养一周后的40只大鼠平均分成5组(n=8):正常组、模型组、单一针灸治疗组、针灸+miRNA-9-5p-mimics联合治疗组以及针灸+siRNA-TLR4联合治疗组。其中模型组、单一针灸组和联合治疗组大鼠均进行KOA模型构建。大鼠KOA模型构建:采用经改良后的Videman法[7],左后肢伸直位固定制动法进行造模,6周时从各组动物随机抽取1只处死,取关节软骨作病理观察,验证造模是否成功。
1.2.2治疗方法 ①正常组与模型组:正常饲养,不给予任何治疗。②单一针灸治疗组:造模成功1周后,采用华佗牌针灸针(0.30 mm×40 mm),选取“足三里”穴、“阳陵泉”穴垂直入针,入针后均施捻转,中度刺激,之后在针柄上插入2 cm的艾条,燃尽。每次留针30 min,每天1次,1周为1个疗程,中间休息2 d,共治疗4周(疗程)。③联合治疗组:siRNA-TLR4和miR-30b-5p mimics均由广州锐博生物科技有限公司代为设计、合成并提供。此部分大鼠在单一针灸治疗的基础上,每周额外膝关节腔内注射10 μg/只miRNA-30b-5p-mimics或siRNA-TLR4,共注射4次,直至治疗结束。
1.2.3样本采集 治疗结束后,采用40 mg/kg腹腔注射戊巴比妥溶液,大鼠麻醉后腹主动脉放血致死;收集每组8只大鼠的膝关节滑膜液备检;取部分膝关节软骨组织,10%中性福尔马林溶液固定备用;剩余部分软骨组织-80℃冰箱保存备用。
1.2.4病理学变化检测(HE染色) 取经固定后的各组大鼠部分膝关节软骨组织,依次经过:①常规步骤脱水浸蜡包埋;②切片:4 μm左右;③展片和烤片;④HE染色;⑤中性树胶封片;⑥拍照分析;确认并比较各组大鼠膝关节软骨组织病理学变化。
1.2.5膝关节滑膜液TNF-α、IL-1β、IL-6和MMP-13的分泌水平检测 分别依照大鼠TNF-α、IL-1β、IL-6和MMP-13 ELISA检测试剂盒使用说明书操作,检测各组大鼠膝关节滑膜液TNF-α、IL-1β、IL-6和MMP-13的分泌水平。
1.2.6qRT-PCR检测软骨组织中miRNA-30b-5p、TLR4和NF-κB的表达水平 根据NCBI上公布的大鼠各基因序列分别设计qRT-PCR用引物:miRNA-30b-5p F/R:5′-CACCAGCCATGTAAACATC-C-3′,5′-ATGCTTGTTCTCGTCTCTGT-3′;TLR4 F/R:5′-CCAGAGCCGTTGGTGTATC-3′,5′-TCAAGGCTTT-TCCATCCAAC-3′;NF-κB F/R:5′-GACAGCACCACCTACGAT-3′,5′-GGATCACTTCAATGGCCT-3′;GA-PDH F/R:5′-CAAGCAACTGTCCCTGAG-3′,5′-TAG-ACAGAAGGTGGCACA-3′及U6 F/R:5′-ATTGG-AACGATACAGAGAAG-3′,5′-GGAACGCTTCACGA-ATTTG-3′;并由上海生物工程有限公司代为合成。分别提取各组大鼠膝关节软骨组织RNA,反转录成cDNA单链为模板,采用20 μl PCR反应体系:各基因对应上下游引物各0.5 μl,SYBR Green Mix 10 μl,cDNA模板1.0 μl,灭菌双蒸水8 μl。PCR反应程序:95℃ 3 min;95℃ 5 s,60℃ 30 s,72℃ 25 s,35个循环;65℃ 5 min;95℃ 50 s,选取GAPDH或U6为内参基因。采用2-ΔΔCT表示基因的相对表达量。
1.2.7Western blot检测软骨组织中TLR4、NF-κB、IL-6和MMP-13蛋白表达量 采用组织全蛋白提取试剂盒对各组大鼠软骨组织进行蛋白提取;然后用BCA蛋白浓度检测试剂盒对所提蛋白进行浓度检测;紧接着取20 μg蛋白和4 μl 2×SDS上样缓冲液混合均匀,100℃变性10 min;上样,SDS-PAGE凝胶电泳分离后转至PVDF膜上;用5%脱脂牛奶封闭1 h;洗膜;PBS洗膜后分别加入一抗(TLR4、NF-κB、IL-6和MMP-13)在4℃下,孵育过夜;PBS洗膜;加入HRP标记的二抗羊抗兔IgG(1∶5 000),室温孵育0.5 h;PBS洗膜;用ECL化学发光法进行显色;以GAPDH为内参蛋白。
1.2.8软骨组织中软骨细胞凋亡检测(TUNEL染色) 取经固定后的各组大鼠部分膝关节软骨组织,依次经过:①常规步骤脱水浸蜡包埋;②切片:5 μm 左右;③烤片和脱蜡;④TUNEL染色;⑤中性树胶封片;⑥光镜下拍照、分析;确认并比较各组大鼠膝关节软骨组织中软骨细胞的凋亡情况。
1.2.9双荧光素酶报告试验验证miRNA-30b-5p与TLR4的靶向关系 首先,采用PCR扩增法获得大鼠TLR4基因3′非编码区(3′UTR)片段,然后通过双酶切法将TLR4基因3′UTR插入pGL3双荧光素酶报告载体获得TLR4 3′UTR野生型;同时合成TLR4 3′UTR突变片段,并插入pGL3双荧光素酶报告载体构建TLR4 3′UTR突变型;然后采用脂质体2000将TLR4 3′UTR野生型/突变型和miR-30b-5p mimics/NC转染进1.0×106个/孔的HEK-293T细胞中;转染48 h后,采用双荧光素酶报告基因分析系统检验各组细胞的荧光素酶活性。
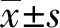
2 结果
2.1大鼠膝关节软骨组织病理学变化 HE染色结果显示(图1),正常组大鼠膝关节软骨组织结构正常,软骨细胞数目较多,排列整齐;模型组大鼠软骨组织结构层次不清,软骨层薄而粗糙,细胞数目少,排列散乱,潮线断裂,出现明显的炎症细胞浸润;与模型组比较,单一针灸组及联合治疗组大鼠软骨组织结构尚清晰可见,软骨细胞稍增多,排列尚整齐,潮线趋于完整,炎性细胞浸润减少。
2.2ELISA检测滑膜液TNF-α、IL-1β、IL-6和MMP-13的分泌水平 ELISA检测结果显示(表1),与正常组比较,模型组大鼠滑膜液中TNF-α、IL-1β、IL-6和MMP-13的分泌水平均显著增加(P<0.01);与模型组比较,单一针灸组及联合治疗组大鼠滑膜液中TNF-α、IL-1β、IL-6和MMP-13的分泌水平均显著降低(P<0.01);与单一针灸组比较,联合治疗组大鼠滑膜液中TNF-α、IL-1β、IL-6和MMP-13分泌水平均显著降低(P<0.05;P<0.01)。
2.3软骨组织中miRNA-30b-5p、TLR4和NF-κB在mRNA水平上的表达 qRT-PCR检测结果显示(图2),与正常组比较,模型组大鼠软骨组织miRNA-30b-5p表达显著降低(P<0.01),而TLR4和NF-κB表达显著升高(P<0.01);与模型组比较,针灸组及联合治疗组miRNA-30b-5p表达显著升高(P<0.01),而TLR4和NF-κB表达显著降低(P<0.01);与针灸组比较,针灸联合miRNA-30b-5p-mimics治疗组miRNA-30b-5p表达显著升高(P<0.01),TLR4和NF-κB表达显著降低(P<0.05,P<0.01);而针灸联合siRNA-TLR4治疗组miRNA-30b-5p表达无显著变化,而TLR4和NF-κB表达显著降低(P<0.01)。
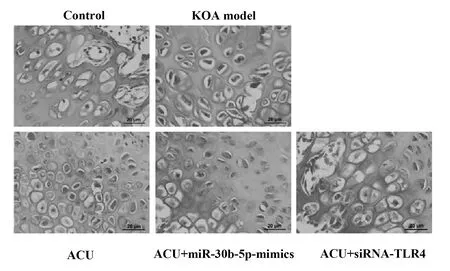
图1 软骨组织病理学变化检测(HE染色,×400)Fig.1 Detection of chondral histopathological changes(HE staining,×400)
表1 滑膜液中TNF-α、IL-1β、IL-6和MMP-13的分泌水平比较
Tab.1 Comparison of secretion levels of TNF-α,IL-1β,IL-6 and MMP-13 in synovial fluid

Group(n=8)TNF-α(pg/ml)IL-1β(pg/ml)IL-6(pg/ml)MMP-13(pg/ml)Control88.59±15.2656.78±8.6066.21±12.35101.26±13.25KOA model267.48±32.561)195.24±17.481)248.90±35.681)315.23±30.441)ACU184.26±26.242)134.56±12.242)187.59±16.212)214.48±17.592)ACU+miR-30b-5p mimics132.56±15.262)4)102.34±9.112)3)123.24±11.262)4)178.22±14.632)3)ACU+siRNA-TLR4128.22±16.042)4)89.31±8.472)4)106.92±10.242)4)152.31±13.882)4)
Note:Compared with control group,1)P<0.01;compared with KOA model group,2)P<0.01;compared with ACU group,3)P<0.05,4)P<0.01.
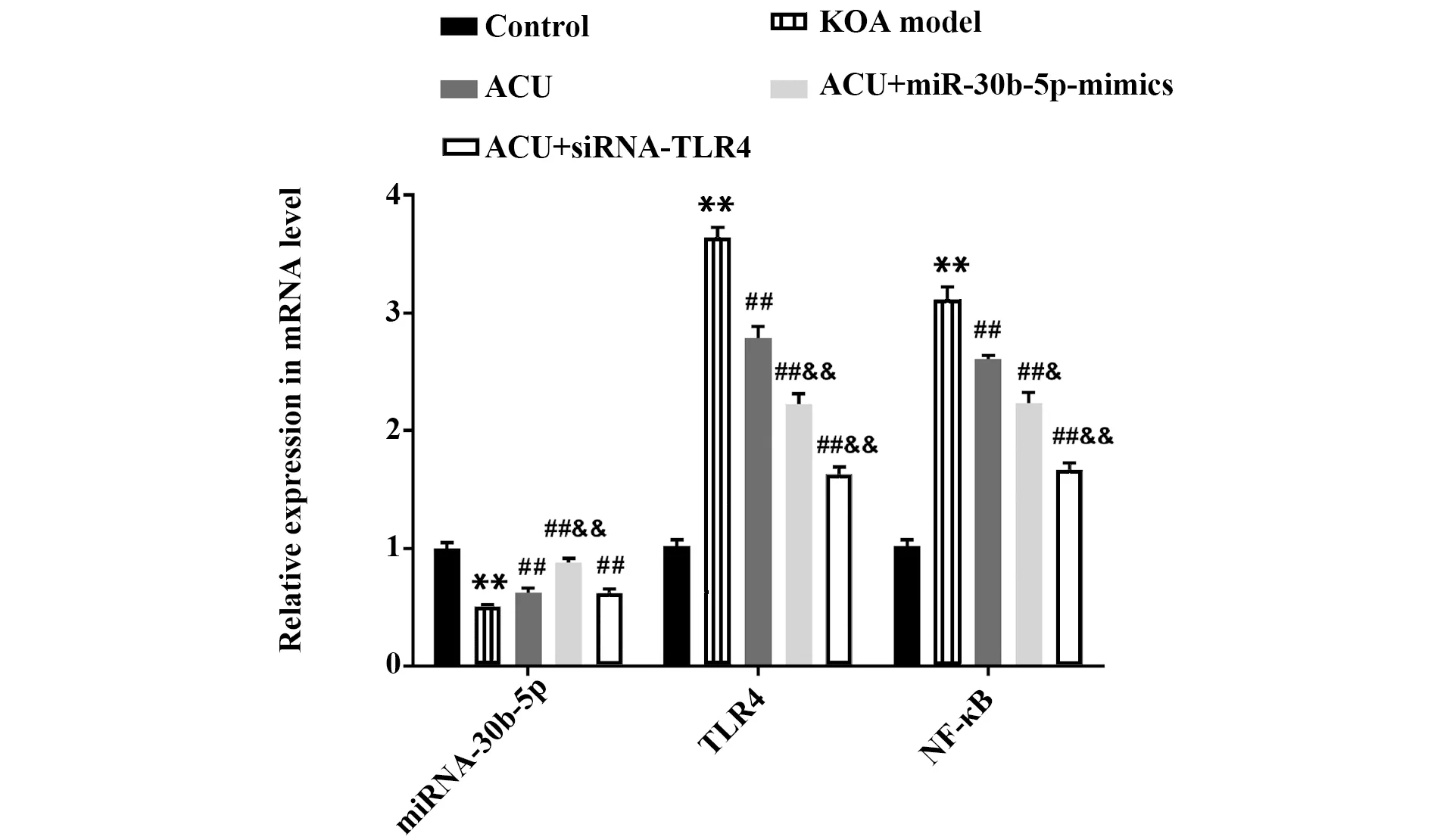
图2 各基因mRNA水平表达检测Fig.2 Detection of each gene mRNA level expressionNote:Compared with control group,**.P<0.01;compared with KOA model group,##.P<0.01;compared with ACU group,&.P<0.05,&&.P<0.01.
2.4软骨组织中TLR4、NF-κB、IL-6和MMP-13蛋白表达量 Western blot检测结果显示(图3),与正常组比较,模型组大鼠软骨组织TLR4、NF-κB、IL-6和MMP-13表达显著升高(P<0.01);与模型组比较,针灸组及联合治疗组TLR4、NF-κB、IL-6和MMP-13表达显著降低(P<0.01);与针灸组比较,针灸联合miRNA-30b-5p-mimics及siRNA-TLR4治疗组TLR4、NF-κB、IL-6和MMP-13表达不同程度降低(P<0.05,P<0.01)。

图3 各基因蛋白水平表达检测Fig.3 Detection of each gene protein level expressionNote:Compared with control group,**.P<0.01;compared with KOA model group,##.P<0.01;compared with ACU group,&.P<0.05,&&.P<0.01.
2.5TUNEL染色检测软骨组织中软骨细胞凋亡情况 TUNEL染色结果显示(图4),与正常组比较,模型组大鼠膝关节软骨组织中凋亡的软骨细胞明显增多;与模型组比较,单一针灸组和联合治疗组大鼠软骨细胞的凋亡现象显著减轻,凋亡细胞明显减少,其中联合治疗组大鼠软骨细胞凋亡现象减轻更显著。
图4 软骨细胞凋亡检测(TUNEL染色,×400)Fig.4 Detection of chondrocyte apoptosis(TUNEL staining,×400)
2.6miRNA-30b-5p与TLR4的靶向关系预测及验证 miRDB在线数据库预测结果显示(图5A),TLR4为miRNA-30b-5p的潜在靶基因;双荧光素酶报告试验结果显示(图5B),与转染了TLR4 3′UTR野生型的miRNA-30b-5p-NC组比较,转染了miRNA-30b-5p-mimics组的细胞荧光强度显著降低(P<0.01)。
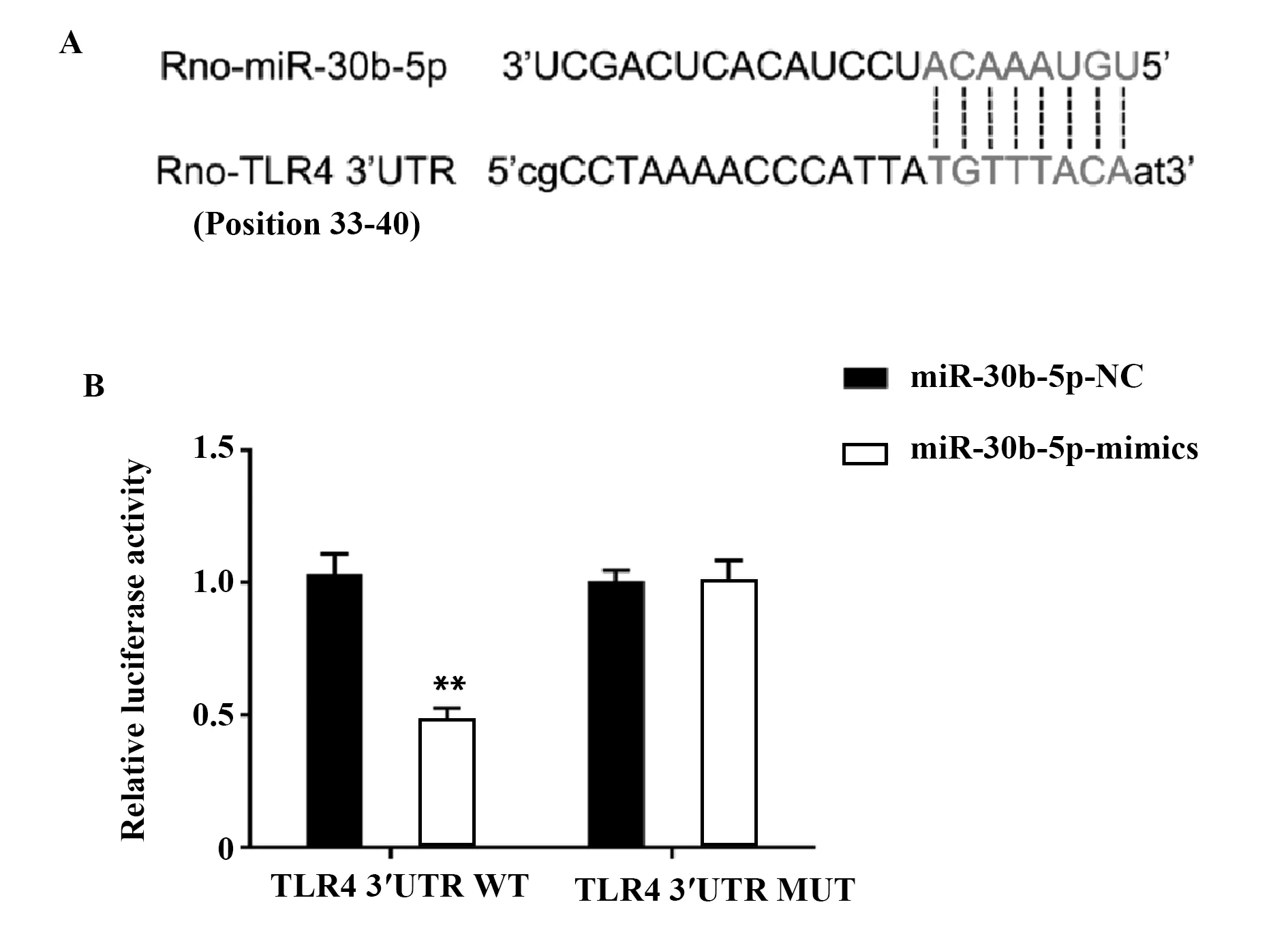
图5 miRNA-30b-5p与TLR4的靶向关系预测及验证Fig.5 Prediction and verification of targeted relationship between miRNA-30b-5p and TLR4Note:Compared with miRNA-30b-5p-NC in same group,**.P<0.01.
3 讨论
膝骨关节炎(KOA)是一种以关节软骨退变或破坏,伴有软骨下骨板、关节边缘骨质增生为主要病理变化的退行性关节病。该病始发部位在关节软骨,以老年人群最为常见,其症状是以关节疼痛、肿胀、功能障碍为主,60岁以上的人群中患病率可达50%,75岁以上的人群则达80%[8]。目前临床上对膝骨关节炎的治疗尚没有特效或治愈的方法,其治疗主要在于缓解临床症状。因此,寻求治疗KOA的有效手段,延缓本病的进展,改善其临床症状,提高患者生活质量,已成为目前预防保健和临床治疗研究的重点。
中医学认为KOA属于“痹症”范畴,其病因病机是由于机体肝肾亏虚,气血不足,感受风寒湿邪,筋脉闭阻,气血不畅,积久而发;该病以正虚为本,邪实为标[9]。针灸作为祖国医学的传统疗法,目前其治疗KOA仍以临床观察为主,治疗方法上主要针对痹症风湿寒淤及本虚的特点,采取祛风散寒除湿、活血化瘀通络的治疗措施。例如,梁超等[10]选取温针灸配合新型膝关节针灸箱治疗KOA患者,发现治疗总有效率及各症状评价变化率显著高于西药组。岳萍等[11]在兔KOA模型相关研究中发现,选用“内膝眼”“犊鼻”“血海”及“阳陵泉”等穴位进行温针灸干预能显著降低关节软骨中TNF-α、MMP-3水平,发挥抗炎作用。“足三里”穴是足阳明胃经之合穴,是对胃腑有直接作用的腧穴;而“阳陵泉”穴为八脉交会之筋会,有祛风散寒除湿,舒经通络之效[12]。本研究选取“足三里”及“阳陵泉”穴入针,结果发现能显著缓解KOA大鼠的膝关节软骨损伤,抑制炎症反应,且下调软骨组织中软骨细胞的凋亡水平。
TLR4/NF-κB信号通路是典型的炎症反应调节信号之一,TLR4的活化可以进一步增加NF-κB的表达量,进而引起下游炎症因子的转录调节,促使炎症反应发生。研究显示,TLR4/NF-κB信号通路参与KOA的发生、发展。例如,对因KOA而进行了膝关节置换术患者的关节软骨进行检测时发现,负重区软骨中TLR4及NF-κB的mRNA及蛋白表达量异常升高,提示TLR4/NF-κB信号通路介导的自身免疫可能参与了KOA的发病机制[13]。而通过药物或其他疗法靶向抑制TLR4/NF-κB信号已成为治疗KOA的有效途径。例如,白藜芦醇可能通过抑制TLR4/NF-κB信号通路发挥抗KOA效应[14]。而经筋微创疗法不仅能有效提升KOA患者的临床疗效;还能抑制KOA模型兔TLR4及下游MyD88、NF-κB的表达,阻断炎性细胞因子的分泌,减少软骨破坏,改善关节活动功能障碍、晨僵等症状,从而达到控制疾病进一步发展的目的[15]。上述结果表明,靶向抑制TLR4/NF-κB信号通路能有效缓解KOA的炎症反应,抑制KOA的发展进程。
近年来,miRNAs在疾病发生发展过程中的作用已成为研究热点。miRNA是一种非编码的小分子RNA,在基因的表达调控过程中起着非常重要的作用,其常规作用方式是通过与靶基因的3′UTR结合抑制靶基因的表达。miR-30家族不仅与癌症、肾小球疾病以及心肌肥大等疾病发生密切相关还被证明在成骨细胞分化过程中扮演着重要的负调节作用[16]。此外,miR-30家族成员还被证明在气管软骨细胞中高表达,且调控着软骨细胞的分化[17]。而miR-30家族在KOA的发生发展过程中的研究还比较少见。本研究发现,与对照组比较,在KOA大鼠膝关节软骨中,miR-30b-5p呈显著低表达,而TLR4及NF-κB呈异常高表达,我们猜测miR-30b-5p可能通过靶向调控TLR4/NF-κB进而促进KOA的进程,而这种关系可能通过针灸疗法而被逆转。因此,我们通过针灸联合miR-30b-5p-mimics或干扰miR-30b-5p的预测靶基因TLR4的表达来观察KOA大鼠的改善情况;结果发现,联合疗法的作用效果优于单一针灸疗法,提示针灸可能通过上调miR-30b-5p的表达进而抑制TLR4/NF-κB信号通路对KOA的影响。
综上所述,针灸治疗KOA模型大鼠具有显著疗效,其作用途径可能是通过调控miR-30b-5p/TLR4/NF-κB信号轴的表达,进而降低软骨细胞凋亡和炎症因子分泌来实现的,其对KOA大鼠的损伤修复具有积极作用。这为针灸治疗KOA提供了更加系统的科学理论,为后期针灸联合分子靶向疗法治疗KOA奠定基础。
