哮喘小鼠中髓样抑制细胞及Arg-1、iNOs的表达①
2019-12-27余孟珠单文琪吕剑平汪雪峰
余孟珠 李 莉 薛 菲 单文琪 吕剑平 汪雪峰
(江苏大学附属医院儿科,镇江 212001)
支气管哮喘是一种慢性气道炎症性疾病,严重危害儿童身心健康。其发病机制尚不十分清楚,但细胞因子在该炎症中所起的重要作用已受到国内外学者越来越多关注。髓样抑制细胞(Myeloid derived suppressor cells,MDSCs)是20世纪80年代在肿瘤患者体内发现一群异质性细胞群,源自骨髓祖细胞及未成熟髓细胞,具有强大的免疫调节功能[1,2]。MDSCs分两个亚群,一类为单核细胞样MDSC(M-MDSC),表达CD11b+Ly6G-Ly6Chigh表型,另一类为粒细胞样MDSC(G-MDSC),表达CD11b+Ly6G+Ly6Clow表型[3]。随着深入研究,MDSCs不仅在肿瘤发展中扮演重要角色,而且在病毒感染、败血症及自身免疫系统疾病中也起着重要作用[4]。国内外有研究发现,MDSCs在肺部过敏性炎症中也有高表达,同时参与哮喘肺部炎症、气道高反应及气道重塑发生发展[5,6]。研究表明,MDSCs可通过表达高水平的免疫抑制因子发挥免疫作用,如:精氨酸酶-1(Arginase-1,Arg-1)和诱导性一氧化氮合酶(inducible nitricoxide synthase,iNOs)等[7]。目前,MDSCs在哮喘病情进展中发挥作用的机理尚不明确。本文通过分析哮喘小鼠脾细胞中MDSCs两个亚群所占有核细胞比例,以及MDSCs产物Arg-1、iNOs在小鼠中表达水平,初步探讨MDSCs在哮喘发生发展中的可能作用机制。
1 材料与方法
1.1材料
1.1.1研究对象 选择6~8周龄雄性BALB/c小鼠,扬州大学动物研究中心购买[动物合格证号:SCXK(苏)2017-0007],实验中所用小鼠随机分为对照组(control)和哮喘组(OVA)进行造模,每组20只,所有小鼠均在江苏大学实验动物中心SPF级环境中饲养。
1.1.2主要试剂 卵清蛋白(OVA,V级)购自美国Sigma公司;goat anti-mouse IgE购自美国Abcam公司;HRP-conjugated rabbit anti-goat secondary IgE购自中国Multisciences公司;FITC anti-mouse CD11b、PE anti-mouse Ly-6C、APC anti-mouse Ly6G购自美国Biolegend公司;逆转录试剂盒购自日本TaKaRa公司;荧光定量PCR试剂盒All-in-oneTMMix购自美国Genecopoeia公司;NOS2 Polycional Antibody、ARG1 Polycional Antibody、GAPDH Polycional Antibody、HRP Goat Anti-Rabbit IgG购自美国ABclonal公司。
1.2方法
1.2.1哮喘模型建立 分别于第1、8和15天,哮喘组小鼠给予腹腔内注射抗原混合溶液 0.2 ml(含OVA 50 μg、10%氢氧化铝),对照组给予腹腔注射磷酸缓冲盐溶液(Phosphate buffer saline,PBS)0.2 ml。第22天开始,哮喘组小鼠每日雾化吸入2% OVA进行哮喘激发,每次30 min,每日1次,持续至第28天,共计7 d。对照组小鼠给予PBS雾化替代。
1.2.2支气管肺泡灌洗液收集 结扎左主支气管后,取预冷的PBS缓冲液1 ml,分3次缓慢冲洗右肺,收集支气管肺泡灌洗液(Bronchoalveolar lavage fluid,BALF),裂解红细胞后进行细胞计数,计数完成后离心取细胞沉渣涂片,瑞氏染色后计数嗜酸细胞(Eosnophils,EOS)百分比。
1.2.3血清OVA特异性抗体IgE检测 取小鼠眼球血约1 ml,室温静置30 min后,3 000 r/min,离心15 min取上层血清。采用ELISA法检测血清OVA特异性抗体IgE水平,在450 nm处测吸光度(OD)值。
1.2.4肺组织病理评分 取小鼠左肺组织切片进行HE染色,光镜下进行观察。参考文献[8]对病理组织切片进行炎症评分。
1.2.5PBMC的提取及MDSCs细胞检测 小鼠麻醉处死后,仰卧位固定,暴露腹腔取脾脏,加入Stanning buffer(含2%胎牛血清的PBS溶液)研磨成单个核细胞,将得到的脾细胞悬液离心弃上清,加入1 ml buffer重悬细胞后,每管加入12 ml红细胞裂解液,静置3 min,充分裂解红细胞,离心弃上清,洗一遍后进行过滤,再次离心弃上清,用buffer洗一遍,重悬后计数。取每管106个细胞加入100 μl buffer混匀,分别加入FITC anti-mouse CD11b、PE anti-mouse Ly-6C及APC anti-mouse Ly6G,4℃避光染色30 min,加入buffer洗2遍,加入400 μl的buffer混匀,用流式细胞仪检测。
1.2.6qRT-PCR检测Arg-1、iNOs mRNA表达 提取脾细胞及肺组织总RNA,逆转录得到cDNA,按照All-in-oneTMMix试剂盒说明书,分别进行实时荧光PCR检测Arg-1、iNOs、GAPDH。用GAPDH对目的基因表达进行标准化。引物由美国Genecopoeia公司设计合成,货号如下:Arg-1(No.MQP026580)、iNOs(No.MQP029793)、GAPDH(No.MQP027158)。
1.2.7Western blot法检测Arg-1、iNOs蛋白表达 提取肺组织蛋白,定量后经SDS-PAGE电泳分离,电转移至硝酸纤维素膜上,室温下5%脱脂奶粉封闭,将配置好的一抗(用1% BSA以1∶1 000稀释)分别倒入孵育盒,将封闭后用TBST清洗后放入一抗中,4℃过夜,TBST洗涤3次,加入HRP标记的抗兔二抗(以1∶5 000稀释),室温孵育2 h,TBST洗涤5次,加入ECL发光液作用后曝光,最后采用Image-Pro Plus 6.0软件进行蛋白条带的半定量分析。
1.3统计学处理 采用GraphPad Prism 5软件进行统计分析,以非配对t检验分析两组间差异,以P<0.05为差异有统计学意义。
2 结果
2.1两组小鼠BALF细胞计数和EOS百分比结果比较 结果如图1所示,哮喘组小鼠支气管肺泡灌洗液中细胞总数及嗜酸性粒细胞百分比显著高于对照组(P均<0.05)。
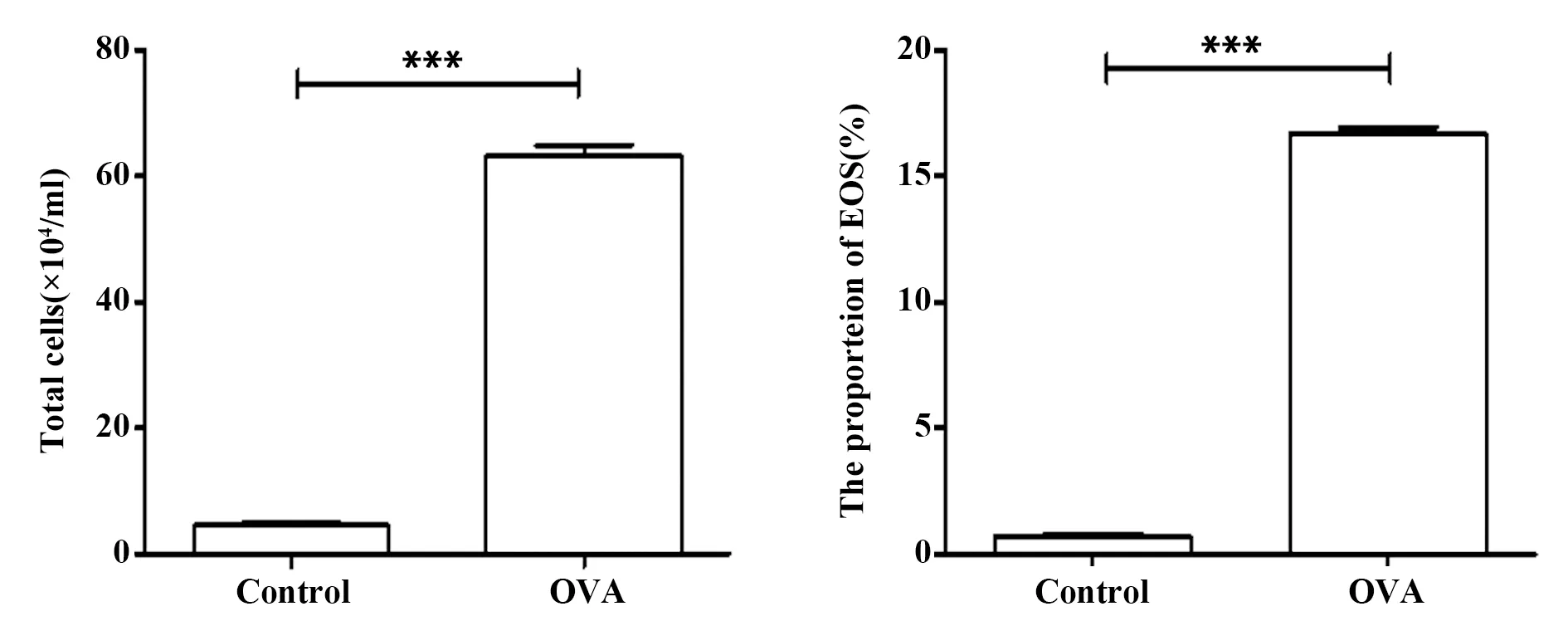
图1 BALF细胞计数和EOS百分比Fig.1 Number of total cells and proportion of eosinophils in BALFNote:
2.2两组小鼠血清OVA特异性抗体IgE水平结果比较 如图2所示,与对照组相比,哮喘组小鼠血清OVA特异性抗体IgE表达水平明显增高(P<0.05)。
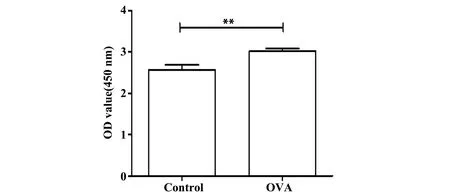
图2 血清OVA特异性抗体IgE水平Fig.2 Level of Anti-OVA-specific IgE in serum of miceNote:
2.3两组小鼠肺组织病理结果比较 与对照组相比,哮喘组小鼠肺组织支气管管壁增厚,管腔狭窄,肺泡间隔增厚,支气管及血管周围炎症细胞浸润明显。炎症评分较对照组明显增高(P<0.05),见图3。
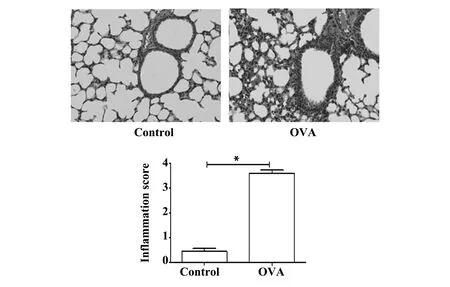
图3 肺组织病理切片结果Fig.3 Pathological section of lung tissue and inflamma-tion scoreNote:
2.4两组小鼠脾细胞中MDSCs两个亚群占有核细胞比例 流式细胞术检测两组小鼠脾细胞中MDSCs两个亚群占有核细胞比例,如图4所示,哮喘组小鼠脾细胞中G-MDSC亚群细胞所占比例明显高于对照组(P<0.001),而两组间M-MDSC亚群无明显差别(P>0.05)。
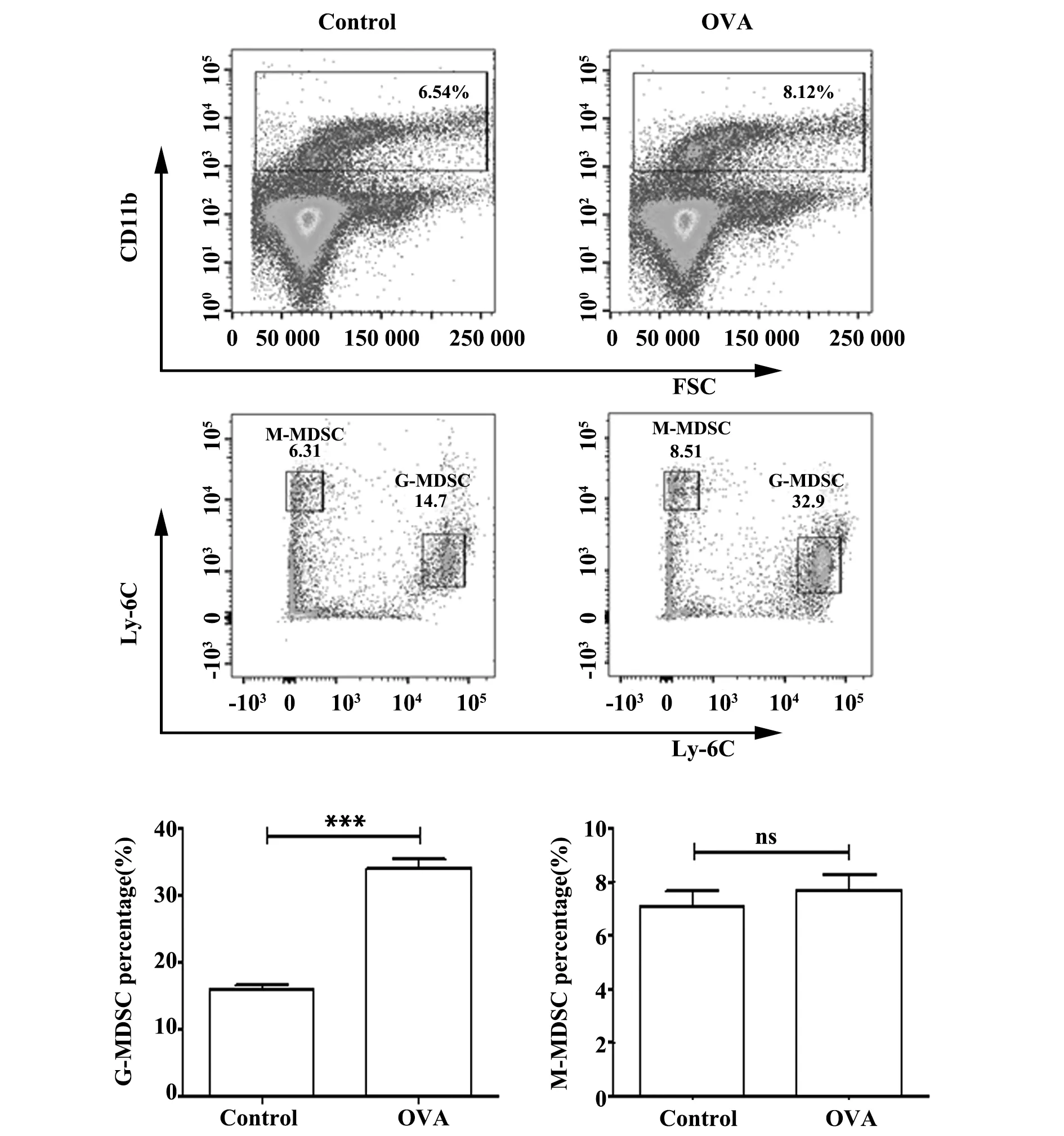
图4 流式细胞术检测脾细胞中MDSCs细胞比例Fig.4 Percentage of MDSCs were analyzed by flow cytometryNote:
2.5两组小鼠脾细胞中Arg-1、iNOs mRNA表达水平 采用qRT-PCR检测Arg-1、iNOs mRNA的表达,结果如图5所示,与对照组相比,哮喘组小鼠脾细胞中Arg-1 mRNA的表达水平明显升高(P<0.01);iNOs mRNA的表达明显降低(P<0.001)。
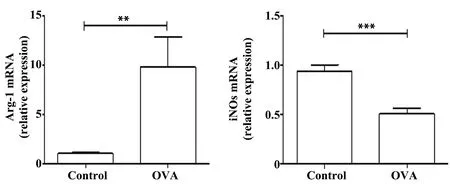
图5 小鼠脾细胞中Arg-1、iNOs mRNA的表达Fig.5 Expression of Arg-1 and iNOs mRNA in spleen of mice Note:
2.6两组小鼠肺组织中Arg-1、iNOs mRNA表达 采用qRT-PCR检测小鼠肺组织中Arg-1、iNOs mRNA的表达,结果如图6所示,与对照组相比,哮喘组小鼠肺组织中Arg-1 mRNA的表达水平明显升高(P<0.001),iNOs mRNA的表达明显降低(P<0.001)。
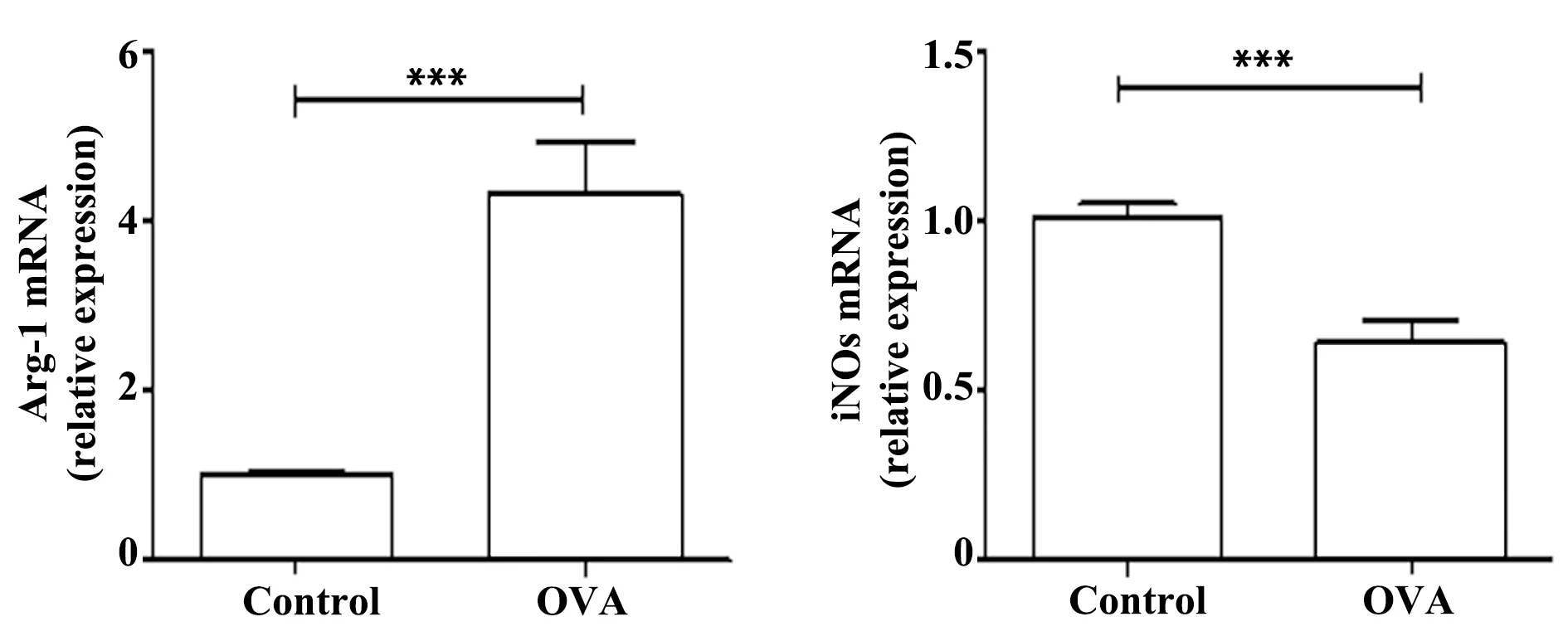
图6 小鼠肺组织中Arg-1、iNOs mRNA的表达 Fig.6 Expression of Arg-1 and iNOs mRNA in lung of miceNote:
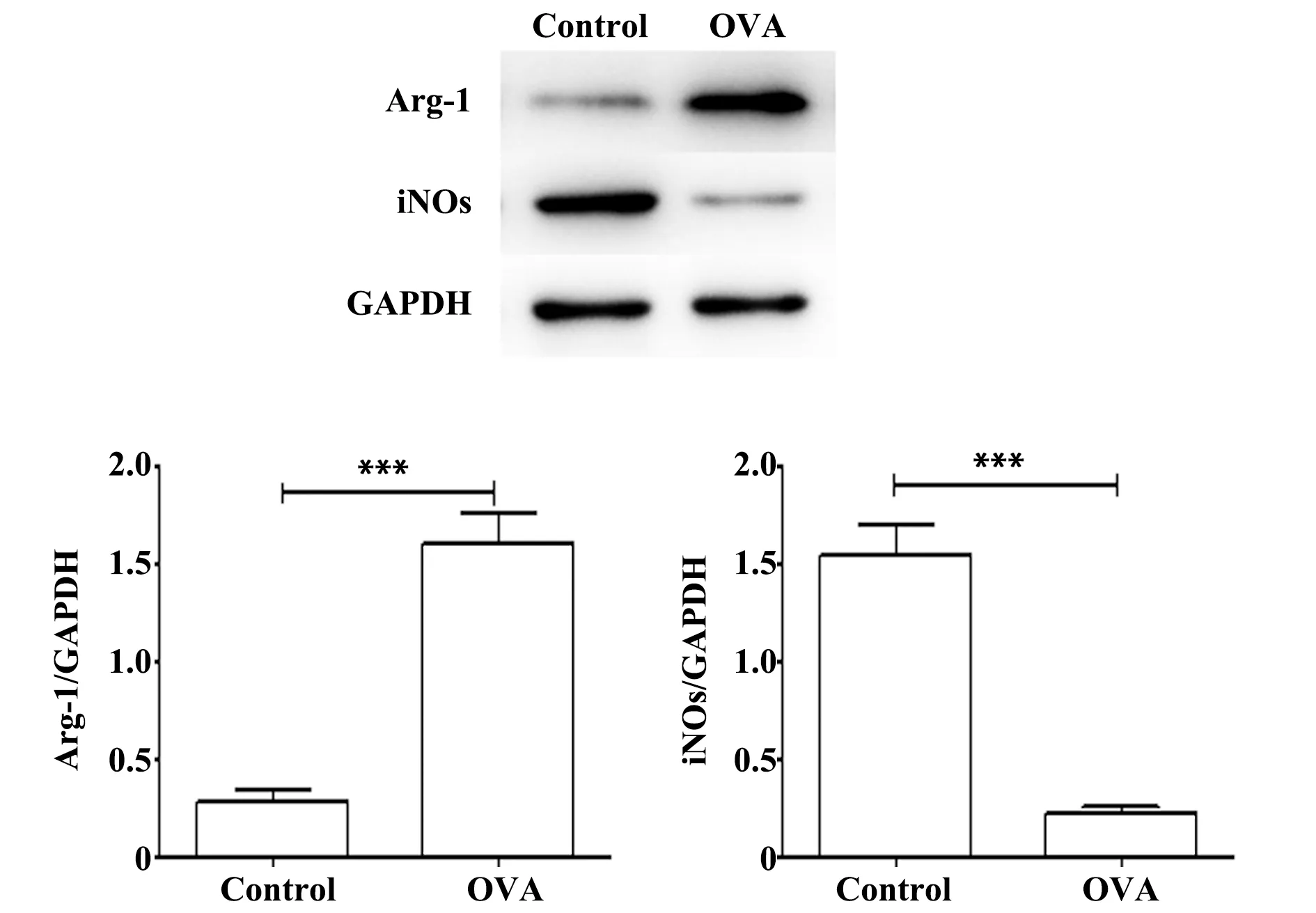
图7 小鼠肺组织中Arg-1、iNOs蛋白表达水平Fig.7 Protein expression of Arg-1 and iNOs in lung of miceNote:
2.7两组小鼠肺组织中Arg-1、iNOs蛋白表达 采用Western blot法检测小鼠肺组织中Arg-1、iNOs蛋白水平的表达,结果如图7所示,与对照组相比,哮喘组小鼠肺组织中Arg-1蛋白水平表达水平明显升高(P<0.001),iNOs蛋白的表达明显降低(P<0.001)。
3 讨论
支气管哮喘是全世界范围内儿童最常见的慢性下呼吸道疾病。本研究中,哮喘组小鼠经OVA致敏及雾化激发后,呈现出明显的头面部瘙痒、安静少动、弓背、前肢抬起、大小便失禁等哮喘急性发作的表现,其BALF中细胞总数、EOS百分比及血清OVA特异性抗体IgE表达水平与对照组相比明显增高,肺组织病理切片HE染色显示,支气管管壁增厚,管腔狭窄,腔内可见大量的黏液,支气管及血管周围可见大量炎性细胞浸润,符合哮喘的病理改变,提示哮喘模型制备成功。
MDSCs是骨髓来源的一群异质性细胞,不仅参与肿瘤的发生、转移和增殖,而且在病毒感染、败血症、急慢性非特异性炎症、哮喘、创伤以及其他自身免疫疾病中起重要作用。支气管哮喘是一种以多种细胞浸润和气道高反应为特征的慢性气道炎症性疾病,目前已知与Th1/Th2、Th17/Treg失衡相关[9,10],但其具体发病机制尚未完全清楚。我们前期研究发现,在反复喘息患儿外周血中MDSCs比例明显升高于肺炎组及正常对照组[11],这与文献报道MDSCs在哮喘患儿体内表达升高是一致的[12],然而,哮喘发病过程中MDSCs具体作用机制尚不明确。
研究表明,MDSCs可产生高水平的免疫抑制因子Arg-1、iNOs和活性氧(ROS),而Arg-1和iNOs在抑制T细胞功能方面的作用已被证实[13]。Arg-1可将L-精氨酸转化为L-鸟氨酸和尿素,iNOs可产生NO。MDSCs产生的Arg-1活性增加可导致L-精氨酸分解代谢增强,进而从微环境中消耗这种非必需氨基酸,而L-精氨酸与T细胞增殖调节密切相关。L-精氨酸缺乏抑制T细胞增殖可通过不同的途径,包括减少T细胞受体(TCR)CD3ζ链的合成以及TCR信号通路转导障碍等[7]。NO与O2-合成具有强氧化能力的过氧亚硝酸盐(ONOO-),可导致TCR和CD8分子的硝化,从而诱导T细胞的凋亡。
本研究中两组小鼠脾细胞中MDSCs细胞比例结果显示,哮喘组G-MDSC与对照组相比明显升高,M-MDSC亚群结果比较两组间差异无统计学意义,推测MDSCs在哮喘发展中可能由G-MDSC亚群起主要作用。尽管大多文献报道MDSCs高表达Arg-1、iNOs[14],但也有文献报道MDSCs表达的Arg-1、iNOs存在差异,例如,王瑞等[15]发现,与正常小鼠相比,在胶原诱导关节炎小鼠中MDSCs产物iNOs的表达升高,Arg-1的表达降低。而我们发现与对照组相比,哮喘组小鼠脾细胞及肺组织中Arg-1 mRNA表达均升高,iNOs mRNA表达均减少,且在小鼠肺组织中Arg-1及iNOs蛋白表达水平与此是一致的。由此推测,不同疾病状态下机体微环境变化可能影响Arg-1和iNOs的表达,MDSCs可能通过高表达Arg-1参与哮喘小鼠气道炎症反应。也有研究表明,IL-4和IL-13可诱导产生Arg-1,IFN-γ可诱导产生iNOs[16]。Th1细胞主要分泌IFN-γ、IL-12和TNF-β,Th2细胞主要分泌IL-4、IL-5、IL-9和IL-13等,哮喘状态下存在Th1/Th2失衡,低表达的Th1细胞因子、高表达的Th2细胞因子是否诱导了Arg-1的高表达,抑制了iNOs的低表达,需要进一步实验研究。
综上所述,本研究结果显示MDSCs尤其是G-MDSC亚群参与哮喘气道炎症反应,MDSCs可能通过高表达Arg-1、低表达iNOs参与哮喘小鼠气道炎症反应,需要进一步实验明确MDSCs及其Arg-1、iNOs产物对哮喘发病过程中T细胞反应的影响,从而为以MDSCs为靶点的哮喘治疗提供实验依据。
