热灭活的大肠埃希菌促进照射后小鼠粒系造血及生存①
2019-12-27郭荣霞张潇予罗鸿博许元富
郭荣霞 张潇予 刘 飞 刘 鹏 王 彤 罗鸿博 许元富
(中国医学科学院,北京协和医学院血液病医院血液学研究所,实验血液学国家重点实验室,天津 300020)
目前,放疗仍是临床治疗肿瘤的重要手段,但是放射线在杀伤肿瘤细胞的同时也不可避免地杀伤了正常组织细胞,尤其是血液系统对放射线比较敏感,易被诱发遗传物质的损伤,从而发生凋亡和坏死。造血系统的损伤导致患者骨髓抑制、免疫力减低,引发感染、脏器衰竭等并发症,是患者产生副作用甚至死亡的主要原因[1-3]。因此,如何有效促进放疗后骨髓粒系造血恢复是目前临床面临的一项重大问题。
成体哺乳动物的粒系造血发生在骨髓内,多种细胞因子参与其中,如粒细胞集落刺激因子(Granulocyte colony stimulating factor,G-CSF)、IL-6、IL-3、粒细胞-巨噬细胞集落刺激因子(Granulocyte-macrophage colony stimulating factor,GM-CSF)、IL-1β等炎症因子均可直接或间接作用于造血干细胞(Hematopoietic stem cell,HSC)、多能祖细胞(Multipotent progenitor cell,MPP)、粒系-巨噬系祖细胞(Granulocyte-macrophage progenitor cell,GMP)等造血干/祖细胞来调控粒系造血。中性粒细胞作为机体防御外来微生物入侵的第一道防线,在天然免疫系统中起着非常重要的作用。它来源于骨髓内的HSC,HSC向下分化形成MPP,MPP再向下游分化为多种定向祖细胞,其中GMP向粒系分化的过程需要经历一系列的分化阶段,即原始粒细胞(Myeloblast,MB)、早幼粒细胞(Promyelocyte,PM)、中幼粒细胞(Myelocyte,MC)、晚幼粒细胞(Metamyelocyte,MM)以及杆状核和分叶核粒细胞(Band cell and segmented cell,BC & SC),最终才能形成功能成熟的中性粒细胞[4,5]。
细菌内毒素能够提高照射后小鼠的生存率,IL-1β、TNF-α、IL-6、IL-12等炎症因子具有与内毒素类似的效应,能够促进照射后小鼠的造血恢复,且协同作用效果更佳[6-11]。HIE.coli能够促进IL-1β、G-CSF、TNF-α、IL-6等炎症因子的分泌与释放,通过建立HIE.coli诱导的腹腔炎症模型,能有效观察各炎症因子的协同作用对造血系统的影响。我们实验室前期工作发现了运用HIE.coli建立腹腔炎症模型可以诱导急性粒系造血[12],但是否对放疗后造血恢复有作用尚不可知。本研究通过对接受全身照射的HIE.coli腹腔炎症模型小鼠造血系统恢复情况的检测,发现HIE.coli诱导的小鼠体内急性炎症微环境影响了骨髓造血干/祖细胞,尤其是粒系-巨噬系祖细胞,促进照射后小鼠粒系的恢复,提高了照射后小鼠的生存率。
1 材料与方法
1.1材料
1.1.1实验动物 实验所用小鼠均由本院动物中心代购自北京华阜康实验动物有限公司或北京维通利华实验动物有限公司,所有小鼠品系均为C57BL/6(白细胞抗原表型CD45.2),8~12周龄。实验过程中所有小鼠均饲养于中国医学科学院北京协和医学院血液学研究所动物管理中心的SPF级动物房;实验获得中国医学科学院北京协和医学院血液学研究所动物管理中心及伦理委员会的批准。
1.1.2主要试剂及仪器 小鼠抗体:lineage cell detection cocktail(Miltenyi Biotec GmbH,130-092-613)、streptavidin-PE/CY7(BioLegend,cat 405206)、FITC-anti mouse CD34(eBioscience,11-0341-82)、APC/CY7-anti-mouse Sca-1(BioLegend,cat 108125)、APC-anti mouse CD117(c-kit)(BioLegend,cat 105811)、PE-anti-mouse Ly6G(BioLegend,cat 127608)、Biotin anti-mouse-CD45R/B220(BioLegend,cat 103222)、Biotin anti-mouse-CD45R/CD8a(BioLegend,cat 100704)、Biotin anti-mouse-Ter-119(BioLegend,cat 116204)、Biotin anti-mouse CD4(BioLegend,cat 100508);流式细胞仪(Canto Ⅱ)购自BD公司,血球计数仪(XT2000i)购自Sysmex公司。微生物摇床购自Beckman公司,酶标仪(Synergy H4)购自BioTek公司。
1.1.3HIE.coli实验用E.coli为菌种Escheri-chia coli,strain 19138,购自美国ATCC。
1.2方法
1.2.1HIE.coli致小鼠急性腹腔炎症模型 实验用E.coli菌种保存在-80℃的菌种冻存液中,使用前经过二次活化,使菌达到良好的生长状态,即指数生长期。经70℃加热菌体悬液30 min,放置室温后给每只小鼠腹腔注射1×107CFU。
1.2.2辐射损伤模型的建立 小鼠腹腔注射HIE.coli24 h后,根据实验需求采用不同辐射剂量处理小鼠。本文所使用的辐射装置为RS2000系列生物学X-ray辐射仪,购自Rad Source公司,电压为160 V,电流为25 mA,剂量率为1.2 Gy/min。
1.2.3外周血血细胞检测 小鼠尾巴末端或眼球后静脉窦取血20 μl,置于PBSE(含0.02%EDTA的PBS溶液)溶液中,血液与PBSE溶液的体积比为1∶4,以达到抗凝和稀释的作用。应用全自动血常规检测仪分析外周血细胞的数目和分类。
1.3统计学处理 统计学分析采用GraphPad Prism 5.0软件进行数据分析。组间均值比较采用t检验。P<0.05表示差异有统计学意义。
2 结果
2.1HIE.coli预处理提高了照射后小鼠的生存率 将HIE.coli腹腔注射到小鼠体内建立急性腹腔炎症模型,每只小鼠注射1×107CFU/300 μl,对照组注射等量体积的生理盐水(Normal saline,NS),24 h后,给予小鼠7 Gy照射并观察其状态及生存(图1)。结果显示对照组(n=7)中大多数小鼠在照射后第8天不良症状明显,主要表现为:体重减轻,毛发缺乏光亮,眼睛无神,食欲下降,身体蜷缩等,且在照射后第10天、第11天、第12天分别有3只(43%)、1只(14%)、3只(43%)小鼠死亡,即对照组在照射后第10天到第12天内全部死亡,死亡率为100%。而HIE.coli预处理后(n=7)明显提高了照射后小鼠的生存率,实验组仅在照射后第17天有1只小鼠死亡,明显晚于对照组,且在后期(照射后30 d内)并无小鼠死亡,即死亡率仅为14%,明显低于对照组。这些结果表明照射前用HIE.coli预处理小鼠能够明显提高照射后小鼠的生存率。
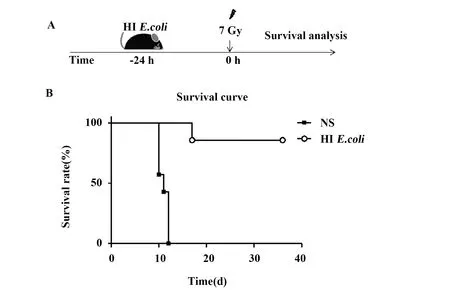
图1 生理盐水和热灭活的大肠埃希菌预处理对7 Gy照射后小鼠的生存情况的影响Fig.1 Impact of pretreatment with heat-inactivated E.coli(HI E.coli)to mice irradiated by 7 Gy compa-red to normal saline(NS)Note: A.Schematic of the experiment process;B.The survival rate.*.P<0.05,**.P<0.001,***.P<0.000 1.
2.2照射后小鼠的造血系统严重受损 给予小鼠7 Gy照射,分别在照射后1、2、4、7、9、12 d检测照射后小鼠的受损情况。结果发现,辐射后小鼠的造血系统严重受损(图2),主要表现为:小鼠骨髓细胞总数在照射后急剧下降,第4天到第7天降到最低水平,每根股骨仅有1×105个细胞,7 d后开始恢复(图2B);脾脏的重量在照射后1 d骤降,到第7天降到最低水平,仅有(0.020±0.002 1)g,约为正常脾重的1/4,同骨髓细胞总数一样,脾脏细胞数在照射7 d后开始恢复(图2C);外周各种血细胞急剧减少,其中红细胞、血红蛋白、血小板逐渐减少(图2F),白细胞、单核细胞、淋巴细胞、嗜酸性粒细胞在照射后1 d之内急剧下降到最低水平,中性粒细胞在照射后迅速降低,仅在第2天略有升高,之后即维持在最低水平,第7天开始恢复(图2G~J)。
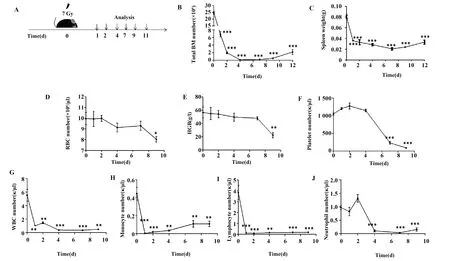
图2 小鼠经7 Gy辐射后的造血系统损伤和血象变化Fig.2 Injury to hematopoietic system and hemogram of mice irradiated by 7 GyNote: A.Schematic of the experiment process;B.Total bone marrow number;C.Spleen weight;D-J.Different cell type in peripheral blood(PB).*.P<0.05,**.P<0.001,***.P<0.000 1.
这些结果表明经7 Gy照射后,小鼠的外周血以及骨髓、脾脏在内的造血器官均严重受损,在照射后第3天至第7天骨髓处于抑制状态,主要表现为粒细胞、血小板以及红细胞、淋巴细胞减少。在此期间,血细胞减少会导致出血、贫血;同时,照射也会损伤肠黏膜,使得肠道菌群释放引发感染;而粒细胞的缺乏还会增加细菌、真菌等病原微生物感染的风险。这些都是导致小鼠照射相关高死亡率的重要原因。因此,及时促进照射后小鼠造血系统的恢复对提高生存率具有重要意义。
2.3HIE.coli预处理促进照射后小鼠造血系统的恢复 由于经7 Gy照射后,小鼠骨髓恢复速度较慢,且死亡率较高,不利于对造血干/祖细胞以及粒系各阶段前体细胞的分析。为了观察照射后骨髓恢复的规律,我们采用非致死剂量(4 Gy)照射小鼠,实验组小鼠在照射前24 h用HIE.coli预处理小鼠(1×107CFU/mouse),对照组腹腔注射等体积的生理盐水。在照射后第7天检测小鼠外周血、脾脏、骨髓造血的恢复情况发现(图3):照射后第7天,实验组小鼠和对照组相比,经HIE.coli预处理的小鼠造血恢复明显加快,主要表现为:脾脏明显增大(P=0.002 8),且有脾结节(图3B、D);骨髓细胞数目增多(P<0.001)(图3E),病理报告显示,HIE.coli预处理的小鼠骨髓增生明显活跃(包括粒系、红系、巨核系),且以粒系为主(图3C);外周血红细胞、血红蛋白、血小板数目均有一定程度的增多;白细胞总数也增多,淋巴细胞、单核细胞、嗜酸性粒细胞没有明显差异,但中性粒细胞数目明显增多(P<0.05)(图3F)。
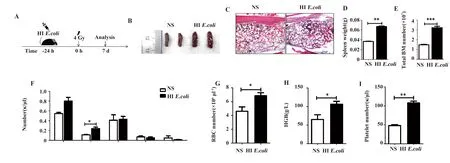
图3 小鼠经4 Gy照射后第7天的造血恢复能力的比较和分析Fig.3 Comparison and analysis recovery ability of hematopoietic system of mice irradiated by 4 Gy at day 7Note: A.Schematic of the experiment process;B.Spleen;C.Bone marrow biopsy(HE staining was performed on femur sections);D.Spleen weight;E.Total bone marrow number;F-I.Different cell types in PB.*.P<0.05,**.P<0.001,***.P<0.000 1.
2.4HIE.coli预处理促进照射后小鼠骨髓造血干/祖细胞及粒系的恢复 造血干/祖细胞是所有血细胞和免疫细胞的来源,有效促进照射后小鼠造血干/祖细胞的恢复对小鼠生存率的提高具有重要作用。我们发现HIE.coli预处理组和对照组相比,骨髓中的LSK(lin-Sca-1+c-kit+)比例虽无统计学差异,但绝对数略有升高(P<0.05)。此外,包括LK(lin-Sca-1-c-kit+)、髓系共同祖细胞(Comment myeloid progenitor,CMP)(LK CD34+CD16/32-)在内的造血祖细胞的比例和绝对数相较于对照组均明显增多,其中GMP(lin-Sca-1-c-kit+CD34+CD16/32+)最为明显(P<0.001)(图4A~C)。GMP可进一步增殖分化成原始粒细胞、早幼粒细胞、中幼粒细胞、晚幼粒细胞以及杆状核和分叶核粒细胞[5]。因此,我们进一步检测了骨髓粒系分化的情况,发现HIE.coli预处理组粒系分化明显加快(P<0.05)(图4D~F)。
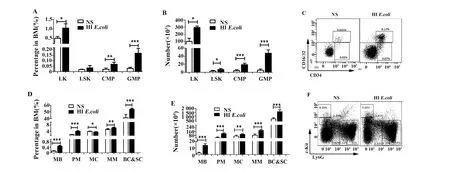
图4 小鼠经4 Gy照射后第7天造血干/祖细胞(A)、粒系细胞(B)的恢复的比较和分析Fig.4 Comparison and analysis recovery of hematopoietic stem/progenitor cells(A)and granulocytes(B)of mice after irradiated by 4 Gy at day 7Note: A-C.The recovery of hematopoietic stem/progenitor cells after irradiation;D-F.The recovery of granulocytes after irradiation.*.P<0.05,**.P<0.001,***.P<0.0001.
以上结果表明HIE.coli预处理能够促进照射后小鼠外周血以及骨髓、脾脏等造血器官的恢复,且能通过作用于GMP来促进粒系造血,从而提高了照射后小鼠的生存率。
3 讨论
放疗是当前治疗肿瘤的常用手段,而造血系统对放射线比较敏感,易被诱发凋亡或坏死,造血系统的损伤可导致患者骨髓抑制、免疫力减低,易发生感染、脏器衰竭等并发症,是患者治疗相关高死亡率的重要原因。血细胞及免疫细胞来源于造血干/祖细胞的增殖分化,促进造血干/祖细胞的增殖分化对照射后小鼠的恢复意义重大。
细菌内毒素能够提高照射后小鼠的生存率,近年来越来越多的研究发现IL-1β、IL-6、TNF-α等炎症因子能够明显促进照射后小鼠造血的恢复,且协同作用效果更佳[6-11]。HIE.coli能够促进IL-1β、G-CSF、TNF-α、IL-6等炎症因子的分泌与释放,此外,我们实验室前期工作发现运用HIE.coli建立的腹腔炎症模型可以诱导急性粒系造血[12],但是对放疗后小鼠造血系统的影响尚未进行研究。Neta等[7]研究表明在照射前腹腔给予IL-1β能够明显提高小鼠的生存率,而照射后再用IL-1β挽救则无明显效果,随后又有多个实验室报道了IL-1β的这种效应[13,14]。因此,我们在照射前24 h腹腔局部注射HIEcoli建立小鼠腹腔炎症,通过这个模型来研究炎症因子对照射后造血系统的影响,避免了某个炎症因子作用的单一性,从而有效利用了HIE.coli刺激后各炎症因子的协同作用。本研究结果表明经HIE.coli诱发的急性腹腔炎症能够明显提高照射后小鼠的生存率,且从小鼠外周血各细胞类型的数量、脾脏的大小以及骨髓细胞总数、造血干/祖细胞等方面来看,HIE.coli诱发的急性腹腔炎症能够明显促进照射后小鼠造血系统的恢复,其中粒系恢复较对照组最为明显。本研究发现经非致死剂量(4 Gy)照射后第7天,实验组与对照组相比造血恢复明显加快。我们实验室前期工作发现腹腔注射HIE.coli36 h后,造血祖细胞BrdU阳性率明显增多[12],说明HIE.coli腹腔注射36 h内便会有造血祖细胞的增殖;Pietras等[15]证明炎症因子可促进造血干/祖细胞的增殖分化,均提示HIE.coli诱导的炎症反应能够促进造血恢复。因此,我们猜测照射后实验组小鼠造血恢复加快一方面可能是因为炎症反应促进了机体中大量的炎症因子的产生,改变了骨髓中的造血微环境,激活了造血干/祖细胞的抗凋亡或促存活机制,导致一些造血干/祖细胞产生抗辐射效应[16];另一方面,我们猜测HIE.coli诱导的炎症促进造血干/祖细胞的数目增多,导致S期(放射不敏感)造血干/祖细胞的数目增多[17]。总之,本研究发现HIE.coli诱导的炎症反应最终促进了照射后小鼠的造血恢复,其中GMP最为明显,其具体机制还需要进一步的工作去证实。
我们已知HSC、MPP、GMP等造血干/祖细胞表面存在多种炎症因子受体,如白介素1受体(Interleukin-1 receptor,IL-1R)、粒细胞集落刺激因子受体(Granulocyte colony stimulating factor receptor,G-CSFR)、Toll样受体(Toll like receptor,TLR)等[18]。因此,这些炎症因子能够直接或间接作用于HSC、MPP、GMP等造血干/祖细胞并促进其增殖并向髓系分化[4,11]。但HIE.coli在促进IL-1β、IL-12、TNF-α、IL-6、SCF等具有照射保护作用的因子分泌的同时也会导致影响照射后小鼠生存质量的因子的释放,如TGF-β、INFα/β。因此,HIE.coli是如何作用于细胞并促进这些炎症因子的分泌与释放,如何在小鼠体内形成一个有效的炎症相关因子网络促进IL-1β、IL-12、TNF-α、IL-6、SCF的作用而抑制TGF-β、INFα/β的效应,如何作用于造血干/祖细胞促进其向粒系分化以达到照射后小鼠恢复的效应,这些问题目前还不清楚,有待我们进一步研究。
