肾上腺髓质素通过PI3K/Akt信号通路影响人牙髓干细胞增殖和凋亡的研究①
2019-12-27李文静李浩渤王菲菲刘从娜
李文静 李浩渤 王菲菲 刘从娜 郭 晗 王 燕
(河北医科大学第二医院口腔内科,石家庄 050000)
当牙体组织受到外伤、龋病等因素而损伤牙髓时,部分成牙本质细胞受到损伤发生变性,变性的牙本质细胞可由牙髓未分化间充质细胞代替形成牙本质,保护牙髓。牙髓中的牙髓干细胞具有多向分化潜能,可分化为成牙本质细胞、脂肪细胞、肌细胞、骨细胞等多种细胞,牙髓干细胞的增殖和分化在牙本质的修复性形成中具有重要作用,因此探讨牙髓干细胞增殖和凋亡的机制具有重要意义[1,2]。肾上腺髓质素具有诱导成骨、调节细胞凋亡、调节炎症反应、促进血管生成、促进细胞迁移等多种效应,在牙本质基质形成和牙齿发育中具有重要作用[3,4],有研究发现肾上腺髓质素可促进牙髓干细胞的增殖和分化[5],但其通过哪种信号通路促进牙髓干细胞增殖尚不清楚。磷脂酰肌醇3-激酶/蛋白激酶B(Phosphatidylinositol 3-kinase/protein kinase B,PI3K/Akt)信号通路在细胞增殖和凋亡中发挥重要作用,参与多种细胞的增殖和凋亡[6]。 本文对肾上腺髓质素对人牙髓干细胞增殖和凋亡以及PI3K/Akt信号通路的影响进行研究,探讨肾上腺髓质素在牙髓干细胞增殖和凋亡中的作用及可能机制,为临床提供依据。
1 材料与方法
1.1材料 组织来源:选取我院因正畸需要拔出的恒牙2颗,所选牙无根尖周炎、无龋坏、无牙周炎,且患者签署知情同意书。主要试剂和仪器:肾上腺髓质素、胰蛋白酶、DMEM培养基、胎牛血清(美国CST公司),PI3K/Akt通路抑制剂LY294002、四唑盐(Tetrazolium salt,MTT)试剂盒、BCA蛋白浓度检测试剂盒、细胞凋亡测定试剂盒(Annexin V-FITC/PI)(美国Invitrogen公司),鼠抗人CD44抗体、鼠抗人CD34抗体、兔抗人增殖细胞核抗原(Proliferating cell nuclear antigen,PCNA)多克隆抗体、兔抗人Cleaved Caspase-3多克隆抗体、兔抗人PI3K多克隆抗体、兔抗人磷酸化Akt(Phosphorylated Akt,p-Akt)多克隆抗体、兔抗人Akt多克隆抗体等(美国Sigma公司)等。BD FACSCalibur流式细胞仪(美国BD公司)等。
1.2方法
1.2.1牙髓干细胞培养 使用钳子,将拔除后的离体牙放入液氮中,牙科金刚砂车针将离体牙纵向切开,使用无菌器械镊子刮取牙髓组织,在DMEM培养基中将牙髓组织剪碎,用Ⅰ型胶原酶水浴消化1.5 h至组织块松散,离心(1 000 r/min)5 min,弃去上清液,加入FBS培养基吹打成混悬液,移入6孔板中培养,隔日进行半量换液,收集细胞的培养上清液离心(1 000 r/min)10 min,加入含FBS的DMEM培养基进行原代培养,培养至出现细胞克隆,挑选细胞克隆转移到96孔板中培养,达一定数量后依次转移到24孔板中、6孔板中、培养瓶中培养,细胞达85%融合后进行胰酶消化传代。
1.2.2牙髓干细胞鉴定 将生长良好的第三代牙髓干细胞用胰酶消化,用培养基重悬调整牙髓干细胞浓度为1×108L-1,接种到6孔板中培养,24 h弃去上清液,加入PBS洗涤,干燥后用多聚甲醛固定,PBS洗涤,按免疫组化染色试剂盒说明书检测牙髓干细胞中CD44和CD34的表达情况,阴性对照组不加一抗进行孵育,阳性对照组加入一抗进行孵育:用山羊血清封闭10 min,加入一抗过夜孵育,加入生物素标记的二抗孵育30 min,加入辣根酶标记链霉卵白素孵育30 min,DAB显色10 min,中性树胶封片。
1.2.3牙髓干细胞分组及处理 取第三代牙髓干细胞随机分为对照组、肾上腺髓质素组和肾上腺髓质素+抑制剂组。肾上腺髓质素组培养基中加入浓度为107mol/L的肾上腺髓质素;肾上腺髓质素+抑制剂组培养基中加入浓度为107mol/L的肾上腺髓质素[5]和15 μmol/L的LY294002[7];对照组培养基不加处理,培养48 h收集细胞。
1.2.4MTT测定牙髓干细胞增殖 将三组细胞调整细胞密度为3×104ml-1接种到96孔板中,每孔200 μl,分别在培养1 d、3 d、7 d加入10 μl MTT试剂孵育4 h,用分光光度计测定波长490 nm处吸光度(A)值。
1.2.5流式细胞术测定牙髓干细胞凋亡 将三组细胞用PBS液洗涤,加入缓冲液重悬细胞,调整牙髓干细胞浓度为1×106ml-1,在流式管中加入100 μl细胞悬液,加入5 μl Annexin V-FITC和5 μl PI室温孵育15 min,上机测定各组牙髓干细胞凋亡情况。
1.2.6Western blot测定牙髓干细胞中PCNA、Cleaved Caspase-3和PI3K、p-Akt、Akt蛋白水平 取上述三组牙髓干细胞,加入RIPA裂解液裂解牙髓干细胞30 min,离心(12 000 r/min)10 min,收集上清液,测定各组牙髓干细胞蛋白浓度,将各组牙髓干细胞蛋白样品和上样液(上样量30 μg)混合变性5 min,加入到制备好的SDS-PAGE凝胶上样孔中电泳,转膜1.5 h,脱脂奶粉封闭2 h,加入PCNA、Cleaved Caspase-3和PI3K、p-Akt、Akt一抗过夜孵育,加入辣根过氧化物标记的羊抗兔IgG孵育2 h,ECL显影,自动凝胶成像系统采集图像,以β-actin为内参,目标蛋白表达量以目标蛋白灰度值/β-actin蛋白灰度值表示。
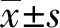
2 结果
2.1牙髓干细胞培养 培养72 h 细胞贴壁生长,有小细胞克隆形成,细胞多呈成纤维细胞样;7 d时有较多细胞从组织块周围游离出来。细胞增殖至1 000 个细胞左右时消化传代,传代培养细胞呈长梭形,有细胞突起。见图1。
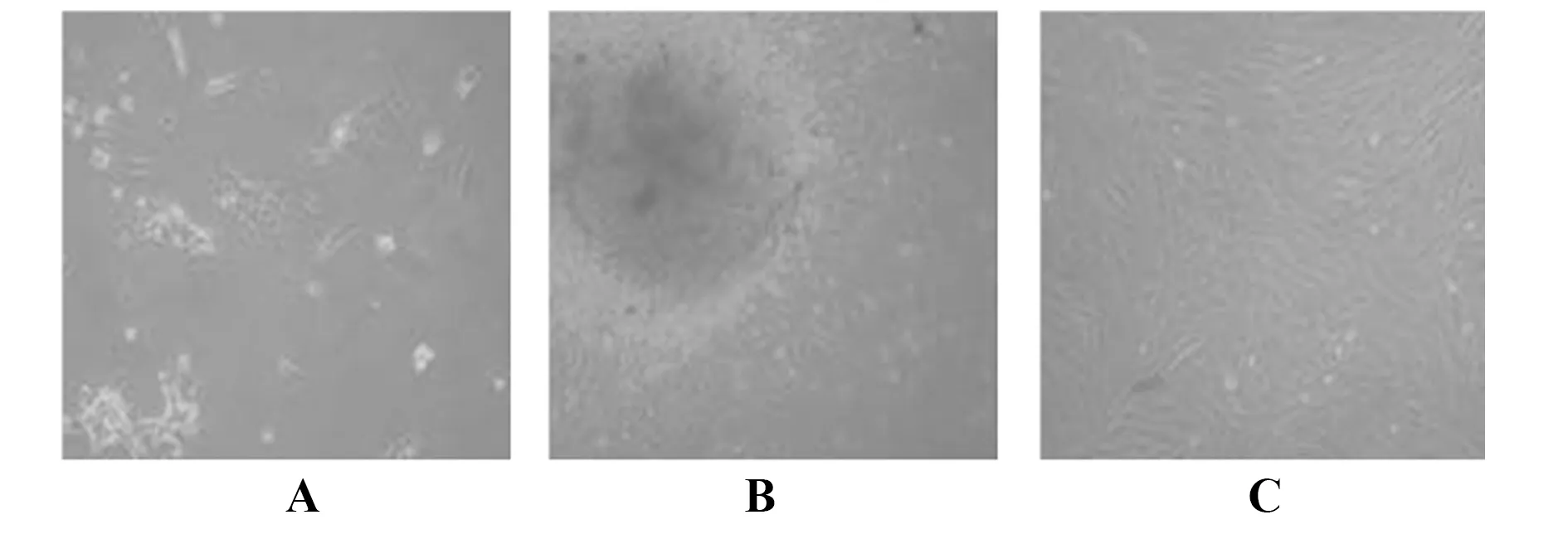
图1 牙髓干细胞培养形态特征Fig.1 Morphological characteristics of dental pulp stem cellsNote:A.Primary culture 24 h (×40);B.Primary culture 7 d (×40);C.Subculture 3rd generation (×100).
2.2牙髓干细胞鉴定 免疫组化结果显示牙髓干细胞阳性表达CD44,阴性表达CD34,表明培养细胞为牙髓干细胞。见图2。
图2 免疫组化染色鉴定牙髓干细胞CD44和CD34表达(×200)Fig.2 Immunohistochemical staining for expression of CD44 and CD34 in dental pulp stem cells (×200)Note:A,B.CD44 positive and negative control;C.The dental pulp stem cell marker CD44;D,E.CD33 positive control and the negative control;F.The dental pulp stem cell mark CD34.
2.3各组牙髓干细胞增殖情况比较 肾上腺髓质素+抑制剂组加入15 μmol/L的PI3K/Akt通路抑制剂LY294002,用分光光度计测定波长490 nm处的A值。培养1 d,对照组、肾上腺髓质素组和肾上腺髓质素+抑制剂组牙髓干细胞A值比较差异无统计学意义(P>0.05);培养3 d和7 d,各组牙髓干细胞A值比较差异有统计学意义(P<0.05),与对照组比较,肾上腺髓质素组和肾上腺髓质素+抑制剂组牙髓干细胞A值升高(P<0.05),与肾上腺髓质素组比较,肾上腺髓质素+抑制剂组牙髓干细胞A值降低(P<0.05)。见表1。
表1 各组牙髓干细胞A值比较
Tab.1 Comparison of A values of dental pulp stem cells in each group
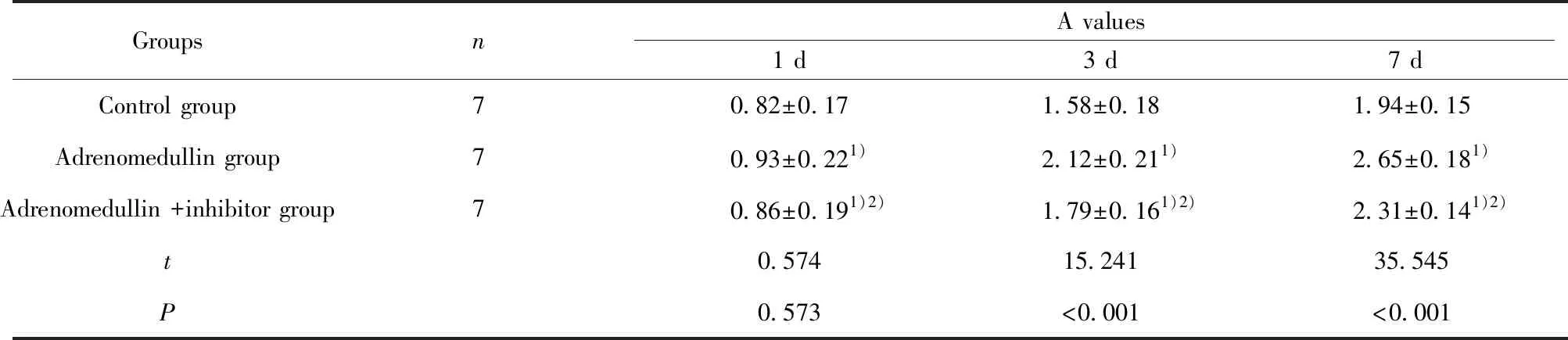
GroupsnA values1 d3 d7 dControl group70.82±0.171.58±0.181.94±0.15Adrenomedullin group70.93±0.221)2.12±0.211)2.65±0.181)Adrenomedullin +inhibitor group70.86±0.191)2)1.79±0.161)2)2.31±0.141)2)t0.57415.24135.545P0.573<0.001<0.001
Note:1)P<0.05 compared with control group;2)P<0.05 compared with adrenomedullin group.
2.4各组牙髓干细胞凋亡情况比较 各组牙髓干细胞凋亡率比较差异有统计学意义(P<0.05),与对照组比较,肾上腺髓质素组和肾上腺髓质素+抑制剂组牙髓干细胞凋亡率降低(P<0.05),与肾上腺髓质素组比较,肾上腺髓质素+抑制剂组牙髓干细胞凋亡率升高(P<0.05)。见表2和图3。
表2 各组牙髓干细胞凋亡率比较
Tab.2 Comparison of apoptotic rate of dental pulp stem cells in each group

GroupsnApoptotic rateControl group712.41±1.26Adrenomedullin group75.24±1.131)Adrenomedullin +inhibitor group77.62±1.571)2)t52.550P<0.001
Note:Compared with control group,1)P<0.05;compared with adrenomedullin group,2)P<0.05.

图3 流式细胞术测定各组牙髓干细胞凋亡Fig.3 Flow cytometry to determine apoptosis of dental pulp stem cells in each groupNote:PI.Propidium iodide;Annexin V FITC.Annexin V labeled with fluorescein isothiocyanate.A.Control group;B.Adrenomedullin group;C.Adrenomedullin+inhibitor group.
2.5各组细胞PCNA、Cleaved Caspase-3蛋白水平比较 PCNA可以反映细胞的增殖状态,Cleaved Caspase-3可反映细胞凋亡情况,选择PCNA、Cleaved Caspase-3了解细胞增殖和凋亡情况。各组牙髓干细胞PCNA、Cleaved Caspase-3蛋白水平比较差异有统计学意义(P<0.05),与对照组比较,肾上腺髓质素组和肾上腺髓质素+抑制剂组牙髓干细胞PCNA蛋白水平升高(P<0.05),Cleaved Caspase-3蛋白水平降低(P<0.05),与肾上腺髓质素组比较,肾上腺髓质素+抑制剂组牙髓干细胞PCNA蛋白水平降低(P<0.05),Cleaved Caspase-3蛋白水平升高(P<0.05)。见表3和图4。
表3 各组细胞PCNA、Cleaved Caspase-3蛋白水平比较
Tab.3 Comparison of PCNA and Cleaved Caspase-3 protein levels in each group
GroupsnPCNACleaved Caspase-3Control group70.09±0.020.28±0.06Adrenomedullin group70.33±0.051)0.12±0.031)Adrenomedullin +inhibitor group70.16±0.041)2)0.23±0.021)2)t71.08928.714P<0.001<0.001
Note:Compared with control group,1)P<0.05;compared with adrenomedullin group,2)P<0.05.
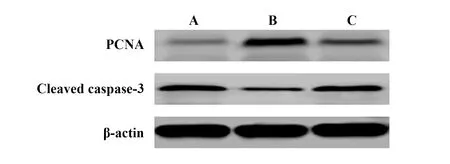
图4 Western blot测定各组细胞PCNA、Cleaved Caspase-3蛋白Fig.4 PCNA and Cleaved Caspase-3 proteins in each group by Western blotNote:A.Control group;B.Adrenomedullin group;C.Adrenomedullin +inhibitor group.
2.6各组细胞PI3K、p-Akt、Akt蛋白水平比较 各组牙髓干细胞PI3K、p-Akt蛋白水平比较差异有统计学意义(P<0.05),与对照组比较,肾上腺髓质素组牙髓干细胞PI3K、p-Akt蛋白水平升高(P<0.05),与肾上腺髓质素组比较,肾上腺髓质素+抑制剂组牙髓干细胞PI3K、p-Akt蛋白水平降低(P<0.05),各组牙髓干细胞Akt蛋白水平比较差异无统计学意义(P>0.05)。见表4和图5。
表4 各组细胞PI3K、p-Akt、Akt蛋白水平比较
Tab.4 Comparison of PI3K,p-Akt,Akt protein levels in each group
GroupsnPI3Kp-AktAktControl group70.78±0.120.51±0.160.39±0.11Adrenomedullin group70.95±0.141)0.91±0.191)0.38±0.121)Adrenomedullin +inhibitor group70.36±0.091)2)0.27±0.111)2)0.41±0.091)2)t46.00729.7450.142P<0.001<0.0010.869
Note:1)P<0.05 compared with control group;2)P<0.05 compared with adrenomedullin group.
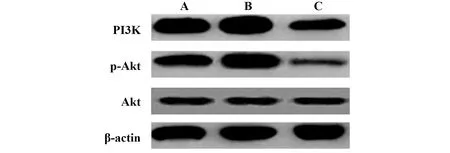
图5 Western blot测定各组细胞PI3K、p-Akt、Akt蛋白Fig.5 PI3K,p-Akt,Akt proteins in each group by Western blotNote:A.Control group;B.Adrenomedullin group;C.Adrenomedullin +inhibitor group.
3 讨论
龋病的发展是一系列反应,包括损伤、防御、修复三个方面,其中防御和修复在龋病的发展中具有重要作用,且具有明显的临床意义,因此成为龋病研究的重点。龋病的发展可侵犯牙髓组织,但临床上保护牙髓活性的成功率比较低,因此通过分子细胞生物技术保护牙髓活性成为新的研究方向[8]。当牙髓受到损伤时,其相对部位成牙本质细胞坏死,牙髓组织中的前体细胞分化成成牙本质细胞,形成成牙本质基质,形成修复性牙本质。牙髓组织中的牙髓干细胞具有多向分化和自我更新潜能,可分化为成牙本质细胞,具有形成牙本质基质的能力,因此牙髓干细胞在牙本质再生和修复中具有重要意义[9]。
肾上腺髓质素为一种多能性肽,具有诱导成骨、调节炎症、调节细胞迁移和凋亡等多种功能,在哺乳动物的发育中具有重要作用[10]。肾上腺髓质素可由牙本质细胞表达,在牙齿发育的关键时间点也有肾上腺髓质素表达,肾上腺髓质素的表达对牙本质细胞的形成和牙髓间充质干细胞有影响,肾上腺髓质素可具有促进骨形成的作用[11,12]。肾上腺髓质素也具有促进细胞增殖、抑制细胞凋亡的作用[13,14],如孙晶等[15]研究发现抑制肾上腺髓质素可抑制胃癌细胞增殖、促进胃癌细胞凋亡。本研究发现:肾上腺髓质素可升高牙髓干细胞增殖A值、降低牙髓干细胞凋亡率,升高牙髓干细胞PCNA蛋白水平,降低牙髓干细胞Cleaved Caspase-3蛋白水平。PCNA存在于肿瘤细胞和正常增殖细胞内,和细胞DNA合成有密切关系,参与细胞增殖的启动过程,可以反映细胞的增殖状态[16];Caspase-3为一种蛋白酶,是细胞凋亡中最重要的终末剪切酶,是细胞凋亡的关键蛋白,在细胞凋亡中发挥重要作用,正常组织中Caspase-3以无活性形成存在,在凋亡途径中最终可引起Caspase-3活化[17,18]。因此本研究结果表明肾上腺髓质素可促进牙髓干细胞增殖、抑制牙髓干细胞凋亡。
PI3K/Akt在多种细胞中广泛存在,属于络氨酸激酶受体介导信号通路,参与细胞生长、增殖和分化过程[19,20]。PI3K/Akt信号通路是经典的信号传导通路,在多种肿瘤细胞中PI3K/Akt信号通路处于激活状态,在PI3K/Akt信号通路中,Akt位于枢纽部分,PI3K可引起Akt磷酸化而发挥生物学功能[21-23],如张小三等[7]研究发现PI3K/Akt信号通路参与食管癌细胞的增殖和凋亡过程。本研究发现肾上腺髓质素可升高牙髓干细胞PI3K、p-Akt蛋白水平,给予PI3K/Akt信号通路抑制剂处理后,牙髓干细胞PI3K、p-Akt蛋白水平降低,且抑制肾上腺髓质素对牙髓干细胞增殖的促进作用和对牙髓干细胞凋亡的抑制作用。表明肾上腺髓质素可能通过激活PI3K/Akt通路促进牙髓干细胞增殖、抑制牙髓干细胞凋亡。
综上所述,肾上腺髓质素可促进牙髓干细胞增殖、抑制牙髓干细胞凋亡,其机制可能与其激活PI3K/Akt信号通路有关。
