组蛋白去乙酰化酶抑制剂联合索拉非尼对肝癌细胞增殖与凋亡的影响
2019-12-20郝大林孙成学肖福斌邓放
郝大林 孙成学 肖福斌 邓放
(北华大学附属医院 1感染肝病科,吉林 吉林 132011;2肝胆胰外科)
我国每年新发肝癌病例约占世界肝癌的45%,肝癌的发病率居世界首位〔1〕。手术治疗是目前肝癌的第一线治疗方案,但70%确诊为肝癌的患者由于肝癌的早期病变恶性程度高、发病隐匿、诊断率低而丧失了手术治疗的机会〔2〕。因此,研究肝癌的非手术治疗是当务之急。组蛋白去乙酰化酶(HDAC)抑制剂(I)亚甲酰胺异羟肟酸(SAHA)和索拉非尼(SRFN)是临床上常用的治疗肝癌的药物,主要用于治疗一些无法通过手术治疗的肝癌患者〔3,4〕。 虽然HDACI或SRFN可以单独用于治疗肝细胞癌(HCC),但最近的研究表明,联合应用SAHA和SRFN可以提高疗效,减少毒副作用,达到综合治疗HCC的效果〔5〕。然而,合理组合用药的基础是深入了解使用药物的机制。本实验拟研究SAHA、SRFN和SAHA联合SRFN对HepG2细胞生长、增殖、细胞周期及相关蛋白表达的影响,探讨SAHA与SRFN协同作用的可能机制。
1 材料与方法
1.1细胞培养与分组 HepG2 细胞株(购自中国科学院上海细胞生物研究所细胞库)放置于 37℃、二氧化碳浓度为5%的孵育箱中进行培养。培养基的组成成分为含10%灭活小牛血清的 RPMI1640 及含 1%的青霉素与链霉素双抗。细胞为上皮样细胞,传代频率为2~3 d/次,取对数生长期的细胞为研究样本。分为4组:对照组、SAHA(1.5 μmol/L SAHA处理)、SRFN(1.5 μmol/L SRFN处理)和SAHA联合SRFN(1.5 μmol/L SAHA和1.5 μmol/L SAHA处理)。
1.2噻唑蓝(MTT)法检测细胞生长 将HepG2细胞以5×104个细胞/孔接种到96孔板上,分别用0.1、0.5、1.0、1.5及2.5 μmol/L不同浓度的SAHA或SRFN处理HepG2细胞24、48、72 h,以0 μmol/L的SAHA或SRFN处理细胞24、48或72 h为对照组。MTT试剂盒经标准化处理后,在570 nm处测量每个孔的光密度(OD)。每组设4个孔,重复3次。平均OD值作为最终OD值。SAHA或SRFN对HepG2细胞增殖的抑制率=(OD对照-OD处理)/OD对照×100%。
1.3流式细胞术检测各组细胞周期及凋亡 将各组处理72 h后细胞用胰蛋白酶〔不含乙二胺四乙酸(EDTA)〕消化,磷酸盐缓冲液(PBS)洗涤细胞2次(2 000 r/min离心5 min),收集(1~5)×105细胞,加入500 μl的结合缓冲液悬浮细胞,加入5 μl的Annexin V-异硫氰酸荧光素(FITC)混匀,再加入5 μl碘化丙啶混匀,室温下避光反应15 min。流式细胞仪检测,激发波长Ex=488 nm,发射波长Em=530 nm。采用FCSExpress3.0软件进行分析处理,计算细胞凋亡率及细胞周期情况。
1.4Western印迹检测不同处理组细胞中蛋白水平的表达 用SAHA、SRFN或SAHA联合SRFN处理后,以细胞总蛋白提取试剂盒提取HepG2细胞的总蛋白。用二喹啉甲酸(BCA)蛋白测定试剂盒测定蛋白质浓度。用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离总蛋白(100 μg)转移至聚偏氟乙烯(PVDF)膜,依次经过封闭、一抗孵育、洗膜、辣根过氧化物酶耦联的二抗孵育、洗膜,最后采用化学发光显色试剂显影并摄像,并进行分析。
1.5统计学处理 采用SPSS19.0软件进行t检验。
2 结 果
2.1SAHA、SRFN或SAHA联合SRFN对HepG2细胞增殖的影响 SAHA或SRFN以浓度/时间依赖性抑制HepG2细胞增殖,见图1。同时SAHA联合SRFN增强抗增殖作用,见表1。
2.2SAHA、SRFN和SAHA联合SRFN对HepG2细胞周期和凋亡的影响 SAHA或SRFN诱导HepG2细胞的G0/G1期阻滞。与对照组相比,SAHA组和SRFN组细胞周期G0/G1期分别增加87.16或68.81%。SAHA联合SRFN组细胞周期G0/G1期比SAHA组增加11.76%,比SRFN组增加23.91%,见表2。SAHA或SRFN组HepG2细胞凋亡率(19.21%±2.96%、12.86%±3.12%)明显高于对照组(4.64%±0.35%,P<0.05),但显著低于SAHA联合SRFN组(31.22%±3.65%,P<0.05)。
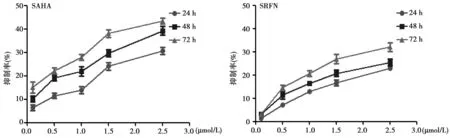
图1 不同浓度处理后不同时间点SAHA和SRFN对HepG2细胞增殖的抑制作用
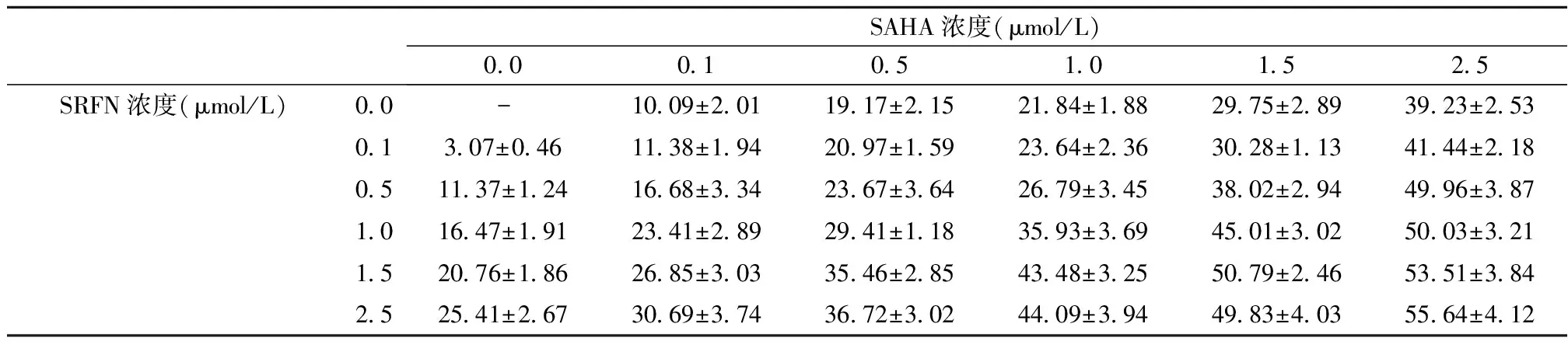
SAHA浓度(μmol/L)0.00.10.51.01.52.5SRFN浓度(μmol/L)0.0-10.09±2.0119.17±2.1521.84±1.8829.75±2.8939.23±2.530.13.07±0.4611.38±1.9420.97±1.5923.64±2.3630.28±1.1341.44±2.180.511.37±1.2416.68±3.3423.67±3.6426.79±3.4538.02±2.9449.96±3.871.016.47±1.9123.41±2.8929.41±1.1835.93±3.6945.01±3.0250.03±3.211.520.76±1.8626.85±3.0335.46±2.8543.48±3.2550.79±2.4653.51±3.842.525.41±2.6730.69±3.7436.72±3.0244.09±3.9449.83±4.0355.64±4.12
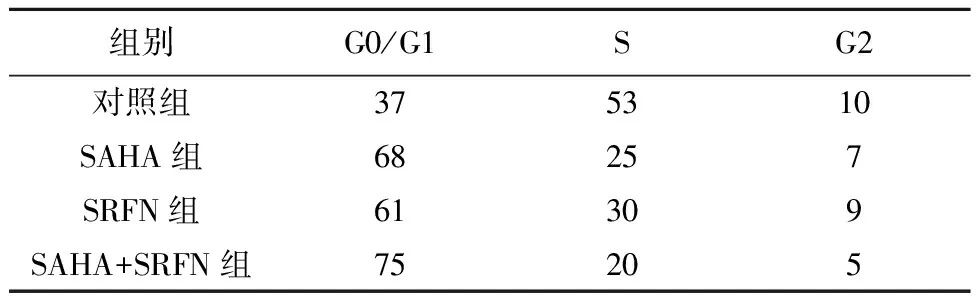
表2 SAHA、SRFN或SAHA联合SRFN对HepG2细胞周期的抑制率(%,n=6)
2.3SAHA、SRFN或SAHA联合SRFN对HepG2细胞相关蛋白表达的影响 与对照组相比,SAHA或SRFN显著上调P21表达(P<0.05)。SAHA联合SRFN组p21蛋白表达显著高于SAHA或SRFN组(P<0.05)。SAHA或SRFN显著下调CyclinD1、Bcl-2表达(P<0.05),而对Bax蛋白表达无明显影响。SAHA联合SRFN组CyclinD1、Bcl-2表达显著低于SAHA或SRFN组(P<0.05),见图3和表3。
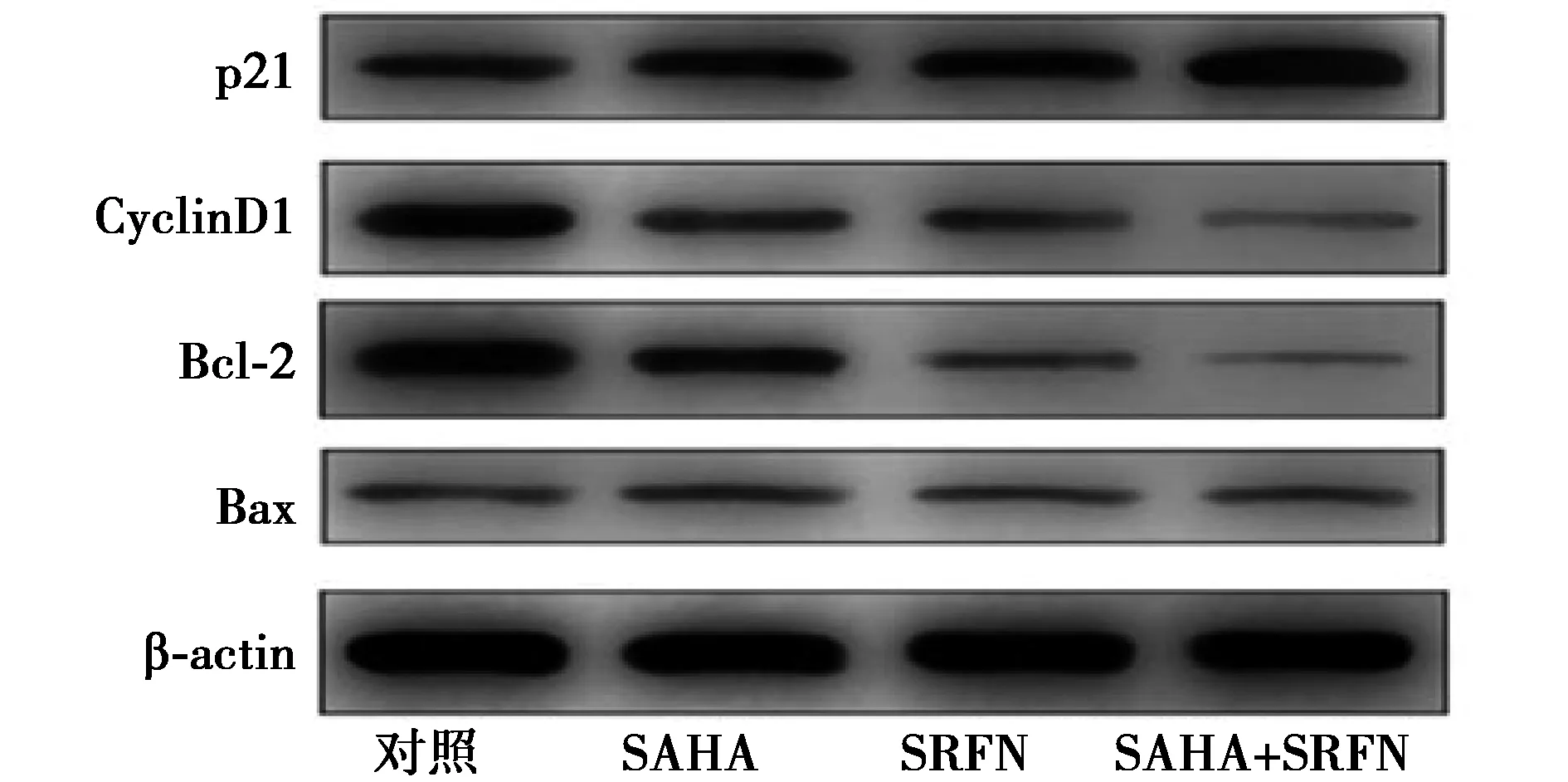
图3 SAHA、SRFN或SAHA联合SRFN组增殖、凋亡相关蛋白表达
表3 SAHA、SRFN或SAHA联合SRFN组中增殖、凋亡相关蛋白表达的比较
与对照组比较:1)P<0.05;与SAHA+SRFN组比较:2)P<0.05
3 讨 论
HDACI是基于表观遗传学理论发展起来的一种新型抗肿瘤药物,具有疗效好、无明显毒副作用的特点〔6〕。HDACI通过抑制HDAC活性、调节组蛋白乙酰化状态、促进抗肿瘤转录因子的转录和表达、调节相关信号通路发挥抗肿瘤生物学效应〔7〕。SAHA是第二代酮类羟基酸HDACI,在微分子水平下具有很高的抗肿瘤生物学效应,通过调节基因,提高肿瘤细胞对其他化疗的敏感性,从而达到治疗癌症的目的〔5〕。肿瘤细胞的增殖、分化受DNA的调控,尽管SAHA和SRFN的作用靶点不同,但两者联合使用可能具有协同抗肿瘤作用。
Cha等〔8〕研究不同抗肿瘤药物的作用靶点不同,但均通过诱导肿瘤细胞凋亡和改变肿瘤组织内环境而显示出抗肿瘤活性。细胞周期阻滞与细胞凋亡间有重要联系。细胞分化相关基因p21通过诱导细胞G1/G0期阻滞而抑制细胞增殖和分化。如果药物能够上调肿瘤细胞中p21表达,就会使细胞G1/G0期比例增加,肿瘤细胞增殖就会受到抑制,从而发挥抗肿瘤作用。CyclinD1是重要的推动细胞G1/S期相关基因,在许多肿瘤细胞中均有高表达,抑制其高表达可诱导细胞G1/S期阻滞〔9〕。Bcl-2可通过调节多种因素抑制细胞凋亡。因此,SAHA联合SRFN通过诱导p21上调和cyclinD1下调,发挥细胞阻滞的作用,进而诱导HepG2细胞凋亡,而Bcl-2下调可促进HepG2细胞凋亡。
SAHA或SRFN通过上调p21蛋白的表达,下调Cyclin D1、Bcl-2蛋白的表达,抑制HepG2细胞增殖,促进细胞凋亡。同时,SAHA和SRFN之间存在协同和叠加效应。
