苦酸通调方对HepG2细胞胰岛素抵抗模型中脂代谢及AMPK、ACC、SREBP-1蛋白的影响
2019-12-20米佳闫冠池朱浩宇王国强王秀阁李香艳
米佳 闫冠池 朱浩宇 王国强 王秀阁 李香艳
(1长春中医药大学附属医院,吉林 长春 130021;2长春中医药大学)
胰岛素抵抗(IR)是糖耐量异常及2型糖尿病(T2DM)的重要发病机制,且贯穿于糖尿病(DM)的整个病程,因此改善IR是治疗T2DM及减轻靶器官损害的重要策略〔1〕。据“国际糖尿病联盟(IDF)糖尿病地图”中流调显示,中国DM患病人数达到1.144亿,居全球首位〔2〕。肝脏是能量代谢的主要场所,同时是胰岛素作用的重要效应器官,糖酵解、糖异生及脂质合成等过程是通过摄取葡萄糖及游离脂肪酸(FFA)而达到的,进而维持能量稳态。当肝脏储能作用失衡,肝糖输出增加,促使高胰岛素血症进一步加重,进而形成T2DM。AMP活化蛋白激酶(AMPK)是细胞内的能量感受器,通过丝氨酸/苏氨酸残基的磷酸化控制细胞的葡萄糖和脂质代谢。AMPK的激活影响脂质代谢中多个酶的表达及活性水平,并能影响转录因子表达,例如通过增强脂肪酸氧化,抑制脂质合成和抑制糖异生,是降低肝脏中脂质积累水平的重要步骤。
前期研究证实,苦酸通调方在临床应用和动物实验中具有改善糖代谢作用,其可通过改善胰岛素受体底物-1/磷脂酰肌醇3-激酶/蛋白激酶B(IRS-1/PI3K/Akt)信号通路传导,增加葡萄糖消耗,减少肝糖原合成,从而增强肝脏糖异生〔3,4〕。其中主要药物黄连、丹参、大黄等具有增强胰岛素敏感性、减轻炎症反应等作用,可用于T2DM的治疗〔5~7〕。还有研究显示大黄黄连合剂能够改善T2DM大鼠模型的糖代谢情况〔8〕。本实验旨在已有的前期研究基础上,进一步探讨苦酸通调方对棕榈酸联合高糖诱导HepG2胰岛素抵抗细胞胰岛素抵抗状态、脂质代谢及AMPK/ACC/SREBP-1的影响。
1 材料与方法
1.1材料
1.1.1细胞株 HepG2细胞人肝癌细胞株,购于中国科学院细胞库。
1.1.2药物及试剂 苦酸通调方(长春中医药大学附属医院药房提供);二甲双胍(HY-17471A,MCE公司);DMEM低糖培养基、胎牛血清(12100061、16140071,Gibco公司);细胞裂解液、噻唑蓝(MTT)细胞增殖及细胞毒性检测试剂盒(P0013、C0201,武汉碧云天生物公司);棕榈酸(MB7088,大连美仑生物技术有限公司);油红O染色试剂盒、三酰甘油(TG)检测试剂盒、胆固醇检测试剂盒(D027、A110、A111,南京建成生物工程研究所);兔抗人单克隆抗体AMPKα,单克隆抗体p-AMPK(Thr172),单克隆抗体乙酰辅酶A羟化酶(ACC),多克隆抗体p-ACC(Ser79)(美国Cell Signaling公司,批号分别为5832,50081,9272,9336);兔单克隆抗体SREBP-1(557036,美国BD公司);辣根过氧化物酶标记山羊抗兔多克隆抗体免疫球蛋白(Ig)G、辣根过氧化物酶标记山羊抗小鼠单克隆抗体IgG(BA1054、BA1050,武汉博士德生物工程有限公司);二喹啉甲酸(BCA)蛋白浓度测定试剂盒(A0216,碧云天生物技术研究所)。
1.1.3仪器 湿化型CO2恒温培养箱(3111,Thermo);YZ-875超净工作台(江苏苏州净化设备厂);低温高速离心机(5804R,德国Eppendorf);DK-S2微型振荡器(浙江金华实验仪器厂);鼓风干燥箱(上海博迅医疗生物仪器公司);M200 PRO酶标仪(瑞士Tecan公司);电泳仪(美国Bio-Rad公司);湿转系统(美国Bio-Rad公司);超低温冰箱(900,美国Thermo Fisher);ECL发光仪(美国Protein Simple公司)。
1.2细胞培养 HepG2细胞培养在37℃,5%CO2湿化条件中,给予10%胎牛血清(FBS)、青霉素100 U/ml和链霉素100 μg/ml的低糖DMEM培养基培养,待细胞融合度约80%时进行传代。各干预组加入无血清低糖DMEM培养基培养细胞24 h,使各组细胞生长同步化后再进行下一步实验。
1.3MTT比色法检测细胞活力 将MTT溶于磷酸盐缓冲液(PBS)为5 mg/ml过滤除菌后备用,选择细胞融合度约80%的HepG2细胞,胰酶消化后,以8 000个细胞/孔的密度接种于96孔板。细胞贴壁生长24 h,吸弃原培养基,加入不同的干预液100 μl,培养24 h,每孔加入MTT溶液10 μl,置细胞于培养箱内避光孵育4 h。震荡混匀,490 nm处测定吸光度。以对照组细胞的存活率为100%计算不同组别细胞存活率。
1.4高糖联合棕榈酸孵育建立HepG2 IR模型 称取9.165 mg棕榈酸标准品溶于0.25 ml无水乙醇中,将溶解后的棕榈酸加入11.88 ml高糖DMEM培养〔其中含有0.12 ml FBS,0.25 g牛血清白蛋白(BSA)〕,55℃水浴15 min,冷却后过滤除菌即为3 mmol/L棕榈酸溶液,造模时稀释至0.25 mmol/L,孵育细胞24 h,建立HepG2 IR模型。
1.5分组及处理 正常组加入正常培养液,模型组及苦酸通调方低、中、高剂量组均加入造模液,孵育24 h,建立IR模型。吸弃培养液,正常组、模型组加入无血清DMEM培养液,苦酸通调方组加入药物溶液(50、100、200 μg/ml),37℃、5%CO2培养箱内孵育24 h。
1.6细胞葡萄糖摄取量的检测 分组干预处理后,吸弃培养液,PBS洗涤2次,每孔加入2 ml无糖DMEM培养液饥饿4 h,胰酶消化,收集细胞,加入含或不含100 nmol/L胰岛素的2-NBDG处理,细胞培养箱内避光孵育30 min,吸弃上清,预冷PBS洗涤,1 000 r/min离心5 min,流式细胞仪检测。
1.7三酰甘油含量检测 HepG2培养于含10%FBS DMEM低糖培养液,以30 000个细胞/孔的密度接种于6孔板中,培养24 h后,将造模液作用于HepG2细胞24 h,苦酸通调方组孵育24 h,吸取上清,10 000 r/min,离心5 min,检测上清中三酰甘油含量;收集细胞,1 000 r/min,离心5 min,留细胞沉淀;用PBS清洗3次,同1 000 r/min,离心5 min,弃上清液,留细胞沉淀。加入0.2 ml的PBS充分混匀,低温条件下超声(功率:200 W,超声4 s,间隔2秒,重复5次),制备好的匀浆液测定蛋白浓度及三酰甘油含量。
1.8油红O染色 细胞给予不同处理24 h后,吸弃原培养基,PBS洗涤。4%多聚甲醛固定。油红O染液染色15 min,复染液染色5 s,水洗30 s,重复3次。
1.9Western印迹检测AMPK,p-AMPK,ACC,p-ACC,SREBP-1蛋白水平 吸弃各处理组上清,预冷PBS冲洗2次,每孔加入预冷RIPA细胞裂解液,冰上裂解,刮取细胞,4℃下10 000 r/min离心10 min。BCA法测定细胞蛋白浓度。制备十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离胶(10%)和浓缩胶(5%)。上样总蛋白40 μg,加入电泳缓冲液,电泳电压及时间(浓缩胶为80 V,30 min;分离胶为100 V,1 h)。再将蛋白转移至聚偏氟乙烯(PVDF)膜上(110 V,90 min)。5%BSA封闭1 h,加入相应一抗(1∶1 000),4℃摇床孵育过夜。TBST洗膜3次,辣根过氧化物酶标记的山羊抗兔或山羊抗小鼠第二抗体(1∶5 000),室温孵育1 h。洗膜5次后,电化学发光(ECL)显色,拍照。
1.10统计学处理 采用SPSS22.0软件进行单因素方差分析及t检验。
2 结 果
2.1对HepG2细胞葡萄糖摄取量的影响 与正常组〔(1.00±0.02)mmol/L〕比较,模型组细胞的葡萄糖摄取量明显下降〔(0.63±0.02)mmol/L,P<0.05〕;与模型组相比,苦酸通调方高剂量组、阳性对照组显著增多HepG2 IR细胞葡萄糖摄取量〔(0.84±0.05)mmol/L,(0.93±0.02)mmol/L,P<0.05〕,且增加细胞葡萄糖摄取量的效果呈剂量依赖性。苦酸通调方低、中剂量组摄取量为〔(0.66±0.03)mmol/L,(0.72±0.03)mmol/L〕与模型组无差异(P>0.05)。
2.2油红O染色 造模液作用后细胞内脂滴明显增多,随着苦酸通调方浓度的增加,细胞脂滴逐渐减少。见图1。
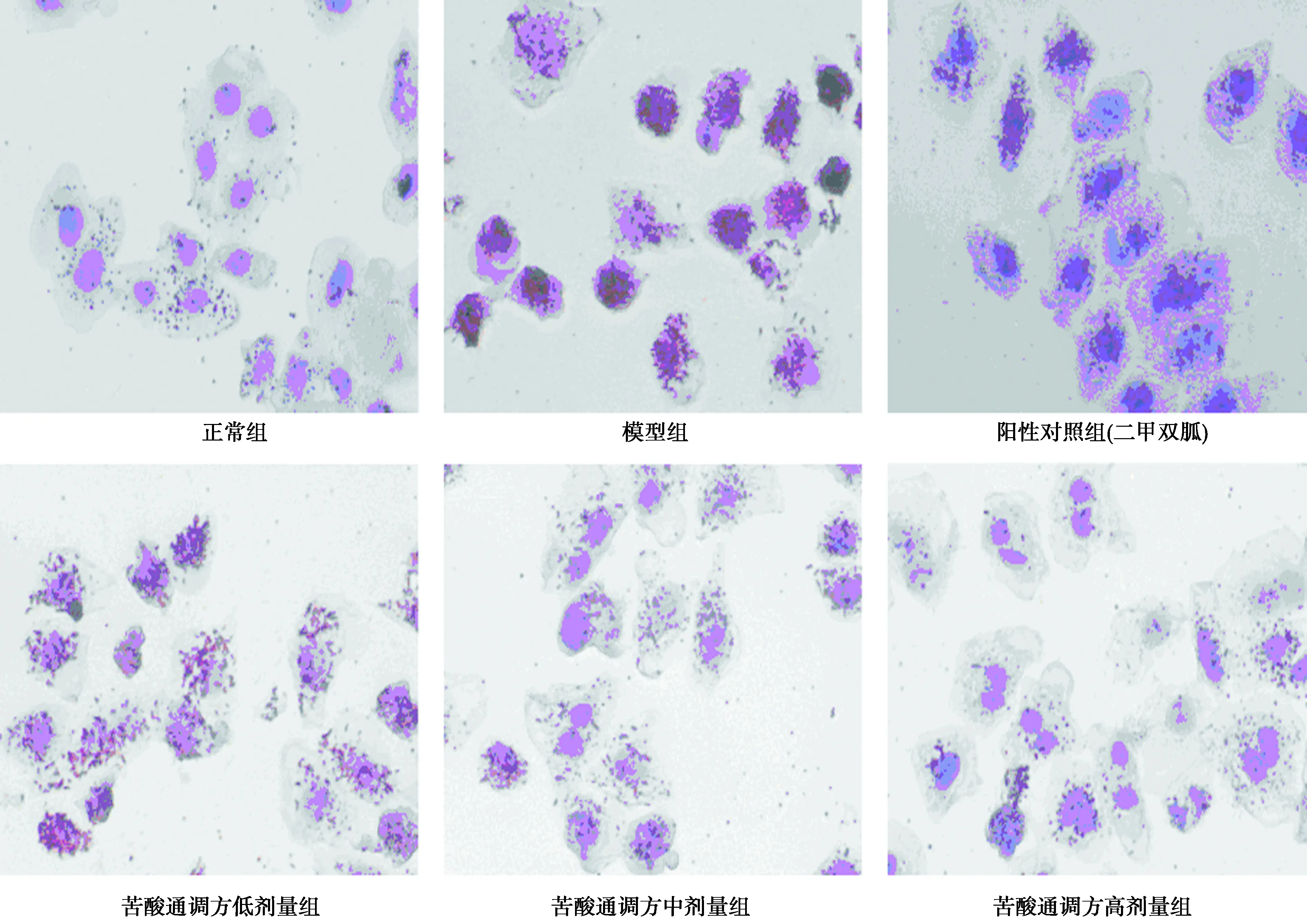
图1 苦酸通调方对HepG2 IR脂类物质积累情况的影响(油红O染色,×40)
2.3对HepG2 IR细胞内TG含量的影响 与正常组细胞中TG的含量〔(0.07±0.02)mg/g〕相比,模型组细胞中的含量均明显增加〔(0.27±0.05)mg/g,P<0.05〕;与模型组相比,苦酸通调方各剂量组的细胞中TG的含量均有所降低,且降低效果呈剂量依赖性〔低剂量组(0.23±0.07)mg/g、中剂量组(0.21±0.03)mg/g、高剂量组(0.20±0.02)mg/g〕。其中中、高剂量组、阳性对照组(二甲双胍)〔(0.210±0.02)mg/g〕TG含量较模型组明显降低(P<0.05)。
2.4HepG2细胞AMPK,p-AMPK,ACC,p-ACC,SREBP-1的蛋白表达的影响 与正常组比较,模型组p-AMPKα,p-ACC水平显著降低,SREBP-1、ACC表达显著增加(P<0.05),与模型组比较,阳性对照组、苦酸通调方中、高剂量组p-AMPKα明显增加,苦酸通调方高剂量组、阳性对照组p-ACC水平表达明显增加,阳性对照组、苦酸通调方各剂量组SREBP-1表达显著降低,阳性对照组、苦酸通调方中、高剂量组ACC表达显著降低(均P<0.05)。见图2,表1。
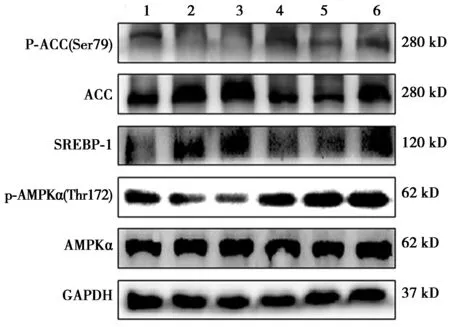
1~6:正常组、模型组、苦酸通调方低剂量组、苦酸通调方中剂量组、苦酸通调方高剂量组、阳性对照组图2 各组HepG2 IR细胞中AMPK,p-AMPK,ACC,p-ACC,SREBP-1蛋白表达
表1 苦酸通调方对HepG2细胞中p-AMPK,ACC,p-ACC,SREBP-1蛋白表达
与正常组比较:1)P<0.05;与模型组比较:2)P<0.05
3 讨 论
中医认为T2DM属“消渴”“脾瘅”范畴,苦酸通调方依据六郁和络滞病机,确立“苦酸制甜”、“辛开苦降”、“活血通络”、“解毒通络”为基本治法,选用丹参、黄连、黄芪、知母、天花粉、制红曲、肉桂、乌梅、生地、酒大黄组成本方。诸药辛苦酸并用,寒温相佐,达到了苦酸制甜,辛开苦降,通达络脉之功。
脂代谢紊乱是胰岛素抵抗发生的始动因素。TG是人体主要供能脂类之一,肝脏及脂肪在胰岛素的刺激下可进行TG的合成。TG合成增加、异常累积为肝细胞胰岛素抵抗的重要病理改变之一。FFA增加使TG在脂肪、肌肉和肝脏中过度累积,超过各组织的储存及代谢能力,最终引起IR。肝脏是脂肪酸代谢的主要场所,通过进行糖异生、脂肪酸合成及分解等过程调节脂代谢。肝细胞摄取FFA主要通过两种途径进行代谢,一是合成胆固醇、TG和磷脂等,二是进入线粒体进行氧化供能。肝脏脂质合成增加是IR脂质代谢紊乱的关键环节〔9〕。AMPK是细胞能量感受器,调节细胞脂代谢及胰岛素信号传递,活化的AMPK抑制脂质合成进程的相关基因,如:SREBP-1。SREBP1是调节TG合成的重要转录因子,调节大多数涉及脂质合成过程中的必要基因的表达,肝脏中的SREBP-1表达增加,转录活性升高,上调脂质合成相关基因(如ACC)的表达〔10〕。同时SREBP-1c介导胰岛素对脂肪生成基因的诱导,在葡萄糖刺激下,SREBP-1c和ChREBP协同诱导糖酵解和脂肪合成mRNA表达〔11〕。此外SREBP-1负调控肝细胞内IRS-1/PI3K/Akt途径为主的胰岛素信号传导通路,减少肝糖原合成。同时增加葡萄糖转化为脂质,促进IR的形成。因此,抑制肝脏SREBP-1的表达不仅可以减少脂质的合成,同时能够改善IRS-1/PI3K/Akt的信号传导,有效的抑制肝脏IR〔12,13〕。ACC是脂肪酸合成的第一个限速酶,包含ACC1和ACC2亚型,ACC1可催化脂肪酸合成,ACC2能够抑制脂肪酸的氧化分解。激活AMPK可促进ACC1磷酸化,从而抑制ACC的活性及脂质合成,增加脂肪酸氧化〔14〕。前期预实验提示苦酸通调方50、100、200 μg/ml的浓度对IR HepG2细胞的细胞活性无明显抑制作用。在本研究中,苦酸通调方作用HepG2 IR细胞后,糖摄取能力明显增加,AMPK,ACC磷酸水平增加,SREBP-1,ACC蛋白表达减少。据此,提出假说,苦酸通调方调节胰岛素抵抗模型HepG2细胞脂质代谢可能是通过调节AMPK、ACC、SREBP-1通路实现的。
