谷氧还蛋白(AbGrx-1)对水稻干尖线虫在氧化胁迫下的保护作用
2019-11-18冯辉范亚磊张金凤朱红利魏利辉
冯辉 范亚磊 张金凤 朱红利 魏利辉, , *
谷氧还蛋白(AbGrx-1)对水稻干尖线虫在氧化胁迫下的保护作用
冯辉2范亚磊2张金凤2朱红利1魏利辉1, 2, *
(1南京农业大学 植物保护学院,南京 210095;2江苏省农业科学院 植物保护研究所,南京 210014;*通讯联系人,E-mail:weilihui@jaas.ac.cn)
谷氧还蛋白(glutaredoxin, Grx)作为一种抗氧化酶,在通过清除多余活性氧来维持生物细胞氧化还原平衡、降低细胞膜损伤过程中发挥重要作用。水稻干尖线虫()能在高温、渗透及氧化胁迫等多种逆境压力中存活。本研究旨在探究Grx在水稻干尖线虫抗氧化胁迫中的作用。通过cDNA末端快速扩增技术(rapid amplification of cDNA ends, RACE),获得了一个水稻干尖线虫谷氧还蛋白基因,进行了序列比对和遗传进化分析;通过qRT-PCR检测了在线虫响应氧化和温度胁迫中的表达差异,通过原核表达获得了AbGrx-1的重组蛋白,并分析了AbGrx-1蛋白浸泡对水稻干尖线虫在氧化和高温胁迫下存活的影响。基因全长包括90 bp的5'非翻译区(UTR)、321 bp的编码区和97 bp的3'UTR,开发阅读框(横跨91至411位)编码106个氨基酸。AbGrx-1蛋白的第24至27位点具有谷氧还蛋白催化残基(CPYC),分别在第69至第72和第83至第86位点存在保守的谷胱甘肽结合位点RSVP和GGDD,归为Ⅰ类谷氧还蛋白。遗传进化树显示AbGrx-1与燕麦真滑刃线虫()Grx亲缘关系最近,位于同一进化分支。在H2O2处理和12℃下时显著上调表达,但在0℃, 4℃, 37℃和45℃极端温度中下调表达。高浓度H2O2和高温导致水稻干尖线虫死亡率增加,AbGrx-1重组蛋白能显著提高暴露于高浓度H2O2中线虫的存活率,但不影响高温下线虫的存活率。AbGrx-1参与调控水稻干尖线虫的抗氧化免疫反应,在抵抗氧化损伤、维持线虫生存方面具有重要功能。
水稻干尖线虫;谷氧还蛋白;基因克隆;重组蛋白;抗氧化
活性氧(ROS)是生物体在呼吸、代谢时因氧分子的不完全还原而产生的,在需氧生物发育过程中十分重要。除此之外,生物体还会受到外界氧化胁迫压力导致细胞内ROS水平升高。ROS的过度积累会损伤生物大分子DNA、蛋白质和脂类[1]。为了避免氧化损伤,生物体利用酶和非酶抗氧化系统调节自身氧化平衡。谷氧还蛋白(Grx)是维持胞间氧化平衡的关键酶,利用谷胱甘肽的还原能力维持和调控细胞氧化还原状态和氧化还原信号途径,在胞内ROS清除、蛋白和脂类氧化损伤修复等抗氧化过程中发挥重要功能[2, 3]。
Grx是热稳定和小分子量(10~16 kD)蛋白,具有3个活性结构域,即二硫键活性中心、GSH结合位点和一个疏水性表面区域。Grx 活性中心的氨基酸序列为-Cys-Pro-Tyr-Cys-,其中,半胱氨酸(Cys)为催化基团。根据序列特点,Grx可分为六类(Ⅰ-Ⅵ),其中,二硫基(Ⅰ类)和单硫基(Ⅰ或Ⅱ类)在所有生物中均存在,Ⅲ类在高等植物中存在,Ⅳ类在光合作用的真核生物中存在,Ⅴ类存在于蓝藻细菌和变形菌中,Ⅵ类存在于蓝藻细菌中[1]。
目前仅有少数几个种类线虫的基因被克隆和研究,这些在维持线虫细胞活性氧稳态、降低细胞膜损伤发挥重要作用。模式生物秀丽隐杆线虫()谷氧还蛋白GLRX-21能阻止硒诱导的氧化胁迫对线虫的损害[4]。动物寄生线虫克氏锥虫()谷氧还蛋白TcGrx参与二硫谷胱甘肽还原反应以及靶标蛋白的去谷胱甘肽化[5]。草莓芽线虫()的谷氧还蛋白AF-GLX-1受脱水干燥和渗透压胁迫诱导表达,并参与调控线虫在逆境下越冬和存活[6]。
水稻干尖线虫()是水稻上的迁移性寄生线虫,在进入水稻颖花后迅速繁殖,在25℃最适温度下10 d就可繁殖一代,并伴随着水稻的成熟逐渐进入低湿休眠状态[7]。基于这种特性,水稻干尖线虫具有忍受脱水干燥的能力,在干燥种子中能进入休眠状态,两三年内仍保持很强的活力。水稻干尖线虫还有抵抗温度逆境的能力。Tenent等[8]发现水稻干尖线虫在贮存于−18℃的稻种中可存活30个月;同时,由于水稻干尖线虫侵染水稻地上组织,在水稻生长季节的大田环境中,常常暴露于高温环境中,因此水稻干尖线虫也具有极强的耐高温能力。此外,之前的一些研究利用氧化剂(H2O2)对水稻干尖线虫进行表面消毒而不影响线虫的运动和侵染,暗示水稻干尖线虫具有强大的抵抗氧化胁迫能力。目前参与水稻干尖线虫的抗逆反应多个基因被克隆,包括钙网膜蛋白[9]、热激蛋白HSP90[10]、海藻糖酶[11]和胚胎发育晚期丰富蛋白基因等[12]。这些基因在水稻干尖线虫应对温度胁迫、渗透胁迫、氧化胁迫以及取食等过程中发挥作用,但有关Grx的功能仍未见报道。
本研究克隆了一个水稻干尖线虫抗谷氧还蛋白基因,并对其在线虫响应氧化和温度胁迫过程中的表达情况进行了监测,同时对进行了原核表达,分析了AbGrx-1重组蛋白对氧化胁迫和高温胁迫下线虫存活的影响,以期阐明水稻干尖线虫的逆境适应机理,为防治提供依据。
1 材料与方法
1.1 线虫准备
线虫最初分离自水稻病穗,后在长满灰葡萄孢菌 ()的平板上培养扩繁。将在平板上培养20 d左右的线虫用无菌水洗涤下来,用35%蔗糖溶液进行收集纯化,并用消毒液(含100 μg/mL 两性霉素B、100 μg/mL 硫酸链霉素和100 μg/mL氨苄青霉素)洗涤虫体3次,最后用ddH2O洗涤保存备用。
1.2 RNA提取和cDNA合成
收集50 μL 活性良好的线虫在液氮中速冻30s,然后用一次性研磨棒迅速研磨成匀浆,采用TRIzol试剂(Invitrogen,美国)进行RNA提取。RNA质量和产量通过1.2%琼脂糖凝胶电泳和Nanodrop 2000分光光度计(OD260/280)进行评估。
cDNA合成按照反转录试剂盒(HiscriptII 1stStrand cDNA Synthesis Kit, 南京)说明书进行:将含有1 μL RNA(1 μg/μL),1 μL Oligo dT23引物(10 μmol/L)和6μL ddH2O的无核酸酶的PCR管,于65℃下孵育5 min,立即冰上放置2 min,然后向PCR管中加入10 μL 2×RT Mix和2 μL 反转录酶(HiscriptII Enzyme),混匀后50℃下孵育45 min,最后在85℃下孵育5min。
1.3 基因克隆
根据NCBI数据库中登录的多种线虫保守序列信息,应用CODEHOP程序(http://blocks.fhcrc.org /codehop.html)设计简并引物degGrx-F/R,并进行PCR扩增[13]。根据获得的部分序列信息应用Primer 3软件(http://primer3.ut.ee/)设计特异引物。
3'和5'端序列根据cDNA末端快速扩增试剂盒(SMART™ RACE cDNA Amplification Kit,Clontech, 美国)进行扩增。对于3'端,25 μL反应体系如下:2.5 μL 10×PCR缓冲液,2 μL MgCl2(25 mmol/L),2 μL dNTP (10 mmol/L),引物AbGrx-F1和UPM (10 μmol/L)各2 μL,0.25 μg cDNA 模板和1个单位的Ex聚合酶(TaKaRa,大连)。PCR条件如下:95℃下预变性5 min;95℃下变性30 s,62℃下退火30 s,72℃下延伸2.5 min,38个循环;最后72℃下延伸10 min。5'端采用巢式PCR进行扩增。第一轮采用引物AbGrx-R1和UPM进行降落PCR,体系和条件参照试剂盒说明。第二轮采用引物AbGrx-R2和NUP,反应模板为稀释50倍的第一轮PCR产物,反应条件同3'端RACE。完整序列采用包含开放阅读框的引物AbGrx-fullF和AbGrx-fullR进行扩增,除退火温度变为55℃,其余反应条件同前。所用引物见表1。

表1 本研究引物列表
下划线为限制性内切酶I/I的酶切位点。
The underlined refer to the digestion site byl/l.
1.4 序列和遗传分析
水稻干尖线虫谷氧还蛋白(AbGrx-1)氨基酸序列、等电点pI及分子量通过Lasergene 7.1进行预测。AbGrx-1基序特征通过保守域数据库(conserved domain database,https://www.ncbi.nlm.nih.gov/cdd)进行分析。蛋白信号肽、跨膜特征和亚细胞定位分别用SignalP 4.1 (http://www.cbs.dtu.dk/services/ SignalP/)、TMHMM Server 2.0 (http://www.cbs.dtu. dk/services/TMHMM-2.0/)和SubLoc1.0 (http://www. bioinfo.Tsinghua.edu.cn/Sub Loc/)进行预测。采用Clustal O 1.2.4(https://www.ebi.ac.uk/Tools/msa/clus talo/)进行序列比对分析,并用BoxShade 3.21 (http:// ch. embnet.org/software/BOX_ form.html)进行图像修饰。应用MEGA 7构建临近树(Neighbor-joint),采用步靴值(Bootstrap)进行计算,重复1000次。
1.5 线虫氧化胁迫和温度逆境存活监测
为监测在不同程度氧化胁迫和温度逆境下水稻干尖线虫的存活率,设置以下实验:对于氧化胁迫,将约100 条活性良好的线虫分别浸泡于含有0、5、10、25、50、100和250 mmol/L H2O2溶液的96孔细胞培养板中,室温静置48 h,每12 h在体式显微镜下统计线虫存活率;对于温度胁迫,将每孔含有约100条线虫水悬液的96孔细胞培养板分别置于0℃、4℃、12℃、25℃、37℃和45℃孵育箱中,每12 h统计线虫的存活率。每个处理重复6次。
1.6 基因差异表达分析
基于氧化胁迫和温度逆境存活结果,在处理12 h后分别收集不同浓度H2O2和温度胁迫条件下的线虫,并进行RNA提取。利用TRIzol试剂提取线虫总RNA,过程同前。采用反转录试剂盒[PrimeScript™ RT reagent Kit with gDNA Eraser (Perfect Real Time),TaKaRa, 大连]进行cDNA合成;采用荧光定量试剂盒(SsoFast EvaGreen Supermix,Bio-Rad, 美国)进行定量PCR(qRT-PCR),并通过Bio-Rad IQ5系统进行数据采集分析。以水稻干尖线虫 18S rDNA 为内参基因,利用特异引物Ab-18S-F和Ab-18S-R进行的转录丰度检测。共3次生物学重复。相对表达水平用2−ΔΔCT法进行计算[14],并采用检验统计差异显著性。
1.7 AbGrx-1蛋白原核表达和纯化
利用分别含有I和I酶切位点引物AbGrx-28a和AbGrx-28a扩增AbGrx1编码区序列,连接到pET28a表达载体上,转入大肠杆菌Top10感受态细胞并进行转化子筛选,测序正确转化子进行质粒提取,并将融合质粒转入BL21(DE3)感受态细胞中,提取阳性克隆进行蛋白表达,加入终浓度为0.5 mmol/L IPTG进行表达诱导。融合菌株在15℃下诱导15 h后进行超声破碎,含有重组蛋白的上清用6×His标签蛋白纯化试剂盒(ProbeGene, 徐州)进行洗脱纯化。洗脱的蛋白在20 mmol/L Tris-HCl (pH 8.0)缓冲液中透析浓缩,并通过BCA试剂盒(ProbeGene, 徐州)测定蛋白浓度。

5'和3'非翻译区用小写字母表示,开放阅读框用大写字母表示;谷氧还蛋白催化残基用方框表示;用于扩增全长序列的基因特异引物用下划线标注;终止子(TAA)用星号表示。
Fig. 1. Complete nucleotide and deduced amino acid sequences of the AbGrx-1 cDNA (GenBank Accession No. KP190142).
1.8 AbGrx-1蛋白溶液对逆境胁迫下的线虫存活的影响
为检测纯化蛋白是否影响线虫的存活,将线虫置于含有不同浓度(0、5、10、25和50 μmol/L)的AbGrx-1蛋白溶液中,室温浸泡48 h,每12 h观察线虫存活率。为明确AbGrx-1能否增强线虫对氧化胁迫和高温胁迫的能力,将约100条线虫加入终浓度为5 μmol/L AbGrx-1蛋白溶液中,室温孵育48 h,将线虫用ddH2O漂洗2次,再分别转移至50 mmol/L H2O2溶液和45℃孵育箱,12 h后统计线虫存活率。每处理重复3次。
2 结果与分析
2.1 AbGrx-1基因序列和进化树分析
水稻干尖线虫谷氧还蛋白的cDNA序列(GeneBank登录号:KP190142)共508 bp,包括90 bp的5'非翻译区(UTR)、318 bp的编码区和97 bp的3'UTR(图1)。ProtParam预测开发阅读框ORF(横跨91至411位)编码106个氨基酸,相对分子质量为11.65 kD,理论等电点(pI)为8.77。AbGrx-1无信号肽和跨膜结构,定位于细胞质。通过与NCBI上登录的其他11种线虫的Grx序列进行序列比对,发现AbGrx-1第24至27位点具有Grx催化残基CYPC,分别在第69至第72和第83至第86位点存在保守的谷胱甘肽结合位点RSVP和GGDD(图2)。
通过NCBI/BLASTP发现谷氧还蛋白在人类、动植物、昆虫和线虫等生物有机体中保守存在。AbGrx-1 (AJE60960)与线虫的Grx具有很高的相似性,其中与动物寄生线虫捻转血矛线虫(, CDJ92071)蛋白序列相似度最高,达68%(E=5× 10−47),而棘唇线虫(,VBB32303)相似度最低,为57%(E=2×10−43);与植物寄生线虫燕麦真滑刃线虫(,AAQ20895)和草莓芽线虫(, AFC377891)分别有67%(E=2×10−54)和64%(E=4×10−49)的相似性;与三种自由生活线虫(CAP38709)、(EFO84822)和(EGT47413)相似性分别为67%、66%和64%。
以二斑叶螨(,XP_01578 4727)谷氧还蛋白为外围群体,将NCBI上登录的23个线虫的谷氧还蛋白进行进化树分析。系统发育树将线虫的谷氧还蛋白划分为2个大的分支,一个分支由罗阿丝虫(,XP 020304614)、曲折盘尾丝虫(,OZC08115)、棘唇线虫(,VBB32303)、马来丝虫(,CRZ22053)以及吴策线虫()等人类和动物寄生丝状线虫组成,另一个分支则包括自由生活线虫、植物寄生线虫以及人类和动物寄生线虫。在目前已知的三种植物寄生线虫中,水稻干尖线虫AbGrx-1与燕麦真滑刃线虫(,AAQ20895)划归于同一个次级分支,而与草莓芽线虫(,AFC 377891)分属不同次级分支(图3)。

方框表示谷胱甘肽结合位点,向下箭头表示谷氧还蛋白的催化残基;一致和相似的序列分别用星号和圆点表示。
Fig. 2. Sequences alignment ofand other nematode glutaredoxin proteins.
2.2 逆境胁迫下线虫AbGrx-1表达水平检测
为了检测氧化和温度胁迫对基因表达水平的影响,首先分析了不同浓度H2O2溶液和不同温度处理对线虫存活率的影响。结果显示,随着H2O2浓度的逐渐升高,线虫的存活率逐渐下降。浸泡于100 mmol/L和250 mmol/L H2O2中24 h可导致80%供试线虫死亡,48 h则导致供试线虫全部死亡;而5 mmol/L和10 mmol/L H2O2溶液对于线虫存活无较大影响,在48 h时仍有90%以上的存活率。浸泡于中间浓度25 mmol/L和50 mmol/L的H2O2溶液中,线虫的存活率存在较大差异:浸泡于25 mmol/L H2O224 h,超过85%线虫存活,而在50 mmol/L H2O2中,线虫存活为38.6%(图4-A)。在温度逆境下,线虫在0、4、12、25℃等较低温度中保持较高存活率,在处理48 h时仍有超过95%存活率。随着时间的推移和温度的升高,暴露于37℃和45℃高温环境下48 h,线虫的存活率分别为54.6%和4.2%(图4-B)。
线虫浸泡于H2O2溶液中12 h,表达水平显著提高,在5 mmol/L H2O2溶液中,表达水平为对照组的19.3倍,随着H2O2浓度的提高,的表达水平下降,但都显著高于对照组(<0.01)(图5-A)。当线虫处于温度逆境中,相比25℃,的表达水平在0℃、4℃、37℃和45℃下对显著降低,而在12℃时表达水平显著提高,为25℃环境中的1.5倍(<0.01)。

图3 线虫谷氧还蛋白的遗传发育树
Fig. 3. Phylogenetic relationship among different glutaredoxin proteins in the known nematodes species.
2.3 AbGrx-1蛋白提高线虫在逆境胁迫中的存活率
为了研究AbGrx-1蛋白功能,构建了融合表达载体进行原核表达。通过IPTG诱导,SDS-PAGE电泳获得一条约14 kD的蛋白条带,与理论分子量相当,通过Ni-IDA柱进行洗脱纯化获得高纯度的AbGrx-1蛋白(图6-A)。将线虫浸泡于不同浓度的AbGrx-1蛋白溶液中,随着时间的推移和蛋白浓度的升高线虫的存活率逐渐下降。48 h时,浸泡于50 μmol/L 蛋白溶液超过13%的线虫死亡,而在低浓度5 μmol/L和10 μmol/L溶液中,线虫的存活率超过90%(图6-B)。为了检测AbGrx蛋白是否增强线虫的抗逆能力,选择5 μmol/L浓度进行后续处理。
将预先浸泡在5 μmol/L AbGrx-1蛋白溶液中的线虫分别置于氧化和高温逆境12 h,结果显示,AbGrx-1蛋白预处理的线虫在50 mmol/L H2O2溶液中的存活率为64.73%,显著高于未预处理的41.28% (<0.01)(图6-C)。45℃高温胁迫下,预处理的线虫存活率为79.81%,高于未处理的65.61%,但差异不显著;而处于25℃环境中线虫的存活率不受影响(图6-D)。
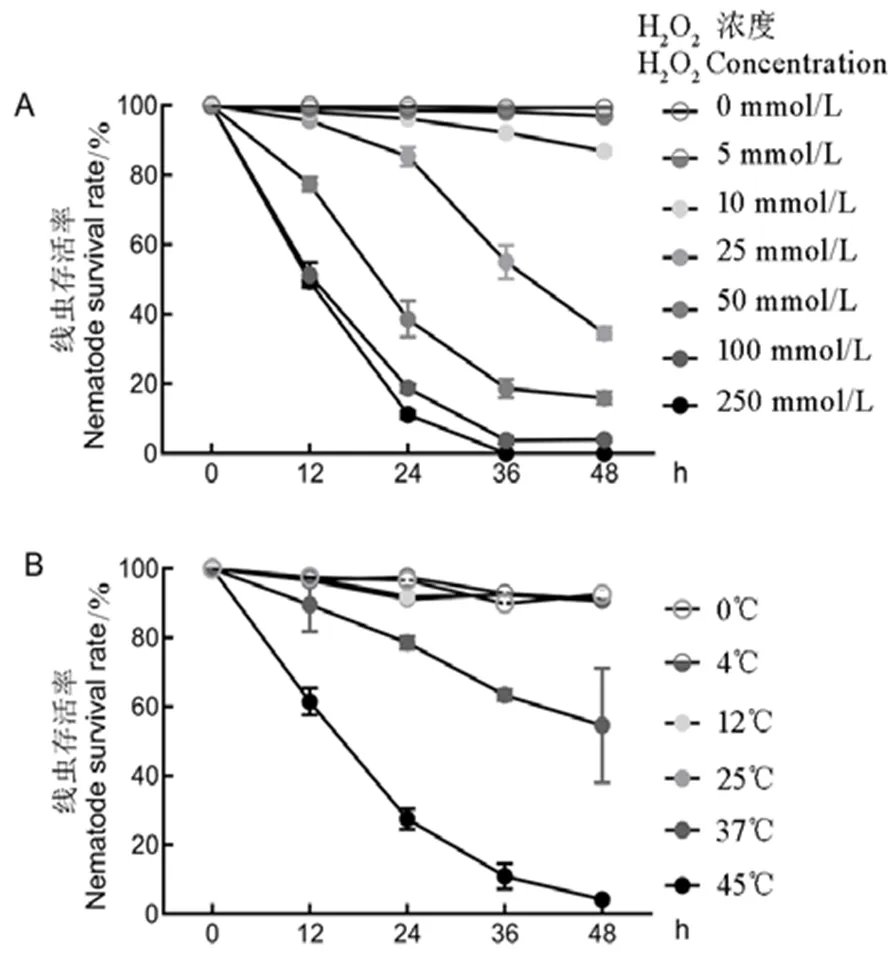
图4 氧化胁迫(A, H2O2处理)和温度胁迫(B)下水稻干尖线虫的存活率
Fig. 4. Cumulative survival rates ofexposed to H2O2(A) and temperature (B) stress.
柱条表示标准误;*,**分别表示与对照(0mml/L或25℃)差异达0.05, 0.01显著水平。
Bars are stardand error. *, ** indicate significant difference between the treatment and the CK(0mml/L or 25℃)at 0.05 and 0.01 levels. The same as in figures below.
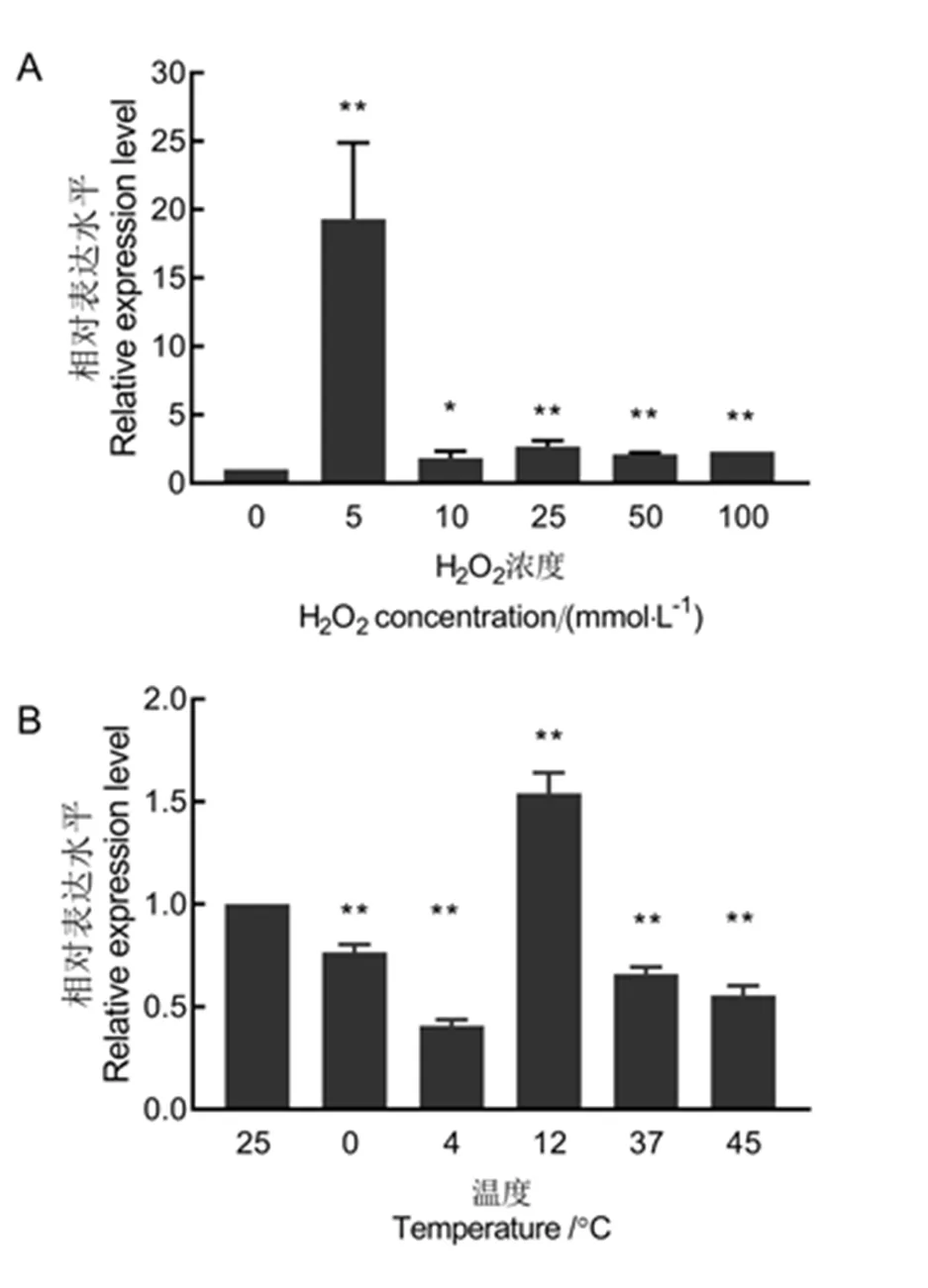
图5 暴露于不同浓度H2O2和不同温度12 hAbGrx-1的相对表达水平
Fig. 5. Relative expression level of AbGrx-1exposed to H2O2and temperature stress for 12 hours.
3 讨论
作为氧化还原酶,Grxs参与维持和调控胞间氧化还原平衡。目前,已有许多昆虫的基因被克隆,表达分析也已完成。当遭受饥饿、紫外光照射、机械损伤及高低温逆境时,亚洲玉米螟()迅速被诱导表达[15]。中华蜜蜂()和受高低温、H2O2、杀虫剂、汞等极端因子的诱导[16]。棉铃虫()、和受不同温度和H2O2的诱导[17],进一步检测发现这些Grxs具有抗氧化防御的功能。然而有关植物寄生线虫Grx的研究十分有限。
本研究通过RACE-PCR技术克隆了水稻干尖线虫的谷氧还蛋白。从氨基酸序列和结构上来说,AbGrx-1蛋白在所有线虫中都高度保守。基于活性位点[1],AbGrx-1与已经报道的草莓芽线虫谷氧还蛋白AF-GLX-1一样,归属于Ⅰ类Grx[6]。尽管如此,在进化关系上,其中一些Grx在分类上可能存在变异。NJ进化树分析显示,尽管位于一个大的进化分支,但AbGrx-1与AF-GLX-1分属不同的次级分支,而与燕麦真滑刃线虫、鼠类圆线虫()和犬弓蛔虫()的谷氧还蛋白属于同一次级分支。
前期已有文献报道,自由生活线虫对H2O2十分敏感,低浓度H2O2浸泡能快速造成虫体死亡[4, 18, 19];而植物线虫对氧化胁迫具有较强的适应性,例如南方根结线虫() J2在100 mmol/L H2O2溶液中浸泡30 min,仅有10%的线虫死亡[20]。相比根结线虫,水稻干尖线虫对H2O2极不敏感,在100 mmol/L和250 mmol/L的H2O2溶液中浸泡24 h仍不会全部死亡(图4-A)。之前有研究利用H2O2溶液对水稻干尖线虫进行表面消毒却不影响线虫的活性[21, 22],暗示水稻干尖线虫可能利用特殊的抗氧化机制来克服外界的氧化胁迫。线虫对温度改变的适应是其生存的关键。例如,昆虫病原线虫小卷蛾斯氏线虫() 在低温(5~ 25℃)下的存活率和致病性显著高于高温35℃[23];肾型线虫()在10℃时不能侵染植物,但在零下低温环境中仍能存活6个月[24]。本研究发现,适度的低温胁迫不能显著影响水稻干尖线虫的存活,短期的高温胁迫也不能造成全体供试线虫死亡(图4-B),表明水稻干尖线虫对温度逆境具有极强的耐受力。
之前的研究表明,燕麦真滑刃线虫()的表达不受H2O2和低温诱导,而受高温抑制[25];而低温能抑制草莓芽线虫()的表达[6]。这些结果说明不同线虫的Grx对于氧化和温度压力的反应存在差异。通过监测H2O2处理和温度逆境下水稻干尖线虫基因表达水平,发现H2O2能显著诱导的表达,并且低浓度(5 mmol/L) H2O2下表达水平最高(图5-A)。考虑到低浓度H2O2对线虫存活率的影响较小,推测5 mmol/L H2O2是水稻干尖线虫虫体损伤的临界浓度,水稻干尖线虫能通过诱导的高表达激发自身的抗氧化免疫反应。各温度胁迫下表达水平最多被诱导1.54倍(图5-B)。当培养温度从25℃上升到31℃~33℃时,热激蛋白Hsp90、Hsp70和小分子Hsp蛋白迅速被诱导合成,表现出典型的热休克反应[26];而低温和高温能显著诱导水稻干尖线虫Hsp90基因上调表达[10]。因此,水稻干尖线虫可能不通过诱导AbGrx-1的表达应对温度逆境。
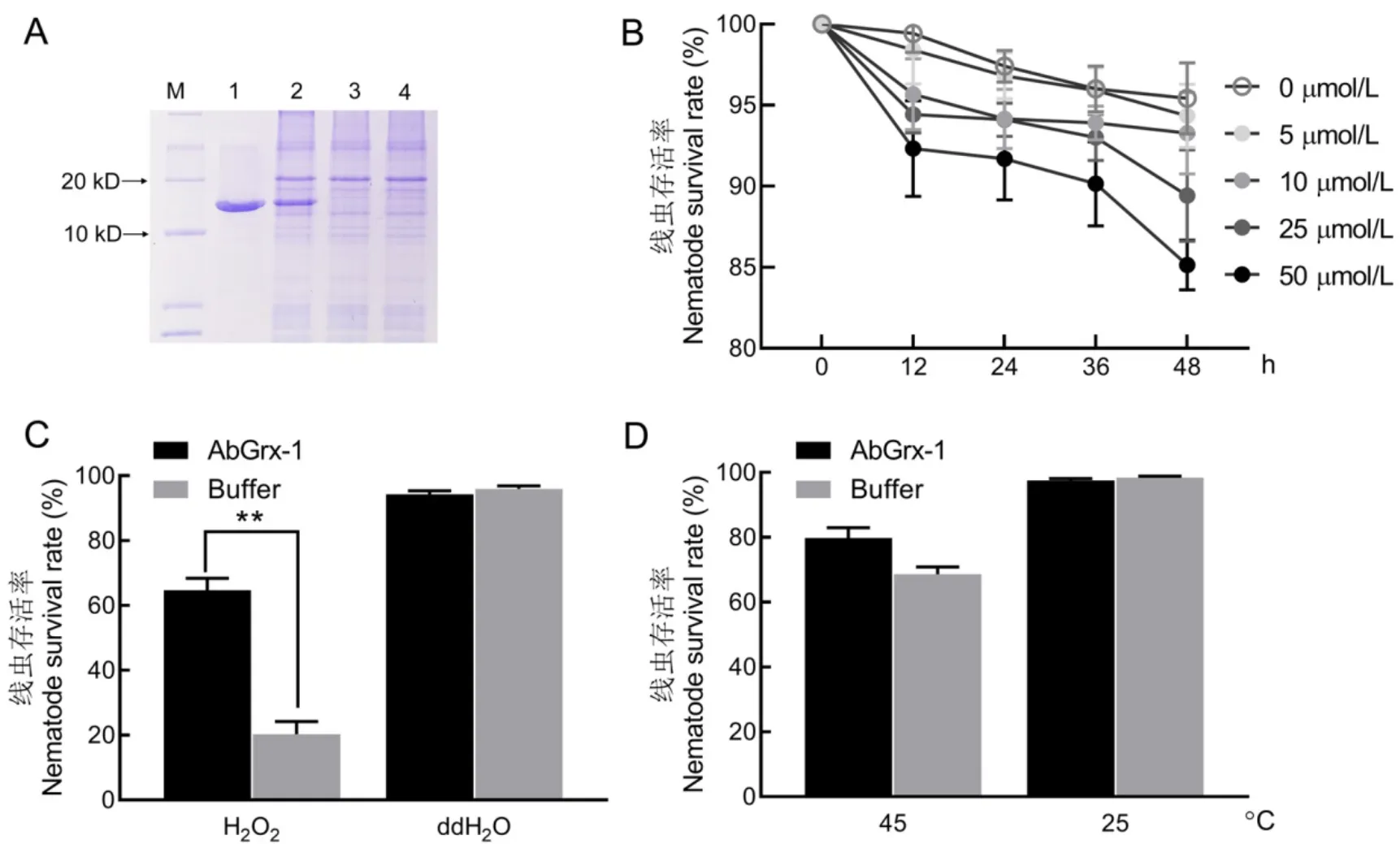
A,AbGrx-1蛋白的表达和纯化;M,标记;1,纯化的蛋白;2,IPTG诱导表达的蛋白;3,未诱导蛋白;4,空载;B,不同浓度AbGrx1溶液浸泡对线虫存活率的影响;C~D,AbGrx-1蛋白预处理的线虫在氧化(C)和高温逆境(D)处理中的存活率。**表示处理与对照间差异达0.01显著水平。
Fig. 6. Role of AbGrx-1 protein in the response ofto oxidization and temperature stresses.
Li等[27]发现利用荞麦谷氧还蛋白rbGrx溶液浸泡能降低氧化胁迫和高温逆境下虫体内活性氧水平,增强SOD、CAT等氧化酶的活性,从而提高线虫对氧化胁迫和高温逆境下的存活率,并延长线虫的寿命。与之不同, AbGrx-1原核表达蛋白溶液预处理能显著提高氧化胁迫下水稻干尖线虫的存活率,但不能显著降低高温逆境导致的线虫死亡率(图6)。通过体外酶活测试,证实AbGrx-1蛋白能有效清除反应溶液中H2O2(数据未发表)。因此,AbGrx-1蛋白能通过降低虫体活性氧水平以减少细胞的氧化损伤,从而提高线虫存活率。
在线虫与寄主互作过程中,寄主能产生活性氧以抵御线虫的侵染取食;为了存活,线虫常常分泌一系列抗氧化酶抑制寄主活性氧信号的免疫反应[20]。例如,动物病原线虫通过SOD、GPX和CAT等抵抗ROS对其造成的损伤[28]。松材线虫()能利用半胱氨酸过氧化物还原酶(Prx2s)弱化寄主防卫反应,促进侵染[29]。根结线虫能分泌转甲状腺素蛋白(MjTTL5)与寄主植物铁(硫)氧还蛋白还原酶催化亚基互作,清除侵染细胞活性氧完成侵染[30]。AbGrx-1作为水稻干尖线虫抵抗氧化胁迫重要蛋白,在侵染寄主早期高度表达(结果未显示),暗示AbGrx-1可能参与水稻干尖线虫与寄主互作。因此,AbGrx-1可能是水稻干尖线虫潜在的防控靶点,通过抑制的表达将有助于水稻干尖线虫病的高效防控。
[1] Kalinina E V, Chernov N N, Novichkova M D. Role of glutathione, glutathione transferase, and glutaredoxin in regulation of redox-dependent processes., 2014, 79(13): 1562-1583.
[2] Lillig C H, Berndt C, Holmgren A. Glutaredoxin systems., 2008, 1780(11): 1304-1317.
[3] Morita S, Yamashita Y, Fujiki M, Todaka R, Nishikawa Y, Hosoki A, Yabe C, Nakamura J I, Kawamura K, Suwastika I N, Sato M H, Masumura T, Ogihara Y, Tanaka K, Satoh S. Expression of a rice glutaredoxin in aleurone layers of developing and mature seeds: Subcellular localization and possible functions in antioxidant defense., 2015, 242(5): 1195-1206.
[4] Morgan K L, Estevez A O, Mueller C L, Cacho-Valadez B, Miranda-Vizuete A, Szewczyk N J, Estevez M. The glutaredoxin GLRX-21 functions to prevent selenium- induced oxidative stress in., 2010, 118(2): 530-543.
[5] Vanina E. Marquez, Diego G. Arias, Claudia V. Piattoni, Carlos Robello, Alberto A. Iglesias, Guerrero A S A. Cloning, expression, and characterization of a dithiol glutaredoxin from., 2010, 12(6): 787-791.
[6] Fu Z, Agudelo P, Wells C E. Induction of glutaredoxin expression in response to desiccation stress in the foliar nematode., 2012, 44(4): 370-367.
[7] Shigeru H, Katsumi T. Effect of water-soaking and air-drying on survival ofinseeds., 2000, 32(3): 303-308
[8] Tenente R V V, Wetzel M M V S, Manso E S B G, Marques A S A. Survival ofin infested rice seeds stored under controlled conditions., 1994, 18: 85-92.
[9] Feng H, Wei L, Chen H, Zhou Y. Calreticulin is required for responding to stress, foraging, and fertility in the white-tip nematode,., 2015, 155: 58-67.
[10] 冯辉, 陈曦, 束兆林, 姚克兵, 魏利辉. 水稻干尖线虫基因克隆及在不同逆境、侵染早期和取食过程的表达差异. 农业生物技术学报, 2016, 24(11): 1741-1753.
Feng H, Chen X, Shu Z L, Yao K B, Wei L H. Characterization of the Hsp90 Gene in the white tip nematode () and its expression in response to environmental stresses, early infection and feeding., 2016, 24(11): 1741-1753. (in Chinese with English abstract)
[11] 陈曦, 冯辉, 束兆林, 姚克兵, 魏利辉. 水稻干尖线虫海藻糖酶基因克隆与逆境条件下的表达分析. 核农学报, 2016, 30(12): 2304-2311.
Chen X, Feng H, Shu Z L,Yao K B, Wei L H. Isolation and expression analysis of a trehalase gene from white tip nematode., 2016, 30(12): 2304-2311.(in Chinese with English abstract)
[12] 陈俏丽, 王峰, 李丹蕾, 零雅茗, 张瑞芝. 水稻干尖线虫基因在高渗透压下的表达. 中国水稻科学, 2017, 31(6): 652-657.
Chen Q L, Wang F, Li D L, Ling Y M, Zhang R Z. Expression under hypertonic osmotic stress of Ab-lea from., 2017, 31(6): 652-657.(in Chinese with English abstract)
[13] Staheli J P, Boyce R, Kovarik D, Rose T M. CODEHOP PCR and CODEHOP PCR Primer Design. In: PARK D J,. Totowa, NJ: Humana Press 2011: 57-73.
[14] Schmittgen T D, Livak K J. Analyzing real-time PCR data by the comparative CTmethod., 2008, 3(6): 1101-1108.
[15] An S, Zhang Y, Wang T, Luo M, Li C. Molecular characterization of glutaredoxin 2 from., 2013, 8 (Suppl 1): 30-38.
[16] Yao P, Chen X, Yan Y, Liu F, Zhang Y, Guo X, Xu B. Glutaredoxin 1, glutaredoxin 2, thioredoxin 1, and thioredoxin peroxidase 3 play important roles in antioxidant defense in Apis cerana cerana., 2014, 68: 335-346.
[17] Zhang S D, Shen Z J, Liu X M, Li Z, Zhang Q W, Liu X X. Molecular identification of three novel glutaredoxin genes that play important roles in antioxidant defense in., 2016, 75: 107-116.
[18] Olahova M, Taylor S R, Khazaipoul S, Wang J, Morgan B A, Matsumoto K, Blackwell T K, Veal E A. A redox-sensitive peroxiredoxin that is important for longevity has tissue- and stress-specific roles in stress resistance., 2008, 105(50): 19839-19844.
[19] Isermann K, Liebau E, Roeder T, Bruchhaus I. A peroxiredoxin specifically expressed in two types of pharyngeal neurons is required for normal growth and egg production in Caenorhabditis elegans., 2004, 338(4): 745-755.
[20] Dubreuil G, Deleury E, Magliano M, Jaouannet M, Abad P, Rosso M N. Peroxiredoxins from the plant parasitic root-knot nematode,, are required for successful development within the host., 2011, 41(3-4): 385-396.
[21] Zhou T, Gao C, Du L, Feng H, Wang L, Lan Y, Sun F, Wei L, Fan Y, Shen W, Zhou Y. Genetic analysis and QTL detection for resistance to white tip disease in rice., 2014, 9(8): e106099.
[22] Sun M J, Liu W H, Lin M S. Effects of temperature, humidity and different rice growth stages on vertical migration of., 2009, 16(4): 301-306.
[23] Kung S-P, Gaugler R, Kaya H K. Effects of soil temperature, moisture, and relative humidity on entomopathogenic nematode persistence., 1991, 57(2): 242-249.
[24] Heald C M, Inserra R N. Effect of Temperature on Infection and Survival of Rotylenchulus reniformis., 1988, 20(3): 356-361.
[25] Browne J A, Dolan K M, Tyson T, Goyal K, Tunnacliffe A, Burnell A M. Dehydration-specific induction of hydrophilic protein genes in the anhydrobiotic nematode., 2004, 3(4): 966-975.
[26] Stringham E G, Candido E P M. Transgenic hsp 16-Lacz strains of the soil nematode caenorhabditis elegans as biological monitors of environmental stress., 1994, 13(8): 1211-1220.
[27] Li F, Ma X, Cui X, Li J, Wang Z. Recombinant buckwheat glutaredoxin intake increases lifespan and stress resistance via hsf-1 upregulation in., 2018, 104: 86-97.
[28] Henkle-Duhrsen K, Kampkotter A. Antioxidant enzyme families in parasitic nematodes., 2001, 114: 129-142.
[29] Zhen L, Xiaoxia L, Yanna C, Yan W, Qingwen Z, Xuguo Z. Cloning and characterization of a 2-Cys peroxiredoxin in the pine wood nematode,, a putative genetic factor facilitating the infestation., 2011, 7(6): 823-836.
[30] Lin B, Zhuo K, Chen S, Hu L, Sun L, Wang X, Zhang L H, Liao J. A novel nematode effector suppresses plant immunity by activating host reactive oxygen species-scavenging system., 2016, 209(3): 1159-1173.
Protective Effect of Glutaredoxin (AbGrx-1) onUnder Oxidative Stress
FENG Hui2, FAN Yalei2, ZHANG Jinfeng2, ZHU Hongli1, WEI Lihui1, 2, *
(1,,,;2,,,;Corresponding author,)
The antioxidant glutaredoxin (Grx) plays a crucial role in regulating intracellular redox homeostasis via scavenging of excess reactive oxygen species. The white-tip nematodecan survive in adverse environments including high temperature,osmosis and oxidative stresses. To reveal the antioxidant function of Grx in,herein the full-length cDNA of glutaredoxin (named AbGrx-1) fromwas cloned by using rapid amplification of cDNA ends (RACE), and AbGrx-1 protein and evolutionary relationship were characterized; differential gene expression level was detected in the nematodes under oxidant and temperature stresses by using quantitative real-time PCR; the effect of the recombinant AbGrx-1 protein onsurvival was also tested.The full-lengthcDNA contains a 5' UTR of 90, an ORF of 321 bp encoding a polypeptide of 106 amino acids and a 3' UTR of 97 bp. The deduced amino acid sequence of AbGrx-1 shares a high similarity with other nematodes’ Grxs, and the catalytic residue (CPYC) and glutathione binding sites (RSVP and GGDD) indicate that AbGrx-1 is categorized into Class I Grx. The phylogenetic tree showed AbGrx-1 is located in the same clade with the plant parasitic nematode. AbGrx-1 mRNA is highly induced inexposed to H2O2solution and 12℃, but is suppressed in the nematodes at 0, 4, 37 and 45℃. The high concentration H2O2solutions and high temperature are adverse to survival of, but the survival rate increases with the nematodes pre-soaked in AbGrx-1 recombinant protein solution.AbGrx-1 is required forantioxidative immunity, and plays an essential role in overcoming oxidative damage and nematode survival.
; glutaredoxin; gene cloning; recombinant protein; antioxidation
S435.111.4+8
A
1001-7216(2019)06-0565-10
10.16819/j.1001-7216.2019.9016
2019-01-28;
2019-05-07。
国家自然科学基金资助项目(31401728);江苏省农业自主创新资金资助项目[cx(17)3023]。
