绝经后骨质疏松症及其合并代谢综合征的研究
2019-11-13尹肖寒张宁杨芳张瑞岩韩军王正平
尹肖寒 张宁 杨芳 张瑞岩* 韩军 王正平*
1.聊城大学生物制药研究院,山东 聊城 252000 2.聊城市人民医院临床营养学实验室,山东 聊城 252002
随着国民经济的飞速发展和人们生活方式的改变,人口老龄化日益明显,中老年人的健康问题已引起广泛重视。以往普遍认为骨质疏松症(osteoporosis,OP)、2型糖尿病、脂代谢异常、高血压这些常见病是相互独立的疾病。但近几年的研究发现,它们常并存于同一个体,并且病理生理机制类似。有研究表明代谢综合征(metabolic syndrome,MS)是OP的独立危险因素[1]。绝经后骨质疏松症(postmenopausal osteoporosis,PMOP)是一种由多因素引起的与年龄相关的慢性退行性代谢性疾病。PMOP患者体内的雌激素水平下降,可以间接引起脂代谢异常和功能障碍。研究表明,临床上大多数用于治疗OP的药物对血脂具有调节作用[2]。MS是一种包括中心性肥胖、高血压、糖脂代谢异常等在内的临床综合征,与OP类似的是,它们都是多发于中老年人的慢性退行性病变,且发病率随年龄增长呈显著上升趋势[3]。MS与PMOP二者关系密切,但既往相关研究较少,二者关联机制尚未完全阐明。本研究旨在探究MS患者的高血压、脂代谢异常等多种因素与PMOP的关系,从而为该类疾病和合并症预防及治疗提供新的理论依据。
1 资料与方法
1.1 研究对象
选取2017年3月至2018年1月在聊城大学营养中心和聊城市人民医院体检的绝经后妇女266例,包括N-PMOP患者共122例,平均年龄(60.02±9.17)岁;PMOP患者共144例,平均年龄(67.66±11.47)岁,依据代谢综合征及骨质疏松症的诊断标准[4-5]筛选出MS-PMOP患者共69例,未合并MS的PMOP的患者共75例。排除标准:①原发性或继发性甲亢;严重缺乏钙及维生素D;骨转移或骨髓瘤等;②近半年内曾使用双膦酸盐、维生素D、钙剂、雌激素、各种降脂药或糖皮质激素、抗癫痫药物等影响骨代谢的药物;③有精神及认知障碍者,长期卧床者;④过早(≤40岁)绝经;⑤既往有椎体退变性或有脊柱或腰椎创伤等压缩性、创伤性或脆性骨折病史。所有参与研究人员均知情同意并签署知情同意书。
1.2 研究方法
1.2.1临床资料收集:采用回顾性资料分析方法对研究对象进行问卷调查,详实采集并记录相关资料(包括年龄、现病史、既往史、婚育史、月经史、家族史等),通过标准仪器测量身高、体重和血压,并计算体质量指数(body mass index,BMI)。
1.2.2血生化指标和骨密度检测:抽取两组研究对象晨起空腹外周血,室温离心后提取血清,置于-20 ℃以备测定;采用全自动生化分析仪检测空腹血糖(fasting plasma glucose,FPG)、三酰甘油(triglyceride,TG)、低密度脂蛋白(low density lipoprotein cholesterol,LDL-C)等。检测严格按照操作标准进行。所有研究对象均使用双能X线骨密度仪(DEXA)测定腰椎(L1-L4)、股骨干及全身骨密度,通过计算机程序得出T值。
1.3 诊断标准
1.3.1代谢综合征诊断标准:中华医学会糖尿病分会关于MS诊断标准[4]如下:同时满足以下条件≥3条者,即可明确诊断。(1)超重和(或)肥胖(BMI≥25 kg/m2)。(2)糖尿病:FPG≥6.1 mmol/L及(或)餐后2 h血糖≥7.8 mmol/L以及(或)已确诊为糖尿病;包括正在接受治疗的患者。(3)高血压:血压≥140/90 mmHg和(或)已确诊为高血压;包括正在治疗中的患者。(4)脂代谢紊乱:TG≥1.7 mmol/L和(或)高密度脂蛋白(high-density lipoprotein cholesterol,HDL-C)<1 mmol/L。
1.3.2骨质疏松症诊断标准:根据2017年最新颁布的中国原发性骨质疏松症诊治指南,基于双能X线检测骨密度的诊断标准如下:T值≥-1 SD,则诊断为骨量正常;-2.5 SD≤T值<-1 SD,则诊断为骨量低下;T值<-2.5SD,则诊断为骨质疏松[5]。
1.4 统计学分析

2 结果
2.1 PMOP与N-PMOP患者一般资料及血生化指标比较
2.1.1PMOP与N-PMOP患者一般资料比较:将研究对象分为绝经后骨质疏松症组(PMOP组)与绝经后非骨质疏松症组(N-PMOP组)。其中,两组的年龄差异有统计学意义(P<0.05),而两组的身高、体重、BMI差异没有统计学意义(P>0.05),详见表1。
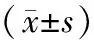
表1 PMOP与N-PMOP患者间一般资料比较 Table 1 Comparison of general characteristics between PMOP and N-PMOP
注:*代表在P<0.05层面上具有统计学意义。
2.1.2PMOP与N-PMOP患者血生化指标比较:PMOP组的收缩压(systolic blood pressure,SBP)、舒张压(diastolic blood pressure,DBP)、FPG、同型半胱氨酸(homocysteine,HCY)均值高于N-PMOP组,差异有统计学意义(P<0.05);并且PMOP组的HDL-C均值低于N-PMOP组,差异有统计学意义(P<0.05),详见图1~4。
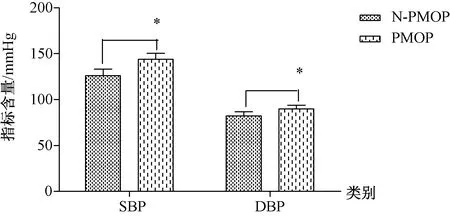
图1 PMOP和N-PMOP两组血压差异性比较Fig.1 Comparison of differences in blood pressure between PMOP and N-PMOP groups

图2 PMOP和N-PMOP两组空腹血糖差异性比较Fig.2 Comparison of differences in FPG between PMOP and N-PMOP groups

图3 PMOP和N-PMOP两组脂代谢指标含量的差异性比较Fig.3 Comparison of differences in lipid metabolism index between PMOP and N-PMOP groups

图4 PMOP和N-PMOP两组同型半胱氨酸含量差异性比较Fig.4 Comparison of the difference in HCY content between PMOP and N-PMOP groups注:*代表在P<0.05层面上有统计学意义。
2.1.3PMOP患者的危险因素分析:以年龄、SBP、DBP、FPG、HDL-C及HCY为自变量,骨量为因变量,进行二元Logistic回归分析。回归方程为:骨质疏松=-46.209+0.368收缩压+1.702空腹血糖+(-10.951)HDL-C。经分析,研究对象的SBP、FPG及HCY的增高都是合并MS的PMOP患者的危险因素。收缩压、空腹血糖与PMOP呈正相关(P<0.05),其次,HDL-C与骨质疏松独立负相关,均为其重要的危险因素。详见表2。
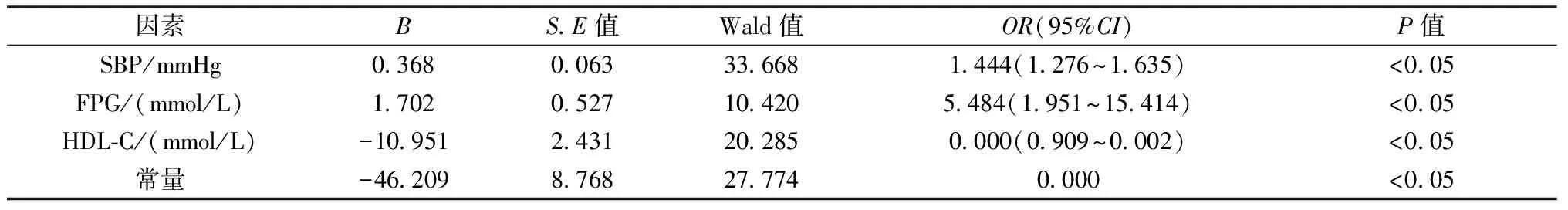
表2 PMOP患者的危险因素分析 Table 2 Risk factors analysis of PMOP patients
2.2 合并MS的PMOP患者与PMOP患者一般资料及血生化指标比较
2.2.1合并MS的PMOP患者与PMOP患者一般资料比较:依据MS诊断标准将PMOP组中患者分为合并MS的PMOP患者组(MS-PMOP组)和PMOP患者组(PMOP组)。经分析,PMOP组患者的年龄、身高均值高于MS-PMOP组,差异有统计学意义(P<0.05);而PMOP组患者的体重、BMI均值低于MS-PMOP组,差异有统计学意义(P<0.05),详见表3。
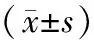
表3 合并MS的PMOP患者间一般资料比较Table 3 Comparison of general characteristics between MS and PMOP
注:P<0.05代表差异有统计学意义。
2.2.2合并MS的PMOP患者与PMOP患者血生化指标比较:经统计分析,PMOP组患者的DBP、FPG、HDL-C、HCY均值低于MS-PMOP组,差异有统计学意义(P<0.05),详见图5~8。

图5 MS-PMOP与PMOP两组血压差异性比较Fig.5 Comparison of blood pressure between MS-PMOP and PMOP groups

图6 MS-PMOP与PMOP空腹血差异性比较Fig.6 Comparison of FPG between MS-PMOP and PMOP groups

图7 MS-PMOP与PMOP脂代谢指标含量差异性比较Fig.7 Comparison of lipid metabolism indicators between MS-PMOP and PMOP groups

图8 MS-PMOP与PMOP同型半胱氨酸含量差异性比较Fig.8 Comparison of homocysteine content between MS-PMOP and PMOP groups注:*代表在P<0.05层面上具有统计学意义。
2.3 MS-PMOP患者骨密度的相关性分析
经分析,与MS-PMOP患者骨密度T值呈负相关的因素包括:年龄(r=-0.559,P<0.05)、收缩压(r=-0.239,P<0.05)、舒张压(r=-0.95,P<0.05)、FPG(r=-0.457,P<0.05)、LDL-C(r=-0.981,P<0.05)、HCY(r=-0.898,P<0.05);与骨密度T值呈正相关的因素为:HDL-C(r=0.951,P<0.05)、血清钙(r=0.336,P<0.05)、血清磷(r=0.834,P<0.05)。详见表4。
表4骨密度和各项指标的相关性分析
Table4Correlation analysis of bone mineral density and various indicators

项目r值P值年龄-0.559∗<0.05身高0.0080.949体重-0.1180.334BMI-0.1570.199收缩压-0.239∗0.048舒张压-0.950∗<0.05FPG-0.457∗<0.05HDL-C0.951∗<0.05LDL-C-0.981∗<0.05VLDL-C0.215<0.05钙0.336∗<0.05磷0.834∗<0.05TG-0.0460.706HCY-0.898∗<0.05
注:*代表在P<0.05层面上具有统计学意义。
3 讨论
骨密度的变化与年龄密切相关,骨密度峰值可以预测OP发病率和骨量流失程度。在排除其他影响骨密度的前提下,人类骨密度达到骨峰值是在25~35岁[6]。骨密度峰值维持到50岁左右(相当于女性绝经期),随后骨密度呈现逐渐下降趋势。除此之外,绝经后女性骨脆性较男性高,更容易出现骨折。原因在于女性骨量流失是骨小梁断裂,而男性的骨量流失是骨小梁微小结构退化。
已有研究表明,高血压病与OP之间呈负相关[7]。这与本研究结果SBP、DBP与骨密度呈负相关(P<0.05)一致,可能发生的机制主要是:①高血压患者甲状旁腺激素分泌增多,刺激破骨细胞活性增强,导致骨量减少;②高血压患者氧化应激过程增强[8]。除此之外,易云平等[9]研究结果显示骨密度与空腹血糖没有明显相关性,而Lohmander等[10]的研究证实空腹血糖高常合并骨质疏松,这与本研究结果吻合,FPG与骨密度呈负相关(P<0.05)。由此可见,空腹血糖增高是骨质疏松的影响因素。国外相关文献报道其机制可能为:体内胰岛素分泌不足和机体对胰岛素的低敏感性,导致骨基质胶原蛋白分解增加,降低了成骨细胞活性,从而引起骨质量的降低[10]。
除此之外,有研究证实,机体处于脂代谢异常状态下,会引起骨髓基质细胞分化程度的改变,其向脂肪细胞分化增多,向成骨细胞的分化明显减少,从而影响骨代谢[11]。本研究结果显示,HDL-C、血清钙、血清磷与骨密度呈正相关(P<0.05),LDL-C、HCY与骨密度T值呈负相关(P<0.05)。其中,HDL-C可以保护成骨细胞基质微环境免受脂质氧化的破坏,这种保护作用可能与体内清道夫受体SR-BI的表达增加相关[12]。而LDL-C水平升高则会引起脂质过氧化增强,破坏成骨细胞基质微环境。因此,PMOP患者更应该注意脂代谢血生化指标的监测,并且PMOP的发生与脂代谢异常是交互作用的复杂病理过程,进行基因位点的研究很有必要。既往研究表明较高水平的HCY会影响到机体的骨代谢,从而引起骨质疏松[13]。在这一点上和本研究结论相吻合。其对PMOP的影响机制主要是高HCY改变了血流动力学,从而影响到骨骼代谢,进而导致骨质疏松的发生[14]。
代谢综合征和绝经后骨质疏松症都是与年龄相关的慢性代谢性疾病,且发病机制较为复杂。目前,MS与PMOP的关系尚无明确定论,既往研究结果不尽相同[15-17]。本研究结果显示,MS患者的SBP、FPG增高,HDL-C降低均是PMOP的危险因素。分析可能的发病机制是:MS患者的骨量丢失现象主要是由于MS的异常代谢状态改变了与骨代谢相关的成骨、破骨细胞活性,骨密度失去平衡。
综上所述,脂代谢异常、高同型半胱氨酸等都有可能会影响绝经后妇女骨代谢,加剧绝经后骨质疏松症的发生;MS患者的SBP、FPG的增高,HDL-C的降低均是PMOP的危险因素,MS患者作为多种代谢异常的聚集体,是PMOP发生的高危人群。因此,合理控制血压、血糖、血脂,定期监测代谢综合征患者的骨密度水平及HCY等生化指标显得尤为重要。
