氟化钠对骨组织主要细胞类型的影响
2019-11-13蒋宁宁郭奉杨史立群徐辉
蒋宁宁 郭奉杨 史立群 徐辉
1.吉林大学药学院再生医学科学研究所,吉林 长春 130021 2.内蒙古自治区鄂伦春自治旗阿里河社区卫生服务中心,内蒙古 鄂伦春165450
骨质疏松是一种以骨量低为特点的代谢性骨病变,而骨量的减少与骨重建过程联系紧密[1]。在骨重建过程中,成骨细胞、破骨细胞分别负责骨形成和骨吸收,来稳定骨骼的结构[2]。骨细胞通过响应机械应力发送的信号来调节骨吸收或骨形成,在骨重建的作用是其主要功能。众多研究发现,氟化物对成骨细胞、破骨细胞的分化起着重要作用[3-4],成骨细胞的增殖速率决定着骨形成速率,破骨细胞的数量及活性决定了骨吸收速率,二者的动态平衡决定骨代谢的平衡[5]。研究证明,氟化物过量可引起骨组织细胞和骨基质的矿化缺陷,导致骨代谢平衡失调,引发骨质疏松等全身性的骨骼疾病[6-7]。迄今为止,不同剂量氟对骨细胞活性影响的研究报道很少,尤其是平行研究不同氟浓度下骨组织中3种主要细胞的活性变化还未见报道。因此,本研究探究不同氟浓度对3种细胞活性的影响,分析3种细胞染氟时间不同细胞活性的变化情况,进而为研究氟骨症中的骨代谢提供重要依据。
1 材料和方法
1.1 3种细胞的来源及诱导培养
1.1.1小鼠骨髓间充质干细胞系(bone marrow mesenchymal stemcells,BMSCs)分离和培养:6~8周龄的ICR小鼠购自吉林大学动物实验中心。将小鼠麻醉、脱颈处死后投入装有75%乙醇的烧杯内消毒1~3 min。无菌条件下取出股骨和胫骨,去除骨膜及周围组织,用无菌PBS反复冲洗骨髓腔,直到骨髓腔发白为止,收集冲洗下的细胞悬液1 200 r/min,离心5 min。将沉淀的细胞重悬,种于培养瓶中,置于37 ℃、5% CO2及饱和湿度条件的恒温培养箱内培养,48 h后更换培养液,漂洗去除未贴壁细胞。将细胞传至第3代,经流式细胞仪鉴定细胞表面抗原CD34和CD44表达阳性的细胞数占94.6%,确认培养的细胞为BMSCs。BMSCs用10 mmol/L β-甘油磷酸钠、50 mg/L维生素C、40 ng/mL地塞米松进行矿化诱导,使其成为成骨细胞。而成骨细胞需要经过4 d后才能进入分化状态,所以待细胞长至对数期以2×104个/mL的密度接种于3个96孔板,待细胞均贴壁后,按照空白对照、低氟浓度(0.1、0.5、1、2 mg/L)、中氟浓度(4、8 mg/L)、高氟浓度(16、32 mg/L)8个浓度染氟,在细胞培养1、2、4 d后在570 nm波长下使用赛默飞世尔Multiskan FC酶标仪检测。
1.1.2小鼠单核巨噬细胞系RAW264.7:RAW264.7细胞株购自中国医学科学院细胞库。将RAW264.7细胞接种于含5%胎牛血清及1%双抗的α-MEM培养液中,待细胞长至对数期以2×104个/mL的密度接种于3个96孔板,待细胞均贴壁后用25 ng/mL RANKL诱导3~5 d使其成为破骨细胞。分别加入不同浓度F-浓度(与上同),置于37 ℃、5% CO2及饱和湿度条件的恒温培养箱内培养。在细胞培养1、2、4 d后在570 nm波长使用赛默飞世尔Multiskan FC酶标仪检测。
1.1.3骨细胞系IDG-SW3:IDG-SW3细胞由Indiana大学医学院的Lynda F.Bonewald教授赠与。将IDG-SW3细胞接种在铺有胶原基质的培养瓶里,并在含有4 mmol/L β-甘油磷酸钠、50 μg/mL维生素C的α-MEM培养液中进行矿化诱导,使其表达骨细胞标志硬化蛋白后,确认成为骨细胞。骨细胞作为成骨细胞的终末成熟细胞,在1~4 d观察该种细胞的代谢改变。将细胞以2×104个/mL的密度接种于3个96孔板,待细胞均贴壁后,按实验分组分别加入F-至终氟浓度(与上同),置于37 ℃、5% CO2及饱和湿度条件的恒温培养箱内培养。在细胞培养1、2、4 d后在570 nm波长下使用赛默飞世尔Multiskan FC酶标仪检测。
1.2 试剂与仪器
α-MEM、DMEM、PBS(Hyclone公司,美国),胎牛血清(天杭生物科技股份有限公司,中国),β-甘油磷酸钠、维生素C、Collagen Type I Rat Tail、MTT、氟化钠(Sigma-Aldrich,美国),二甲基亚砜DMSO(北京鼎国昌盛生物技术有限责任公司,中国),酶标仪(赛默飞世尔上海仪器有限公司,型号 Multiskan FC)。
1.3 MTT法检测不同氟浓度对3种不同的细胞活性
细胞培养结束后,PBS洗3次去除细胞分化诱导液,待测孔每孔加入180 μL的DMEM和20 μL的 5 mg/mL的MTT溶液,37 ℃孵育4 h后小心吸出培养上清液,每孔加入150 μL DMSO,低速振荡10 min,使用酶标仪测定各孔吸光度值,重复3次检测。
1.4 统计学处理

2 结果
如表1所示,3种细胞给予不同氟化物浓度处理1 d后,与对照组相比,高氟浓度对3种细胞均有抑制作用,其中32 mg/L组较16 mg/L组抑制作用更为显著。当3种细胞暴露于32 mg/L时,与对照组相比,骨细胞活性下降了22.6%,而破骨细胞和成骨细胞活性分别下降了94.1%和94.6%,呈现出明显的抑制作用。由此可以看出,高氟浓度16 mg/L、32 mg/L对3种细胞有显著的毒性抑制作用。
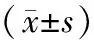
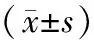
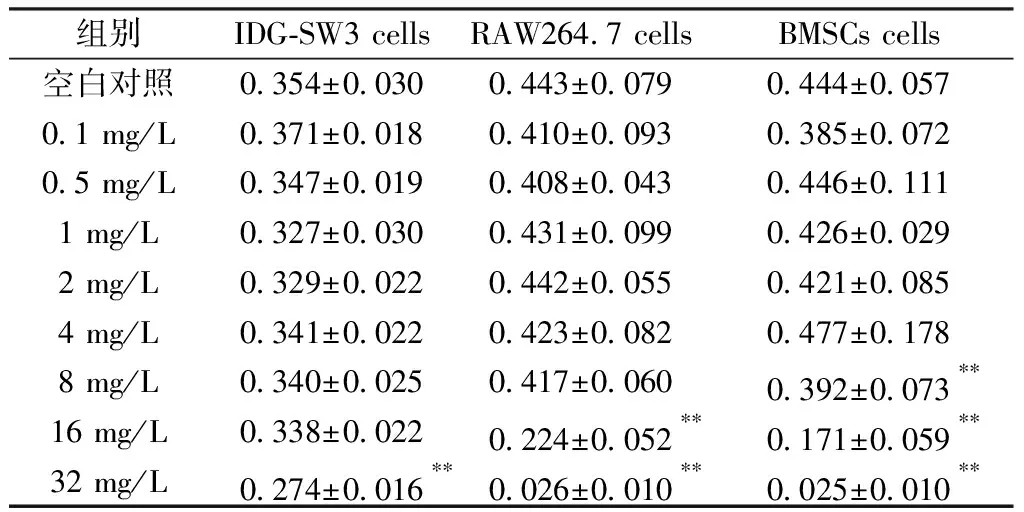
组别 IDG-SW3 cellsRAW264.7 cellsBMSCs cells空白对照0.354±0.0300.443±0.0790.444±0.0570.1 mg/L0.371±0.0180.410±0.0930.385±0.0720.5 mg/L0.347±0.0190.408±0.0430.446±0.1111 mg/L0.327±0.0300.431±0.0990.426±0.0292 mg/L0.329±0.0220.442±0.0550.421±0.0854 mg/L0.341±0.0220.423±0.0820.477±0.1788 mg/L0.340±0.0250.417±0.0600.392±0.073∗∗16 mg/L0.338±0.0220.224±0.052∗∗0.171±0.059∗∗32 mg/L0.274±0.016∗∗0.026±0.010∗∗0.025±0.010∗∗
注:与对照组相比较,**P<0.01。
随着投氟时间增加到2 d,如表2所示,低氟浓度提高骨细胞活性,尤其是0.5 mg/L和1 mg/L促进作用明显。与对照组相比,细胞活性均增加了8%。中氟浓度8 mg/L抑制破骨细胞和成骨细胞的活性,细胞活性分别下降了26.7%和29.7%。而高氟浓度16 mg/L和32 mg/L对破骨细胞和成骨细胞活性的抑制作用更加明显,就16 mg/L而言,两种细胞活性均下降了91.7%,而骨细胞活性则下降了5.3%。结果说明骨细胞对高剂量的氟耐受力明显比破骨细胞和成骨细胞强。
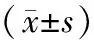
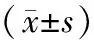

组别IDG-SW3 cellsRAW264.7 cellsBMSCs cells空白对照0.547±0.0380.833±0.0950.496±0.0590.1 mg/L0.579±0.0250.832±0.1100.490±0.0400.5 mg/L0.591±0.037∗0.776±0.1170.531±0.0621 mg/L0.591±0.039∗0.801±0.1000.502±0.0972 mg/L0.528±0.0340.772±0.0680.492±0.0834 mg/L0.539±0.0380.756±0.0780.462±0.0768 mg/L0.560±0.0210.611±0.111∗∗0.299±0.073∗∗16 mg/L0.518±0.0250.069±0.020∗∗0.041±0.022∗∗32 mg/L0.240±0.030∗∗0.017±0.002∗∗0.011±0.003∗∗
注:与对照组相比较,*P<0.05,**P<0.01。
投氟时间增加到4 d时,如表3所示,低氟浓度对骨细胞和破骨细胞活性促进作用较明显,当这两种细胞暴露于0.1 mg/L时,与对照组相比,骨细胞活性增加了8.8%,破骨细胞活性增加了16%。骨细胞的活性在0.1~2 mg/L氟处理下显著增高,1~4 mg/L氟处理下的破骨细胞的活性也明显比对照组高。然而,成骨细胞只有在0.1 mg/L和0.5 mg/L作用下细胞活性轻度提高了,随着氟浓度增加成骨细胞活性也随之下降。当3种细胞暴露于16 mg/L 4 d后,与对照组相比,骨细胞活性下降了8.6%,而破骨细胞和成骨细胞活性则分别下降了90.8%和97.2%。3种细胞染氟4 d的活性充分显示了低剂量氟对破骨细胞和骨细胞的刺激作用,而高剂量氟对破骨细胞和成骨细胞的显著抑制作用。
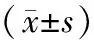
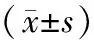

组别IDG-SW3 cellsRAW264.7 cellsBMSCs cells空白对照0.697±0.0450.655±0.1220.643±0.0810.1 mg/L0.758±0.036∗0.760±0.1420.693±0.0840.5 mg/L0.740±0.029∗0.662±0.1030.653±0.0811 mg/L0.700±0.0460.845±0.085∗0.552±0.0922 mg/L0.630±0.048∗0.796±0.117∗0.592±0.0734 mg/L0.649±0.0630.807±0.121∗0.591±0.1008 mg/L0.700±0.0350.611±0.0430.295±0.124∗∗16 mg/L0.637±0.054∗0.060±0.009∗∗0.018±0.005∗∗32 mg/L0.085±0.036∗∗0.007±0.003∗∗0.012±0.005∗∗
注:与对照组相比较,*P<0.05,**P<0.01。
3 讨论
氟骨症是指长期摄入过量氟化物引起氟中毒的一种慢性侵袭的全身性骨病。在氟骨症发病过程中成骨细胞和破骨细胞表现出不同程度的活跃[8],成骨细胞活性增强/破骨细胞活性减弱可能是骨硬化发生的原因。方瑶瑶等[9]发现BMSCs向成骨细胞分化,可以增强成骨细胞活性,有利于骨形成。在本实验中,低浓度增强了成骨细胞的活性,成骨细胞在0.1 mg/L浓度下暴露4 d后,细胞活性提高了7.8%,提示了长期小剂量的氟可以刺激成骨细胞活性[10]。高氟浓度降低了BMSCs诱导的成骨细胞活性和破骨细胞活性,从而证明了大剂量的氟能够导致骨质疏松或骨硬化[10]。通过成骨细胞和破骨细胞活性可以预测骨丢失情况,本研究旨在分析3种细胞染氟后的活性变化,实验结果表明,氟化物对所有类型的细胞都有负面影响,但破骨细胞对低剂量和高剂量氟化物作用敏感。
近年来,越来越多的研究人员报告了氟化物对成骨细胞和破骨细胞的活性影响[3],进而研究两种细胞在骨代谢过程中的作用,但骨细胞在氟中毒中的作用研究较少。本研究采用IDG-SW3细胞经矿化诱导使其分化为骨细胞,采用MTT法分析骨细胞的活性。研究数据表明,低剂量的氟提高骨细胞活性,氟暴露于0.5 mg/L浓度下2 d和4 d后细胞活性均有显著性。中剂量中8 mg/L氟化物处理仅提高了骨细胞的活性,对成骨细胞和破骨细胞活性表现出抑制作用,高剂量中16 mg/L的氟化物使骨细胞活性下降了不到10%,但几乎抑制了90%以上的破骨细胞和成骨细胞,这表明骨细胞不仅可以对低量氟刺激作用敏感,而且累积氟毒性具有很强的耐受性。
综上所述,本研究通过骨组织中3种主要类型细胞染氟实验研究,验证了氟化物对3种细胞活性的双重作用,即低氟浓度对破骨细胞和骨细胞的促进作用,高浓度氟对破骨细胞和成骨细胞的抑制作用。综合3种细胞活性来看,氟对成骨细胞的刺激作用范围最窄,而抑制作用显著,破骨细胞对氟剂量的变化最敏感,而骨细胞对氟化物蓄积毒性的耐受性最强。本实验结果为进一步研究慢性氟骨症骨病变提供了重要线索和依据。
