HOTAIR上调miR-152靶向调控HLA-G的生物信息作用预测与验证
2019-11-06李晓娟周芝熠王珏钱源
李晓娟 ,周芝熠 ,王珏,钱源 ,3,4△
子痫前期(preeclampsia,PE)是严重威胁母儿健康的妊娠相关疾病,目前全世界发病率为3%~17%[1]。子痫前期病理学机制尚未完全阐明,研究表明子痫前期患者胎盘及外周血中人类白细胞抗原-G(human leucocyte antigen-G,HLA-G)的表达水平低于正常孕妇[2]。HLA-G属于非经典HLA-Ⅰ分子,主要表达于母胎界面绒毛外滋养层细胞,是重要的免疫耐受分子。HLA-G通过多种机制维持正常妊娠,如抑制妊娠期子宫蜕膜内自然杀伤(natural killer,NK)细胞和细胞毒性 T淋巴(cytotoxic T-lymphocyet,CTL)细胞的细胞毒性发挥免疫抑制作用[3]。
HOX转录反义RNA(HOX transcript antisense RNA,HOTAIR)是一种典型的反义长链非编码RNA(long non-coding RNA,lncRNA),也是第一个被发现的具有反式转录调控作用的长链非编码RNA。目前研究发现HOTAIR可作为内源竞争性RNA(ceRNA)与某些靶miRNA竞争性结合,从而解除miRNA对靶信使RNA(mRNA)的抑制作用,进而发挥特 定 的生 物 学功能[4-5]。Song 等[6]研究认 为HOTAIR作为miR-152的ceRNA发挥生物学功能,诱导HLA-G表达增加,参与胃癌的逃逸过程。同时Zhu等[7]研究表明miR-152-3p通过靶向3'-非翻译区(UTR)的结合位点抑制HLA-G的表达,并且miR-152-3p可能通过上调NK细胞介导的人绒毛膜癌细胞JEG-3细胞溶解,发挥免疫增强剂的作用。这些研究提示HOTAIR可作为miR-152-3p的ceRNA调控HLA-G的表达。
人类白细胞抗原HLA-G在胎盘中的低表达被认为与子痫前期的发病相关,但其异常表达的机制尚未完全阐明。为进一步研究HOTAIR、miRNA-152-3p及HLA-G与子痫前期发病机制的关系,我们通过双荧光素酶实验验证三者在HTR-8/SVneo细胞中靶向调控的关系,为进一步研究具体的下游调控机制提供理论依据,从而发现子痫前期潜在的诊断、治疗靶点。
1 材料与方法
1.1实验材料 HTR-8/SVneo细胞购自BioVector质粒载体菌种细胞基因保藏中心。RPMI-1640培养基(美国Gibco公司),胎牛血清(FBS,以色列BI公司),HOTAIR、HLA-G的目标序列和突变序列、miR-152-3p mimics及mimics-NC(上海吉玛公司),限制性内切酶SacⅠ、XhoⅠ(美国Fermentas公司),DNA凝胶回收试剂盒,质粒小提试剂盒(北京天根生化有限公司),中量抽提试剂盒(杭州爱思进生物技术有限公司),LipofectamineTM2000(美国Invitrogen),双荧光素酶报告基因检测系统试剂盒(美国Promega公司)。
1.2方法
1.2.1生物信息学预测 采用DIANA在线预测网站diana.imis.athena-innovation.gr/DianaTools/及PITA软件对miR-152-3p与HOTAIR和HLA-G的3'-UTR区域结合位点进行分析,预测miR-152-3p与HOTAIR及HLA-G的潜在结合位点。
1.2.2双荧光素酶报告载体构建 根据靶基因与miR-152-3p结合的序列,设计野生型及突变型PCR扩增引物序列,见表1。化学合成以上序列,合成时在序列两端加上SacⅠ和XhoⅠ酶切位点,用退火的方法得到目的序列双链模板。为将目的序列片段克隆到GP-miRGLO载体中,先采用SacⅠ和XhoⅠ对GP-miRGLO载体进行酶切,酶切产物经1%琼脂糖凝胶电泳,用DNA凝胶回收试剂盒回收双酶切后的载体条带,然后采用T4 DNA连接酶连接目的片段与双酶切后的GP-miRGLO载体。将连接产物转化入感受态细胞,并将培育后的细胞接种于含50 mg/L氨苄青霉素的LB平板上,置37℃培养箱培养16 h。筛选阳性克隆,质粒小提试剂盒抽提质粒。重组质粒送上海吉玛公司测序,测序结果与目的基因序列比对后,筛选出构建成功的目的基因表达质粒,并对筛选出的阳性克隆进行超纯去内毒素抽提,得到足够量的重组质粒。

Tab.1 The primers for HOTAIR wild-type,mutant and HLA-G wild-type,mutant表1 HOTAIR野生型、突变型及HLA-G野生型、突变型引物序列
1.2.3细胞培养及转染 人工合成miR-152-3p mimics及mimics NC序列,见表2,以LipofectamineTM2000为转染试剂。转染前1 d收取处于对数生长期的HTR-8/SVneo,按5×105细胞/孔接种于12孔板,使转染时的细胞融合度能够达到70%~80%。共设置8个组:HOTAIR野生型+mimics NC、HOTAIR野生型+miR-152-3p、HOTAIR突变型+mimics NC、HOTAIR突变型+miR-152-3p、HLA-G野生型+mimics NC、HLA-G野生型+miR-152-3p、HLA-G突变型+mimics NC、HLA-G突变型+miR-152-3p,每组3个平行孔。按照LipofectamineTM2000试剂盒说明书进行转染,转染后摇匀,置于37℃、5%CO2培养箱温育5 h后,将孔里的培养液移去,更换为含10%FBS的培养基,24 h后收取细胞。

Tab.2 The sequences of miR-152-3p mimics and mimics NC表2 miR-152-3p mimics及mimics NC序列
1.2.4荧光素酶活性测定 转染24 h后弃培养基,加入细胞裂解液裂解细胞,取每孔100µL细胞裂解液加入10µL的LARⅡ试剂,酶标仪上检测萤火虫荧光素酶活性。取出测试板,加入10µL Stop&Glo试剂,酶标仪检测海肾荧光素酶活性。以海肾荧光素酶为内参,将每个样品萤火虫荧光素酶活性进行均一化处理,比较相对荧光素酶活性。
1.3统计学方法 采用SPSS 17.0进行统计学分析,计量数据以均数±标准差(±s)表示,2组间比较采用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1结合位点预测 预测结果显示miR-152-3p与HOTAIR有3个潜在结合位点,miR-152-3p与HLAG的3'-UTR区域有1个潜在结合位点,见图1。

Fig.1 Potential binding sites of miR-152-3p to HOTAIR and HLA-G 3'-UTR图1 miR-152-3p与HOTAIR和HLA-G的3'-UTR区域潜在结合位点
2.2测序及序列对比分析 含有与miR-152-3p结合位点及缺失结合位点的荧光素酶报告载体HOTAIR野生型、HOTAIR突变型、HLA-G野生型、HLA-G突变型测序结果见图2~5。对比结果表明,目标序列和突变序列均成功地克隆入双萤光报告载体GP-miRGLO,可以用于后续萤光素酶检测实验。2个克隆测序方向为标准序列的互补链,与SNP数据库结果互补。
2.3双荧光素酶活性分析 HOTAIR野生型+miR-152-3p组相对荧光素酶活性(0.308±0.013)与HOTAIR野生型+mimics NC组(1.002±0.051)相比较,差异有统计学意义(n=3,t=22.531,P<0.001),HOTAIR野生型+miR-152-3p组荧光素酶活性受到明显的抑制。HOTAIR突变型+miR-152-3p组(1.004±0.061)与 HOTAIR突变型+mimics NC组(1.003±0.022)相比差异无显著变化(n=3,t=0.119,P=0.911),见图6。HLA-G野生型+miR-152-3p组相对荧光素酶活性(0.621±0.033)与HLA-G野生型+mimics NC组(1.003±0.040)相比较差异有统计学意义(n=3,t=12.596,P<0.001),HLA-G野生型+miR-152-3p组荧光素酶活性受到明显的抑制。HLA-G突变型+miR-152-3p组(1.050±0.039)与HLA-G突变型+mimics NC组(1.002±0.042)相比差异无显著变化(n=3,t=1.521,P=0.203),见图7。
3 讨论
3.1HLA-G低表达促进子痫前期发生 子痫前期发病机制尚未阐明,HLA-G低表达增加母体对半抗原胎儿的免疫不耐受与子痫前期的发生密切相关[8]。HLA-G作为非经典主要组织相容性复合体(MHC)Ⅰ类抗原,可通过调节细胞因子的释放诱导免疫耐受,调控滋养层细胞的侵入能力,促使子宫螺旋动脉重塑,维持正常妊娠[9]。HLA-G还可抑制NK细胞和T淋巴细胞的细胞毒作用,减弱母体对胎儿的免疫不耐受[10]。同时HLA-G能够以抗原呈递的身份参与免疫识别,诱导母胎界面的免疫耐受[11]。HLA-G低表达与子痫前期的发生密切相关。
Fig.2 Map for partial sequences of the wild type HOTAIR图2 HOTAIR野生型部分测序结果
Fig.3 Map for partial sequences of the mutant type HOTAIR图3 HOTAIR突变型部分测序结果

Fig.4 Map for partial sequences of the wild type HLA-G图4 HLA-G野生型部分测序结果
Fig.5 Map for partial sequences of the mutant type HLA-G图5 HLA-G突变型部分测序结果

Fig.6 Expression of relative luciferase activity of HOTAIR group图6 HOTAIR组荧光素酶活性相对表达量
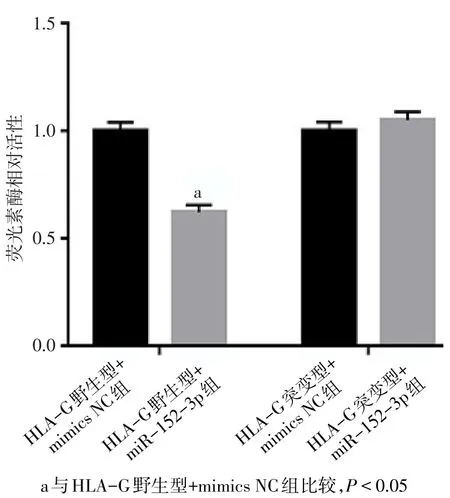
Fig.7 Expression of relative luciferase activity of HLA-G group图7 HLA-G组荧光素酶活性相对表达量
3.2microRNA可调控HLA-G的表达 Sun等[12]通过生物信息学分析和荧光素酶分析,对HOTAIR作为ceRNA的作用机制进行了探讨,采用过表达和RNA干扰方法对宫颈癌细胞HeLa、ME-180、SiHa和CasKi进行研究,结果表明HOTAIR通过竞争性结合miR-148a调节HLA-G的表达进而参与宫颈癌的发生。Luo等[13]研究发现,miR-148a在HTR-8/SVneo细胞中通过抑制DNA甲基转移酶1(DNMT1)的水平调节HLA-G的表达而参与子痫前期的发生机制。以上研究表明microRNA可通过多种机制调控HLAG的表达。
3.3HOTAIR对miR-152-3p负向调控作用 研究表明,在癌症患者中HOTAIR与miR-152-3p表达之间呈负相关关系,且HOTAIR对miR-152-3p表达有潜在负调控作用[14]。Luan等[15]在人黑色素瘤细胞系A375、A875中证实HOTAIR作为miR-152-3p的ceRNA,通过激活PI3k/Akt/mTOR信号通路调控肝细胞生长因子受体c-MET的表达,促进恶性黑色素瘤的进展。这些研究表明HOTAIR与miR-152-3p之间存在靶向关系。
3.4HOTAIR通过miR-152-3p调控HLA-G的表达 Song等[6]研究证实在胃癌细胞系SGC7901和MGC-803中,HOTAIR通过抑制miR-152的表达上调HLA-G参与胃癌的免疫逃逸。但HOTAIR、miR-152-3p、HLA-G是否参与子痫前期发病机制尚鲜见报道。本研究通过生物信息学分析发现miR-152-3p在HOTAIR转录本中存在3个潜在的结合域,通过荧光素酶报告系统在HTR-8/SVneo细胞中进行验证,预测miR-152-3p对HOTAIR及HLA-G存在作用靶点。提示在滋养细胞中HOTAIR、miR-152-3p、HLA-G之间存在相互调控的可能性,但三者在子痫前期患者中是否存在相互关系未进行验证,具体下游调控机制有待进一步研究。
