鬼针草总黄酮通过ERK1/2/NF-κB通路减轻局灶性脑缺血大鼠认知功能障碍
2019-11-06李丽丽焦富英
李丽丽,焦富英
脑卒中是脑部血管突然破裂或因血管阻塞导致血液不能流入大脑而引起的脑组织损伤,包括出血性和缺血性脑卒中。其中缺血性脑卒中占脑卒中患者的60%~80%,也是造成中老年人致残和致死的主要疾病[1]。认知功能障碍是脑卒中患者临床最常见的功能障碍之一,严重影响患者生活质量,我国脑卒中患者发病3个月内发生认知障碍的概率高达60%[2]。炎症因子表达异常在缺血性脑卒中患者认知功能障碍发展过程中有重要作用[3],细胞外信号调节蛋白激酶(extracellular signal-regulated protein kinase,ERK)1/2/核 转 录 因 子 - κB(nuclear transcription factors,NF-κB)通路是炎症反应中的重要信号通路。ERK1/2激活后可活化NF-κB,促使其转移入核,进而调控下游肿瘤坏死因子(TNF)-α、白细胞介素(IL)-6等炎症因子的表达,参与炎症反应[4]。Li等[5]研究发现可乐定预处理可通过ERK1/2-CREB/NF-κB-NR2B途径改善大鼠脑缺血诱导的学习记忆功能障碍。鬼针草总黄酮(total flavones of bidens bipinnata L.,TFB)是鬼针草的主要生物活性成分。研究表明,TFB可减轻脑出血大鼠脑水肿和细胞膜脂质过氧化,改善血肿周围组织微循环状态,保护脑损伤[6]。TFB可抑制NF-κB表达,进而抑制TNF-α、IL-6、IL-10等炎性因子的表达,提高抗氧化能力,减轻高氧所导致的大鼠肺损伤[7]。TFB能否改善脑缺血患者的认知功能及可能的机制少见报道。本研究通过线栓法建立局灶性脑缺血大鼠模型,基于ERK1/2/NF-κB信号通路,探讨TFB对脑缺血大鼠认知功能的影响及可能机制。
1 材料与方法
1.1实验动物 8周龄健康雄性SD大鼠72只,清洁级,体质量160~230 g,购自上海斯莱克实验动物有限责任公司,动物合格证号:SCXK(沪)2017-0006。大鼠自由饮水和饮食,在温度20~25℃、湿度50%~56%、光照12 h的环境空间中饲养。
1.2试剂 TFB购自合肥七星科技有限公司,总黄酮含量大于75%(批号:20180125)。脑源性神经营养因子(brain derived neurotrophic factor,BDNF,批号:20180125)和神经生长因子(nerve growth factor,NGF,批号:20180214)试剂盒购自武汉博士德生物工程有限公司;IL-1β(批号:20180215)、IL-6(批号:20180127)和TNF-α(批号:20180123)酶联免疫吸附法(ELISA)检测试剂盒购自南京建成生物工程研究所;兔抗小鼠ERK1/2(货号:sc-94)、p-ERK1/2(货号:sc-7385)抗体购自美国Santa Cruz公司;兔抗小鼠NF-κB p65(货号:6958)、p-NF-κB p65(货号:6961)、β-actin兔抗大鼠(货号:3700s)一抗、辣根过氧化物酶标记(HRP)的羊抗兔IgG二抗(货号:C1309)购自美国Cell Signaling公司。
1.3实验方法
1.3.1分组和给药 大鼠适应性饲养1周后,采用随机数字表法分为假手术组、模型组、阳性对照组、低剂量TFB组、中剂量TFB组、高剂量TFB组,每组12只。手术前,低、中、高剂量TFB组分别灌胃25、50、100 mg/kg的TFB[6];阳性对照组灌胃1 mg/kg[8]的尼莫地平;假手术组和模型组灌胃等量的生理盐水,每天1次,连续治疗7 d。手术后,继续治疗21 d。
1.3.2局灶性脑缺血大鼠模型建立 参照文献[9]方法采用改良的线栓法建立局灶性脑缺血大鼠模型。大鼠腹腔注射10%水合甲醛,麻醉后,将大鼠仰卧式固定,从颈正中切口,暴露出颈总动脉(CCA)、右侧颈内动脉(ICA)和颈外动脉(ECA)。从CCA分叉处结扎ECA,夹闭CCA近心端和远心端,在其近分叉处剪口,将线栓向ICA插入,直至大脑中动脉起始处,用来阻塞其开口。之后,收紧剪口处细线,松开CCA近心端动脉夹,逐层缝合。假手术组除不插入线栓外,其他操作相同。
1.3.3Morris水迷宫实验 参照文献[10]方法采用Morris水迷宫实验检测各组大鼠的学习和记忆功能。Morris水迷宫实验由定位航行实验和空间探索实验2部分组成。实验开始前一天,将大鼠放入水中自由游泳2 min,熟悉环境。定位航行实验:第1~5天观察和记录大鼠分别从4个象限入水后找到平台的潜伏期。空间探索实验:第6天撤去平台,同一入水点将大鼠面向池壁放入水中,记录120 s穿越平台的次数。
1.3.4标本采集和指标检测 Morris水迷宫实验结束后第2天,从每组大鼠中采用简单随机抽样法取6只,腹腔注射10%水合甲醛,麻醉后采用50 mL生理盐水灌流冲净体内血液,4%多聚甲醛100 mL灌注固定,开颅取脑,待充分固定后取出海马组织,4%中性甲醛固定7 h。常规梯度乙醇脱水、石蜡包埋,制作组织切片。切片行尼氏染色,观察大鼠海马组织病理结构变化。其余大鼠取出海马组织-80℃保存备用。取适量海马组织制成10%匀浆,ELISA检测BDNF、NGF、IL-1β、IL-6和TNF-α含量。具体操作过程严格按照试剂盒说明书进行。
1.3.5Western blot检测蛋白表达 待上述实验完成后,取适量海马组织,加入RIPA裂解液于冰上充分裂解后离心(4℃、12 000 r/min,10 min)。取离心后的上清液,采用BCA法定量蛋白。蛋白溶液加入上样缓冲液,95℃煮沸5 min,离心取上清液行SDS-PAGE电泳。电泳结束后,转至PVDF膜,5%脱脂牛奶37℃封闭2 h。TBST洗膜后加入稀释好的一抗:ERK1/2抗体、p-ERK1/2抗体、NF-κB p65抗体、p-NF-κB p65抗体,以β-actin作为内参,4℃孵育过夜。TBST洗膜后,加入二抗,37℃孵育2 h。TBST洗膜,加入ECL发光液,避光显影,曝光拍照。Image J图像软件分析各蛋白条带灰度值,以目的蛋白与相应的β-actin蛋白条带灰度值的比值作为目的蛋白相对表达水平。
1.4统计学方法 采用SPSS 22.0软件对数据进行统计分析。计量资料以±s表示,多组间均数比较采用单因素方差分析,组间多重比较采用LSD-t法。P<0.05为差异有统计学意义。
2 结果
2.1Morris水迷宫实验结果 随着训练时间的增加,各组大鼠逃避潜伏期逐渐缩短。在相同时间内,与假手术组相比,模型组大鼠逃避潜伏期显著延长(P<0.05),穿越平台次数显著减少(P<0.05)。从第2天起,与模型组比,阳性对照组和高剂量TFB组大鼠逃避潜伏期显著缩短(P<0.05),穿越平台次数显著增加(P<0.05)。与阳性对照组相比,高剂量TFB组大鼠平均逃避潜伏期和穿越平台次数差异无统计学意义,见表1。
2.2海马组织尼氏染色 假手术组大鼠海马组织神经细胞呈圆形,染色均匀,细胞排列整齐。模型组细胞排列紊乱,细胞核固缩,染色较深。不同剂量TFB干预后,海马组织细胞形态、排列得到不同程度改善。高剂量TFB组海马组织与假手术组较为接近,见图1。
Tab.1 Results of Morris water maze experiment表1 Morris水迷宫实验结果 (n=12,±s)
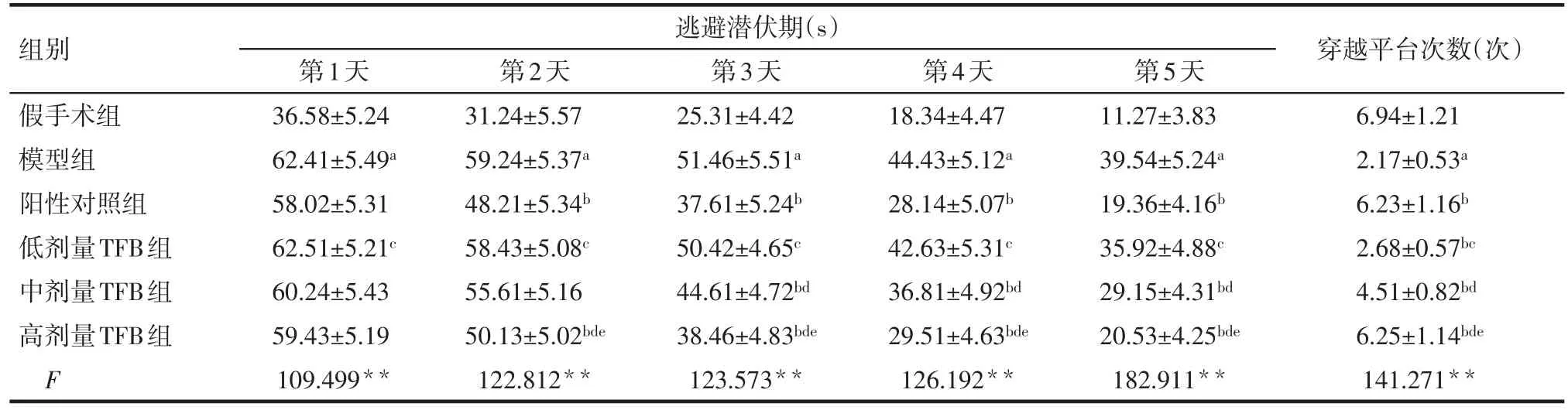
Tab.1 Results of Morris water maze experiment表1 Morris水迷宫实验结果 (n=12,±s)
*P<0.05,**P<0.01;a与假手术组比较,b与模型组比较,c与阳性对照组比较,d与低剂量TFB组比较,e与中剂量TFB组比较,P<0.05;表2~4同
组别假手术组模型组阳性对照组低剂量TFB组中剂量TFB组高剂量TFB组F逃避潜伏期(s)第1天36.58±5.24 62.41±5.49a 58.02±5.31 62.51±5.21c 60.24±5.43 59.43±5.19 109.499**第2天31.24±5.57 59.24±5.37a 48.21±5.34b 58.43±5.08c 55.61±5.16 50.13±5.02bde 122.812**第3天25.31±4.42 51.46±5.51a 37.61±5.24b 50.42±4.65c 44.61±4.72bd 38.46±4.83bde 123.573**第4天18.34±4.47 44.43±5.12a 28.14±5.07b 42.63±5.31c 36.81±4.92bd 29.51±4.63bde 126.192**第5天11.27±3.83 39.54±5.24a 19.36±4.16b 35.92±4.88c 29.15±4.31bd 20.53±4.25bde 182.911**穿越平台次数(次)6.94±1.21 2.17±0.53a 6.23±1.16b 2.68±0.57bc 4.51±0.82bd 6.25±1.14bde 141.271**
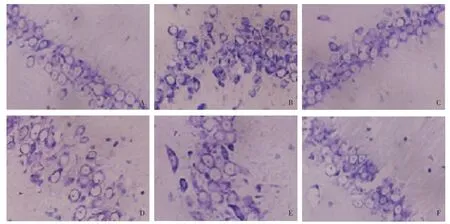
Fig.1 Nissl staining of hippocampal tissues(×400)图1 海马组织尼氏染色(×400)
2.3大鼠海马组织BDNF和NGF含量比较 与假手术组相比,模型组大鼠海马组织BDNF和NGF含量均显著降低(P<0.05)。与模型组相比,中、高剂量TFB组和阳性对照组大鼠海马组织BDNF和NGF含量均显著升高(P<0.05)。高剂量TFB组和阳性对照组比较差异无统计学意义,见表2。
Tab.2 Comparison of BDNF and NGF contents in hippocampus between six groups表2 各组海马组织BDNF和NGF含量比较(µg/L,n=6,±s)

Tab.2 Comparison of BDNF and NGF contents in hippocampus between six groups表2 各组海马组织BDNF和NGF含量比较(µg/L,n=6,±s)
组别假手术组模型组阳性对照组低剂量TFB组中剂量TFB组高剂量TFB组F BDNF 0.62±0.13 0.21±0.04a 0.55±0.12b 0.24±0.03c 0.37±0.06bcd 0.53±0.09bde 64.404**NGF 0.31±0.06 0.08±0.01a 0.27±0.03b 0.09±0.02c 0.18±0.03bcd 0.23±0.04bde 117.568**
2.4海马组织IL-1β、IL-6和TNF-α含量比较 与假手术组比,模型组大鼠海马组织IL-1β、IL-6和TNF-α含量均明显升高(P<0.05)。与模型组比,低、中、高剂量TFB组和阳性对照组大鼠海马组织IL-1β、IL-6和TNF-α含量均明显降低,TFB具有剂量依赖性(P<0.05)。高剂量TFB组和阳性对照组比较无统计学意义,见表3。
Tab.3 Comparison of IL-1β,IL-6 and TNF-α in hippocampus between six groups表3 海马组织IL-1β、IL-6和TNF-α含量比较(µg/L,n=6,±s)
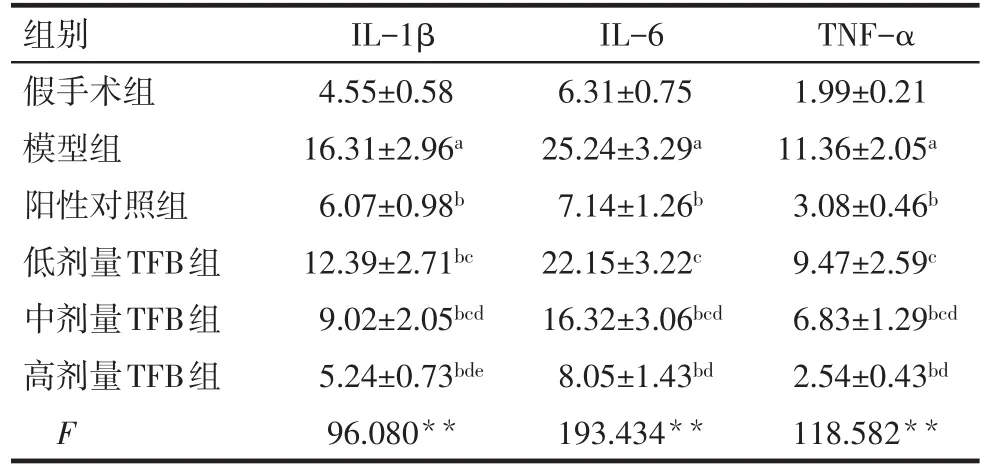
Tab.3 Comparison of IL-1β,IL-6 and TNF-α in hippocampus between six groups表3 海马组织IL-1β、IL-6和TNF-α含量比较(µg/L,n=6,±s)
组别假手术组模型组阳性对照组低剂量TFB组中剂量TFB组高剂量TFB组F IL-1β 4.55±0.58 16.31±2.96a 6.07±0.98b 12.39±2.71bc 9.02±2.05bcd 5.24±0.73bde 96.080**IL-6 6.31±0.75 25.24±3.29a 7.14±1.26b 22.15±3.22c 16.32±3.06bcd 8.05±1.43bd 193.434**TNF-α 1.99±0.21 11.36±2.05a 3.08±0.46b 9.47±2.59c 6.83±1.29bcd 2.54±0.43bd 118.582**
2.5ERK1/2/NF-κB通路相关蛋白表达 各组大鼠海马组织ERK1/2、NF-κB p65蛋白表达水平差异无统计学意义;与假手术组比,模型组大鼠海马组织p-ERK1/2和p-NF-κB p65蛋白表达水平均明显升高(P<0.05)。与模型组比,中、高剂量TFB组和阳性对照组大鼠海马组织p-ERK1/2和p-NF-κB p65蛋白表达水平均显著降低,具有剂量依赖性(P<0.05)。高剂量TFB组和阳性对照组比较差异无统计学意义,见图2、表4。

Fig.2 ERK1/2/NF-κB pathway-related protein expression图2 ERK1/2/NF-κB通路相关蛋白表达
Tab.4 Expressions of ERK1/2/NF-κB pathway relatedproteins in six groups表4 ERK1/2/NF-κB通路相关蛋白表达 (n=6,±s)

Tab.4 Expressions of ERK1/2/NF-κB pathway relatedproteins in six groups表4 ERK1/2/NF-κB通路相关蛋白表达 (n=6,±s)
组别假手术组模型组阳性对照组低剂量TFB组中剂量TFB组高剂量TFB组F ERK1/2 0.65±0.21 0.86±0.25 0.67±0.18 0.74±0.16 0.71±0.21 0.68±0.17 0.881 p-ERK1/2 0.23±0.04 0.96±0.15a 0.31±0.06b 0.74±0.12c 0.49±0.08bcd 0.33±0.05bde 157.856**NF-κB p65 0.72±0.21 0.85±0.18 0.73±0.22 0.82±0.19 0.79±0.16 0.75±0.18 0.445 p-NF-κB p65 0.17±0.03 0.84±0.19a 0.19±0.04b 0.78±0.16c 0.51±0.10bcd 0.20±0.05bde 122.126**
3 讨论
海马是调控人类学习、记忆和情感等认知功能的重要脑区,Morris水迷宫实验是常用的测定大鼠学习和记忆能力的方法之一,潜伏期长短和穿越平台次数可反映大鼠的学习和记忆能力。BDNF是一种可促进神经元生长活性的蛋白质,主要分布于神经系统,以海马和皮质含量最高。BDNF对维持神经元功能、防治神经元退行性病变、神经元损伤后再修复等过程发挥重要作用,除此之外,其还参与大脑的学习和记忆过程[11]。因此,大鼠海马组织BDNF水平降低也可在一定程度上反映其认知功能受损程度。NGF是一种神经生长因子,能有效拮抗神经细胞的凋亡,促进胆碱能神经元的功能,诱导轴突末端生长,保护基底前脑胆碱能神经元受损导致的神经变性,改善空间学习记忆能力[12]。研究表明,海马齿状回中BDNF和NGF表达水平与学习记忆关系密切,成年大鼠认知功能降低与海马组织BDNF和NGF表达水平降低有关[13]。本研究结果显示,模型大鼠平均潜伏期较假手术组显著升高,穿越平台次数减少,海马组织细胞排列紊乱,细胞核固缩,BDNF和NGF表达水平降低,说明模型建立成功,局灶性脑缺血大鼠认知功能障碍。TFB可缩短大鼠平均潜伏期,增加穿越平台次数,促进BDNF和NGF表达,提示TFB可改善局灶性脑缺血大鼠的认知功能。
ERK1/2是真核细胞中广泛存在的重要信号转导蛋白,ERK1/2信号的激活可促进IL-1β、IL-6、TNF-α等多种炎症细胞因子的表达,加重炎症反应。同时,NF-κB还是ERK信号传导通路的下游调控分子,活性受ERK1/2的调控。ERK1/2的活化可进一步激活NF-κB,促进炎症反应发生。还有研究报道显示,NGF能够通过激活ERK1/2信号通路抑制凋亡的产生,同时在细胞损伤模型中发现激活ERK有利于细胞抵抗损伤而产生保护效应,其具体机制可能与激活Bga-1及Bcl-2等有关[14]。本研究结果显示,模型组大鼠海马组织p-ERK1/2和p-NF-κB p65蛋白表达水平较假手术组升高,此结果说明局灶性脑缺血可能刺激p-ERK1/2相关信号通路激活,促使BDNF及NGF水平下调,进而导致神经功能改变,损害认知功能,而TFB能够抑制p-ERK1/2和p-NF-κB p65蛋白表达,从而促使BDNF及NGF水平增高,最终改善认知功能的。NF-κB通过磷酸化被激活后,参与调节炎症反应,NF-κB是核转录因子家族,包含p65、p50等多个亚单位,而IL-1β、TNF-α等多种炎症因子可促进脑组织中NF-κB激活,而活化的NF-κB则将会进一步诱导IL-1β、TNF-α等炎症因子大量生成,从而导致组织过度炎症反应及损伤。本研究结果显示,各组大鼠海马组织促炎因子IL-1β、IL-6、TNF-α与p-ERK1/2和p-NF-κB p65蛋白表达具有相同的变化情况,此结果与有关研究结果基本一致[15],进一步说明TFB可能通过ERK1/2/NF-κB信号通路传导,降低局灶性脑缺血大鼠大脑炎症反应,提示TFB对脑保护具有一定的作用。
综上所述,TFB提高局灶性脑缺血大鼠学习和记忆功能,促进海马组织BDNF和NGF表达水平,改善大鼠认知功能,其作用机制可能与抑制ERK1/2/NF-κB信号通路传导,降低IL-1β、IL-6和TNF-α等促炎因子的表达有关。
