柴胡利胆颗粒中总黄酮含量测定及不确定度评定*
2019-10-21陈舒茵梁国成黄小鸥冯文勇周光宇
陈舒茵,梁国成,黄小鸥,冯文勇,周光宇
广西中医药大学附属瑞康医院(南宁530011)
试验样品在制备、测量过程中,通常会因操作或者测量用具等原因而不可避免的产生误差,因此多数测量值只能反映出真实值的近似值。不确定度是合理的表征赋予被测量值的分散性与测量结果相关联的参数[1-2],是一种科学、合理的质量控制方法和验证手段[3],能够较为准确的评估测量结果。
紫外-可见分光光度法(UV-VIS)因其操作简单、适用性广等特点,已广泛应用于药品分析领域。本文建立了UV-VIS测定柴胡利胆颗粒中总黄酮含量的方法,并根据欧洲化学委员会颁布的Quantifying Uncertainty in Analytical Measurement要求[4],对测定方法进行不确定度评定,探讨该法试验过程中的不确定因素,提高试验数据和检测结果的准确性和可靠性。
仪器与试药
1 仪 器 AE240分析天平(梅特勒-托利多公司),DK-S26电热恒温水浴锅(上海精宏实验设备有限公司),UV-2550紫外分光光度计(日本岛津公司),玻璃器皿为天玻牌A级。
2 试剂与试药 柴胡利胆颗粒(自制,批号180320,180326,180409),黄芩苷对照品(中国药品生物制品检定所,批号110715-200514,含量测定用),乙醇(上海沃凯生物技术有限公司,分析纯),无水乙醇(广东翁江化学试剂有限公司,分析纯),纯化水(自制)。
方法与结果
1 溶液的制备
1.1 对照品溶液的制备:精密称取黄芩苷对照品10.47 mg,以无水乙醇定容于50 ml容量瓶中,再精密量取5 ml至10 ml容量瓶中,加无水乙醇至刻度线,摇匀,即得。
1.2 供试品溶液的制备:取本品18.7315g,精密加入70%乙醇50 ml,热回流提取3次,每次1 h,收集提取液,过滤,合并,蒸干,用无水乙醇溶解,定容于50 ml容量瓶中,加无水乙醇定容至刻度线,摇匀后精密移取5~50 ml容量瓶中,加无水乙醇至刻度线,摇匀,即得。
1.3 阴性样品溶液的制备:取用黄芩阴性样品18.8734g,照“1.2 供试品溶液的制备”法,制备阴性样品溶液,备用。
2 检测波长选择 分别取对照品溶液、供试品溶液和阴性样品溶液,在200~400 nm范围进行紫外全波长扫描,结果显示,黄芩苷对照品溶液与供试品溶液光谱图基本一致,且阴性无干扰,最终选择检测波长为278 nm(图1~3)。
3 线性及线性范围的考察 精密吸取对照品溶液1.0、2.0、4.0、6.0、8.0 ml,分别置于10ml容量瓶中,加无水乙醇稀释到刻度,摇匀,分别取上述溶液,采用UV-Vis进行测定,以吸光度A(Y)为纵坐标,黄芩苷浓度(mg/ml)(X)为横坐标绘制标准曲线。
4 方法学验证
4.1 精密度和重复性试验:精密吸取“1.2”项下供试品,在278 nm波长下,连续测定5次,其吸光度的RSD%=0.64%,表明精密度良好。
4.2 稳定性试验:精密吸取“1.2”项下供试品,在278 nm波长下,分别于0、1、3、6、9、12 h测定,测定6次,其吸光度的RSD%=0.77%,表明溶液在12 h内的稳定性良好。
4.3 重现性试验:取同一批次的柴胡利胆颗粒5份,分别按“1.2”项下平行制备供试品溶液,依法进行测定,结果RSD%=1.26%,表明样品重现性良好。
4.4 回收率试验:精密称取已知含量的供试品5份,分别精密加入黄芩苷对照品,照“1.2”项下制备供试品溶液,依法测定其中总黄酮含量,计算加样回收率,见表1。
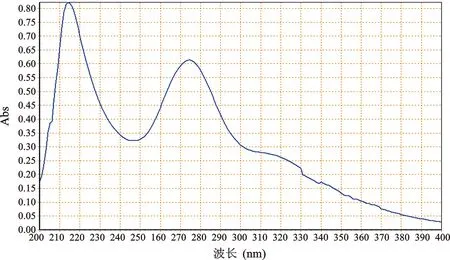
图1 黄芩苷UV光谱图
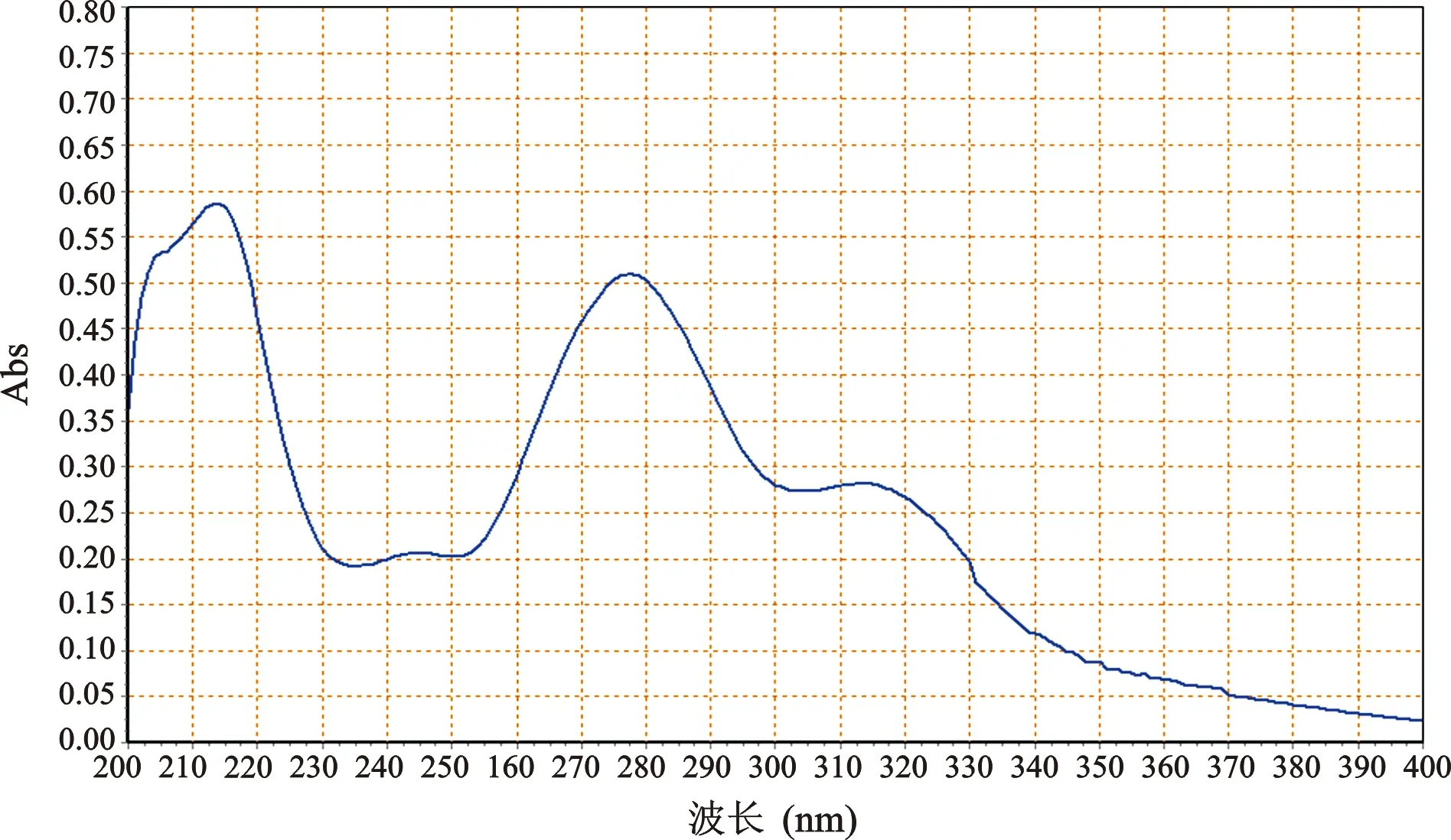
图2 供试品溶液UV光谱图
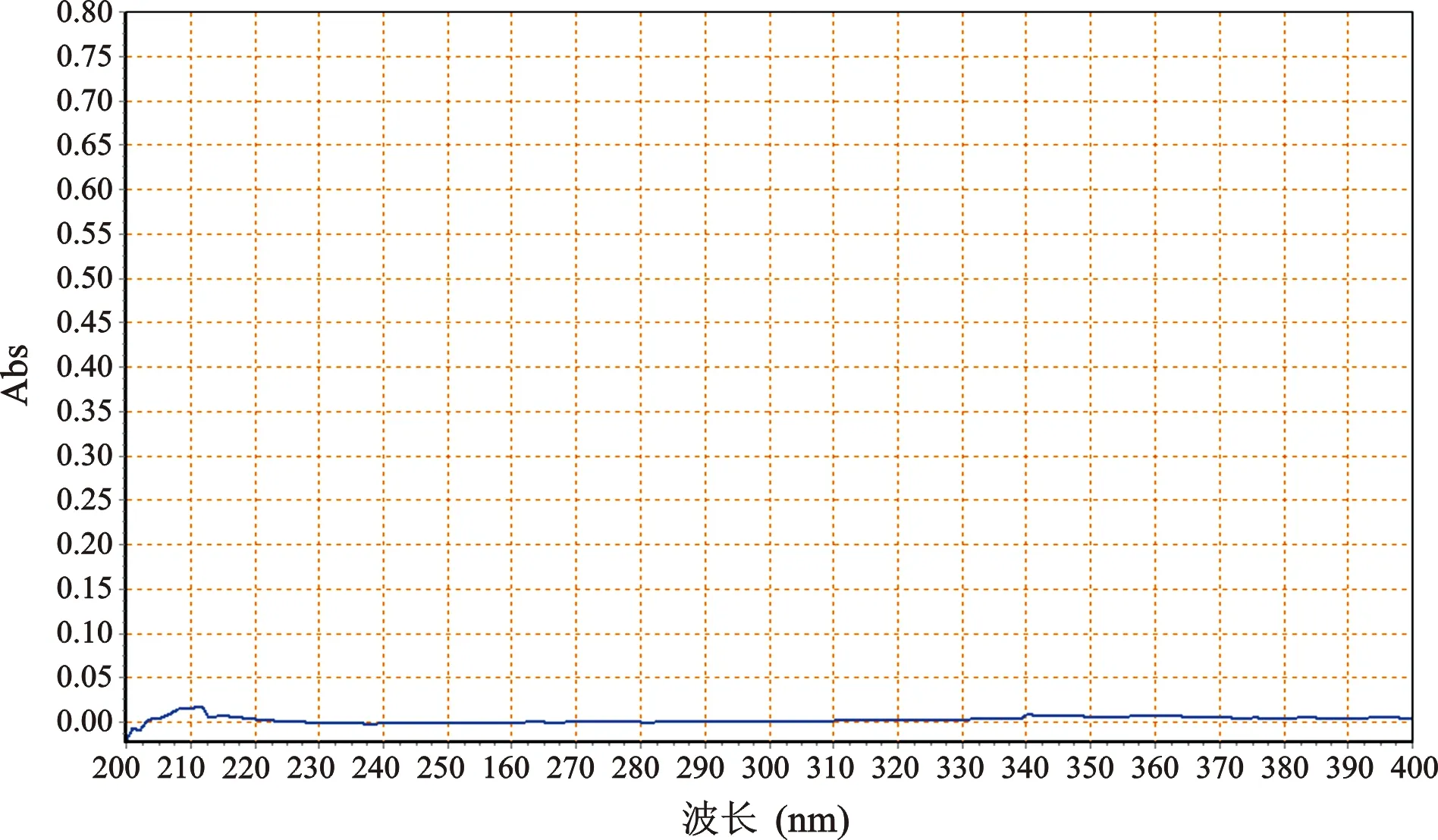
图3 阴性UV光谱图
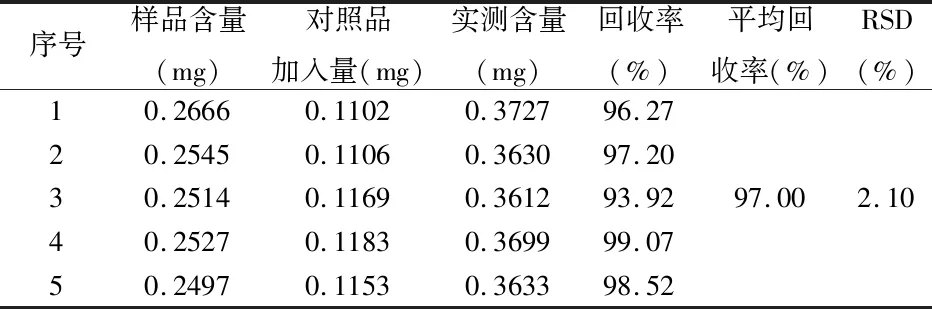
序号样品含量(mg)对照品加入量(mg)实测含量(mg)回收率(%)平均回收率(%)RSD(%)10.26660.11020.372796.2720.25450.11060.363097.2030.25140.11690.361293.9297.002.1040.25270.11830.369999.0750.24970.11530.363398.52
5 样品含量测定 取不同3个批次的柴胡利胆颗粒,分别按“1.2”项下平行制备供试品溶液,并依法进行测定,见表2。
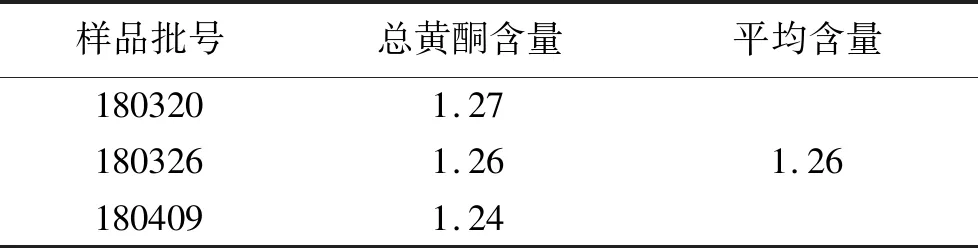
表2 样品含量测定结果(mg/g)
6 不确定度的评定
6.1 不确定度的来源:本实验中,不确定度的主要来源有:对照品溶液制备过程所引入的不确定度、供试品溶液制备过程所引入的不确定度、标准曲线拟合所引入的不确定度、样品重复测定所引入的不确定度、以及回收率测定所引入的不确定度[5-7]。
6.2 量化不确定度分量
6.2.1 对照品溶液制备引入的不确定度:对照品制备过程中使用十万分之一天平精密称取10.47 mg,以无水乙醇定容于50 ml容量瓶(A级)中,再以5 ml单标移液管(A级)精密量取5~10 ml容量瓶中,无水乙醇定容至刻度。故对照品溶液制备引入的不确定度U1有:①对照品称量的不确定度M1,电子天平经检定为1级,允许误差±0.100 mg;②溶液配制的不确定度V1,溶液配制过程用到50 ml、10 ml、5 ml单标移液管(A级)据国家计量检定规程JJG196-2006要求[8],允许误差分别为±0.050 ml、±0.020 ml、±0.025 ml;其分量评定结果见表3。
由表6可得对照品溶液制备的不确定度:
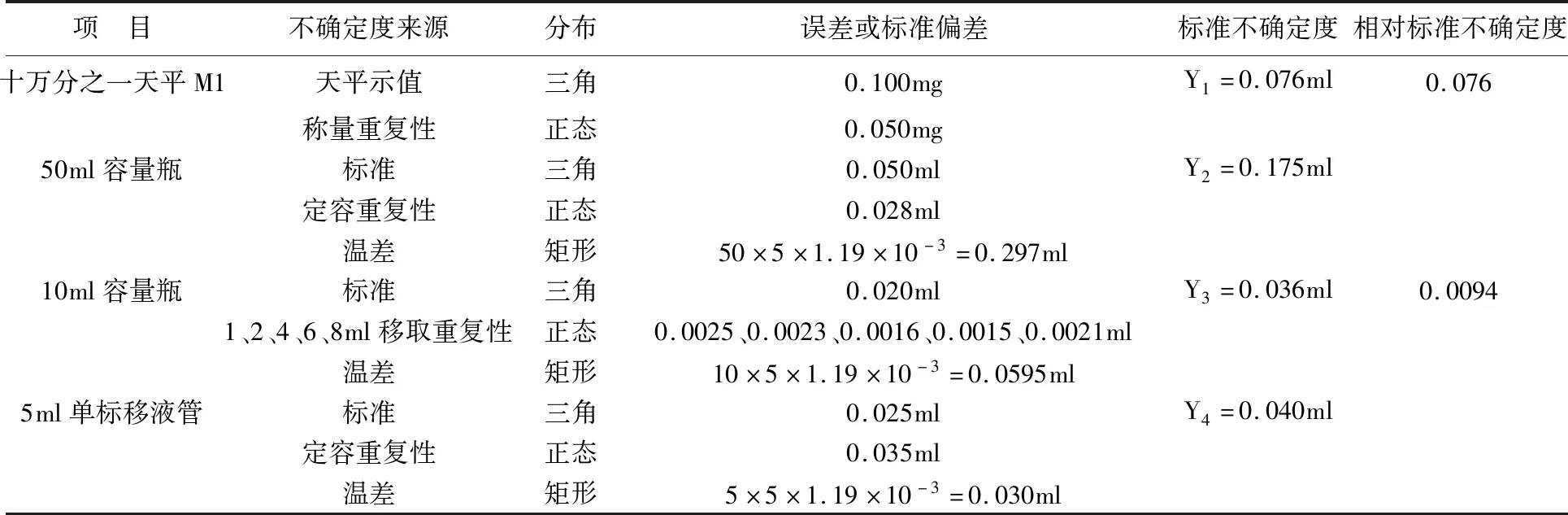
表3 对照品溶液的不确定度评定
6.2.2 供试品溶液制备引入的不确定度:用十万分之一天平精密称取本品18.7315 g,以50 ml单标移液管(A级)精密加入70%乙醇50 ml,热回流提取3次,每次1 h,收集提取液,过滤,合并,蒸干,用无水乙醇溶解,定容于50 ml容量瓶中,加无水乙醇定容至刻度线,摇匀后以5 ml单标移液管(A级)精密移取5 ml至50 ml容量瓶中,加无水乙醇至刻度。供试品溶液制备引入的不确定度U2有:①供试品称量的不确定度M2,电子天平经检定为1级,允许误差±0.100 mg;②溶液配制的不确定度V2,溶液配制过程用到50 ml、5 ml允许误差分别为±0.050 ml、±0.025 ml;其分量评定结果见表4。
供试品溶液制备的不确定度:
6.2.3 标准曲线拟合引入的不确定度:本试验配制了5个浓度的标准溶液Ci:0.01047、0.02094、0.04188、0.06282、0.08376mg/ml,平均浓度C0=0.04397mg/ml,在278nm处测得平均吸光度Ai分别为:0.141、0.218、0.364、0.532、0.696,每个平行测定2次,用最小二乘法拟合,得到直线方程A=bX+a(b为斜率,a为截距)和相关系数r,见表5。
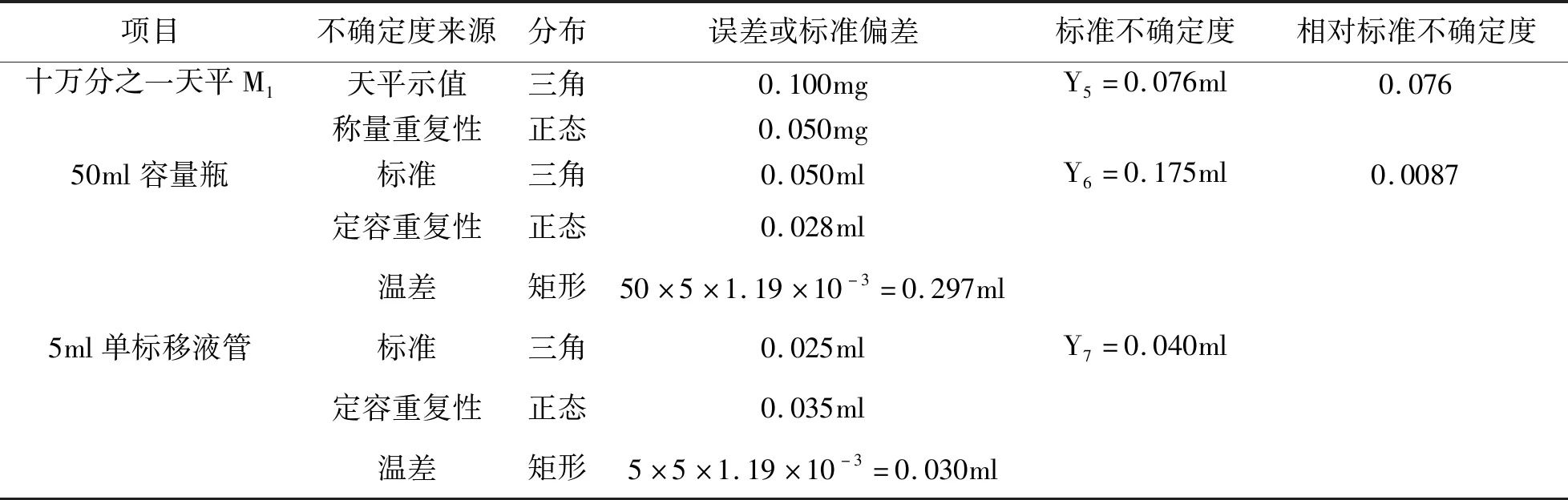
表4 供试品溶液的不确定度评定
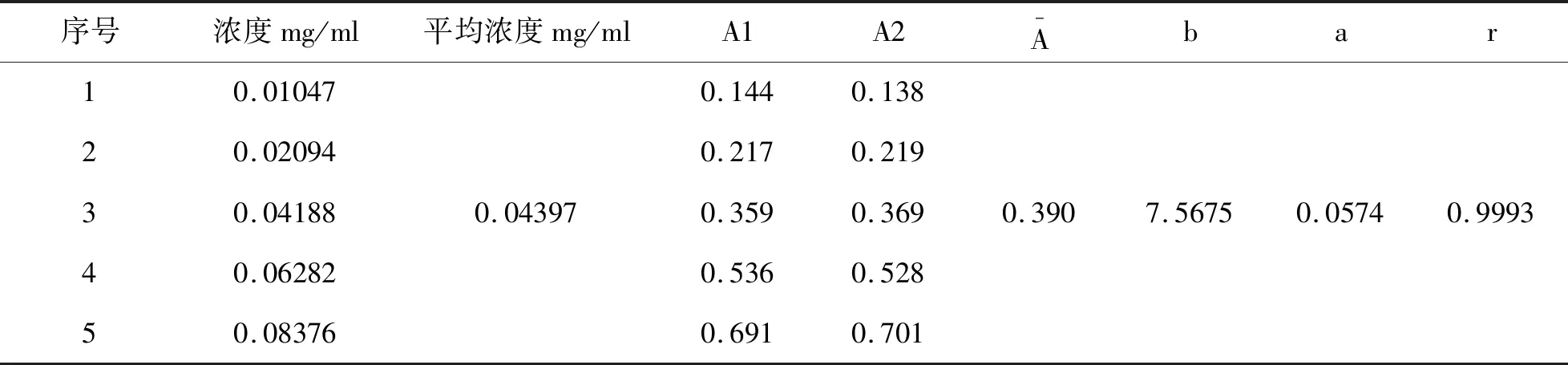
表5 线性最小二乘法拟合
得到b=7.5675,a=0.0574,r=0.9993,线性回归方程A=7.5675X+0.0574
取一份供试品,平行测定2次,由此得平均浓度C0=0.0472mg/ml。则C0的标准不确定度U(C0)为:
公式中:
p-每份样品测定的次数,p=2;
n-标准曲线制备过程中测定了5个浓度,每个浓度测定2次,n=10;
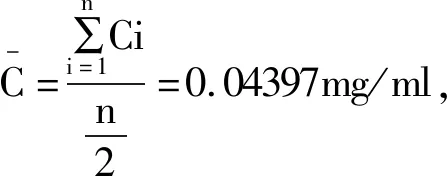
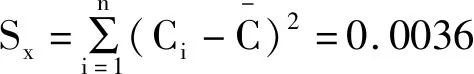
U3=U(C0)/C0=0.0023/0.0472=0.0487
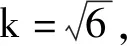
6.3 计算合成标准不确定度:各相对不确定度分量值及贡献率见表6。
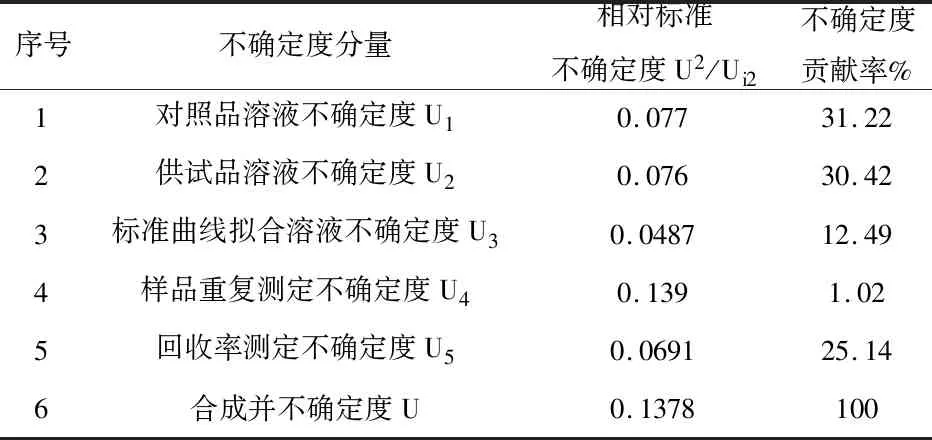
表6 UV-VIS测定柴胡利胆颗粒中总黄酮不确定度分量评定表
7 扩展不确定度和报告不确定度 95%置信区间下,包含因子k=2,则相对扩展不确定度U95=k×U×100%=2×0.1378×100%=27.56%
由试验测定柴胡利胆颗粒中总黄酮含量
W=2.26mg/g,故扩展不确定度为:
U95(W)=1.26×0.2756=0.3473mg/g
本次试验测定得到柴胡利胆颗粒中总黄酮含量为:
W=(1.26±0.3473)mg/g
讨 论
不确定度[9]的评定,与方法学验证一样,将成为分析领域的重点和难点, 2020年版药典拟增加《药品检测结果的不确定度评定指导原则》的征求意见稿[10],可见不确定度评定越来越受重视。
评估不确定时,应尽可能考虑到可能产生不确定度的所有因素,各不确定度分量对合成不确定度的贡献率各异,由表6可看出,UV-VIS测定柴胡利胆颗粒中总黄酮不确定度分量,不确定度主要由对照品溶液配制、供试品溶液配制以及回收率试验所引入,主要原因在于操作步骤繁多或操作不熟练、以及计量器具等因素,因此试验过程中应尽可能减少操作步骤,提高操作熟练度,尽量避免使用小容量计量器具进行量取、定容等,以减少因主观和客观因素而引入的不确定度,提高测量结果的可靠性。
本文通过UV-VIS试验的方法学验证和不确定度的评定,可较为真实的反映试验过程中各因素所引入的不确定度,评定出测量结果的合成标准不确定度以及扩展不确定度,验证测定方法的科学性、合理性,也
为同类分析方法的参考提供了可靠依据。
