中国鲎几丁质酶的酶学性质研究
2019-09-18林建城王丽英林娟娟
林建城,王丽英,林娟娟
( 莆田学院 环境与生物工程学院,福建省新型污染物生态毒理效应与控制重点实验室,福建 莆田 351100 )
Broadway等[1]根据几丁质酶作用机理不同,认为其至少包含内切几丁质酶(EC3.2.1.14)、外切几丁质酶和具外切酶性质的N-乙酰-β-D-氨基葡萄糖苷酶(EC3.2.1.52,NAGase)等3种组分。微生物几丁质酶已受到广泛关注[2],它能够将真菌细胞壁、昆虫体表和围食膜的几丁质成分水解为几丁寡糖和N-乙酰氨基葡萄糖,从而能有效抑制真菌的生长和加速害虫的死亡进程[3];而在甲壳动物的生长中必须经过一个周期性的动态生理过程——蜕皮[4],近年研究发现甲壳动物几丁质酶与其周期性蜕皮生理之间存在相关性[5]。Buchholz[6]研究表明,南极磷虾(Euphausiasuperba)蜕皮与外壳几丁质酶活力变化相关,在蜕皮前短时间内,内切几丁质酶和N-乙酰-β-D-氨基葡萄糖苷酶大量合成,酶活力迅速提高,用于降解虾几丁质表皮;朴顺金等[7]在研究不同养殖期凡纳滨对虾(Litopenaeusvannamei)外壳膜N-乙酰-β-D-氨基葡萄糖苷酶的性质中也发现,在虾幼体和生殖期时,由于蜕壳频繁,虾外壳膜N-乙酰-β-D-氨基葡萄糖苷酶比活力会迅速升高。而Koga等[8]从家蚕(Bombyxmori)的表皮层中获得N-乙酰-β-D-氨基葡萄糖苷酶,发现蚕表皮N-乙酰-β-D-氨基葡萄糖苷酶与其周期性的蜕皮生理、以及生活周期中蛹的形成密切相关。Arakane等[9]也发现昆虫内切几丁质酶可将其自身几丁质表皮降解为壳寡糖,再由外切几丁质酶继续降解为N-乙酰氨基葡萄糖单体,并用以形成新的表皮。此后,王佩等[10]研究表明,日本沼虾几丁质酶基因-3的表达水平以蜕皮前期最为显著,从而推测与几丁质酶参与虾旧壳的降解和新壳的形成有关,进一步证明了几丁质酶在甲壳动物蜕皮生理中起重要作用。
中国鲎(Tachypleustridentatus)属节肢动物门、肢口纲、剑尾目,由于海域环境破坏和人类捕杀等原因,已成为濒危物种,是国家二级保护动物。随着沿海地区工业化的不断推进,鲎赖以生存的海域环境受到严重破坏,扰乱了鲎的正常生理活动与物质代谢。有研究表明,温度和盐度都会影响中国鲎胚胎发育的速度和孵化率,其胚胎发育最适温度为28 ℃,最适盐度为20[11];而Zn、Pb、Cu和Cd 4种重金属离子对中国鲎的胚胎发育产生的影响不同,当4种重金属离子浓度超过渔业水域水质标准浓度8倍时,Cd2+和Cu2+对鲎的胚胎发育无明显影响,但Zn2+和Pb2+会使鲎胚胎发育中卵径变小,发育速度下降[12],说明海洋环境因子的变化直接影响中国鲎的胚胎发育和幼体生长。此外,有研究表明,温度、酸碱度、金属离子和有机溶剂等环境因素对节肢动物几丁质酶会产生重要影响,并推测会影响节肢动物的蜕皮生理[13-15]。而在中国鲎的胚胎发育到性成熟期间,至少需经19次蜕皮,鲎蜕皮生理的变化直接影响鲎的正常生长发育。然而,中国鲎几丁质酶的生理特性及环境因子对鲎几丁质酶的影响,目前尚未见相关研究。之前研究已自中国鲎内脏中分离纯化出N-乙酰-β-D-氨基葡萄糖苷酶[16],现继续自中国鲎内脏中分离提取内切型几丁质酶,探讨其酶学性质,并研究环境因子对中国鲎几丁质酶的影响,这对进一步揭示鲎几丁质酶与蜕皮生理之间的相关性具有重要的作用,并为能更好地保护鲎资源,合理开发利用鲎资源提供科学依据。
1 材料与方法
1.1 材料
中国鲎购自莆田市城南市场。酶催化的底物对硝基苯-N-乙酰-β-D-氨基葡萄糖苷,由上海医药工业研究院生化室合成;3,5-二硝基水杨酸为Fluka产品,标准物N-乙酰-D-氨基葡萄糖为Sigma产品,几丁质购自中国医药集团上海化学试剂公司,其余化学试剂均为国产分析纯。
1.2 方法
1.2.1 中国鲎几丁质酶制剂的制备
取新鲜中国鲎内脏,以1∶3(m/V)浸泡在预冷的0.01 mol/L Tris-HCl(pH 5.4)缓冲液中,在高速组织捣碎机中破碎1 min,4 ℃抽提4 h以上,匀浆液于4 ℃,12 000 r/min,离心30 min,取上清液。上清液依次采用35%、75%饱和度的(NH4)2SO4分级分离,沉淀物经双蒸馏水透析后于4 ℃、14 000 r/min 离心30 min,上清液为粗酶制剂。
1.2.2 胶体几丁质的制备
将条状几丁质(甲壳素)在植物粉碎机下磨成细粉,10 g细粉几丁质加入100 mL浓盐酸,4 ℃下间隔搅拌24 h,倒入500 mL预冷蒸馏水中,放置48 h,4000 r/min下离心,沉淀用蒸馏水洗至中性,用的50 mmol/L NaAc-HAc缓冲液(pH 5.4)配成5.0 mg/mL的胶体几丁质。
1.2.3 中国鲎几丁质酶活力的测定方法
中国鲎几丁质酶活力测定方法参照文献[13],在0.5 mL的酶活力测定体系中含有50 mmol/L NaAc-HAc缓冲液(pH 5.4)和5.0 mg/mL胶体几丁质,55 ℃下预热10 min,后加入50 μL的酶液,在55 ℃下反应30 min;以0.5 mL 0.5 mol/L的NaOH终止反应,离心,去沉淀,取上清液0.5 mL,加入0.5 mL 3,5-二硝基水杨酸,煮沸5 min,静置至室温后,测定其光吸收值(A520nm),以未加入酶制剂的为对照。以产物N-乙酰-D-氨基葡萄糖为标准物,制定标准曲线。以吸光值(y)为纵坐标,N-乙酰-D-氨基葡萄糖含量(x)为横坐标,绘制标准曲线,得直线回归方程:y=0.619x-0.151。
1个酶活力单位(U)定义为:每小时水解胶体几丁质产生1 μmol N-乙酰-D-氨基葡萄糖所需的酶量。
1.2.4 中国鲎几丁质酶最适pH和酸碱稳定性的测定
在酶活力测定体系中,测定不同pH(3.6~9.0)下中国鲎几丁质酶活力,其中pH为3.6~5.8时选择HAC-NaAC缓冲液,pH为5.8~7.6时采用Na2HPO4-NaH2PO4缓冲液,pH为7.6~9.0时使用Tris-HCl缓冲液,3种缓冲液浓度均为50 mmol/L,酶活力最大的试验组其pH值确定为酶的最适pH,其酶活力以100%表示,其余各试验组酶活力则以相对酶活力表示。
将酶液分别与各种不同pH(3.6~9.0)的缓冲液混合,4 ℃下各预处理1 h,然后取50 μL处理过的酶液,在酶活力测定体系中测定酶经处理后的剩余酶活力,剩余酶活力最大的试验组其酶活力以100%表示,其余试验组的酶活力以相对酶活力表示,以分析几丁质酶的酸碱稳定性。
相对酶活力/%=(a/amax)×100%
式中,a为各试验组(剩余)酶活力,amax为各试验组中最大(剩余)酶活力。
1.2.5 中国鲎几丁质酶最适温度和温度稳定性的测定
在酶活力测定体系中,检测不同温度(20~90 ℃)下中国鲎几丁质酶活力,酶活力最大的试验组其温度确定为酶的最适温度,其酶活力以100%表示,其余试验组的酶活力以相对酶活力表示。
将几丁质酶液置于不同温度(20~90 ℃)下预处理1 h,然后取50 μL经热处理过的酶,在酶活力测定体系中测定酶经热处理后的剩余酶活力,剩余酶活力最大的试验组其酶活力以100%表示,其余试验组的剩余酶活力以相对酶活力表示,以分析几丁质酶的温度稳定性。
1.2.6 中国鲎几丁质酶催化几丁质酶解的动力学参数测定
在几丁质酶活力的测定体系中,改变底物胶体几丁质的质量浓度,测定不同底物质量浓度[S](2.0~8.0 mg/mL)下几丁质酶活力,采用Lineweave-Burk双倒数作图法,以反应初速度倒数(1/v)对底物质量浓度倒数(1/[S])作图,求出中国鲎几丁质酶的米氏常数(Km)和最大反应速度(Vmax)。
1.2.7 金属离子对中国鲎几丁质酶活力影响的测定
在上述几丁质酶活力的测定体系中,分别加入0~20.0 mmol/L的Li2SO4、Na2SO4、NaCl、NaNO3和KNO3;0~5.0 mmol/L的MgSO4、CaCl2和BaCl2;0~20.0 mmol/L的FeSO4、CoCl2、NiCl2、CuSO4、ZnSO4、MnCl2、AlCl3、FeCl3、HgCl2、Pb(NO3)2和Cd(NO3)2;测定加入各金属离子后的中国鲎几丁质酶活力。以未添加金属离子的对照组酶活力为100%,计算各试验组的相对酶活力。
相对酶活力/%=(a/amax)×100%
式中,a为各试验组酶活力,amax为对照组酶活力。
1.2.8 有机溶剂对中国鲎几丁质酶活力影响的测定
在几丁质酶测活体系中,分别加入0~50.0%体积分数的甲醇、乙醇、正丙醇、异丙醇、丙酮、二氧六环和二甲亚砜等7种有机溶剂,以未添加有机溶剂的对照组酶活力为100%,计算各试验组的相对酶活力。
2 结果与分析
2.1 pH对中国鲎几丁质酶活力的影响
由图1可见,pH对中国鲎几丁质酶活力的影响呈钟罩型曲线变化,几丁质酶最适pH为5.4,随pH逐渐增大,几丁质酶活力也不断下降。

图1 中国鲎几丁质酶的最适pH
由图2可见,几丁质酶在pH 4.6~6.0的缓冲液中预处理1 h后,相对酶活力还保留在80.7%以上,说明几丁质酶在pH 4.6~6.0内相对稳定,经pH 8.0缓冲液处理1 h后几丁质酶相对活力仅有11.5%;而在pH≤4.4的缓冲液中处理后几丁质酶活力也呈下降趋势,说明该几丁质酶对环境中酸碱度的变化敏感。
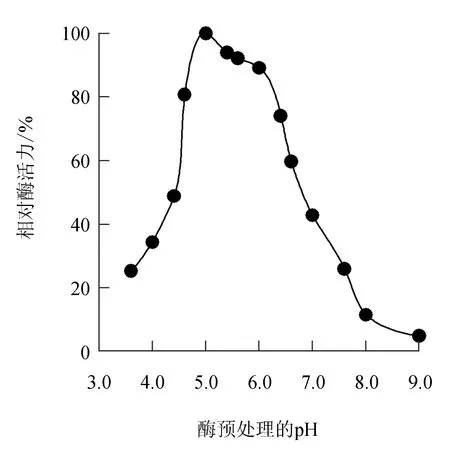
图2 中国鲎几丁质酶的酸碱稳定性
2.2 温度对中国鲎几丁质酶活力的影响
由图3可见,中国鲎内脏几丁质酶的最适温度为55 ℃,之后随温度升高酶活力不断下降,温度达80 ℃时,酶活力剩余36.6%。
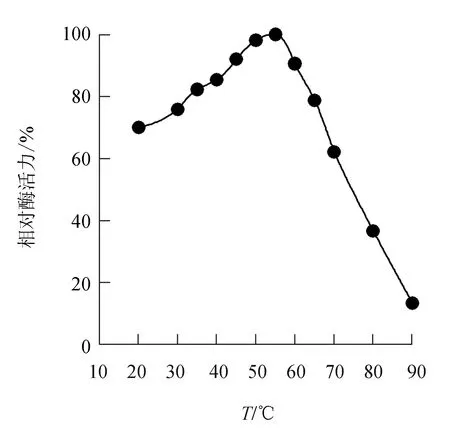
图3 中国鲎几丁质酶的最适温度
由图4可见,几丁质酶在20~60 ℃预处理1 h后相对酶活力保持在88%以上,酶在65 ℃处理1 h相对酶活力还保留有79.8%,在90 ℃下处理1 h相对酶活力还剩34.3%,表明中国鲎内脏几丁质酶具较好的热稳定性。
2.3 中国鲎几丁质酶米氏常数和最大反应速度的测定
Lineweaver-Burk双倒数作图(图5)显示,反应初速度倒数(y)与底物浓度倒数(x)的回归方程为y=1.494x+0.687,求得催化胶体几丁质底物水解的中国鲎几丁质酶米氏常数为2.175 mg/mL,最大反应速度为1.456 μmol/(mL·min)。

图4 中国鲎几丁质酶的温度稳定性
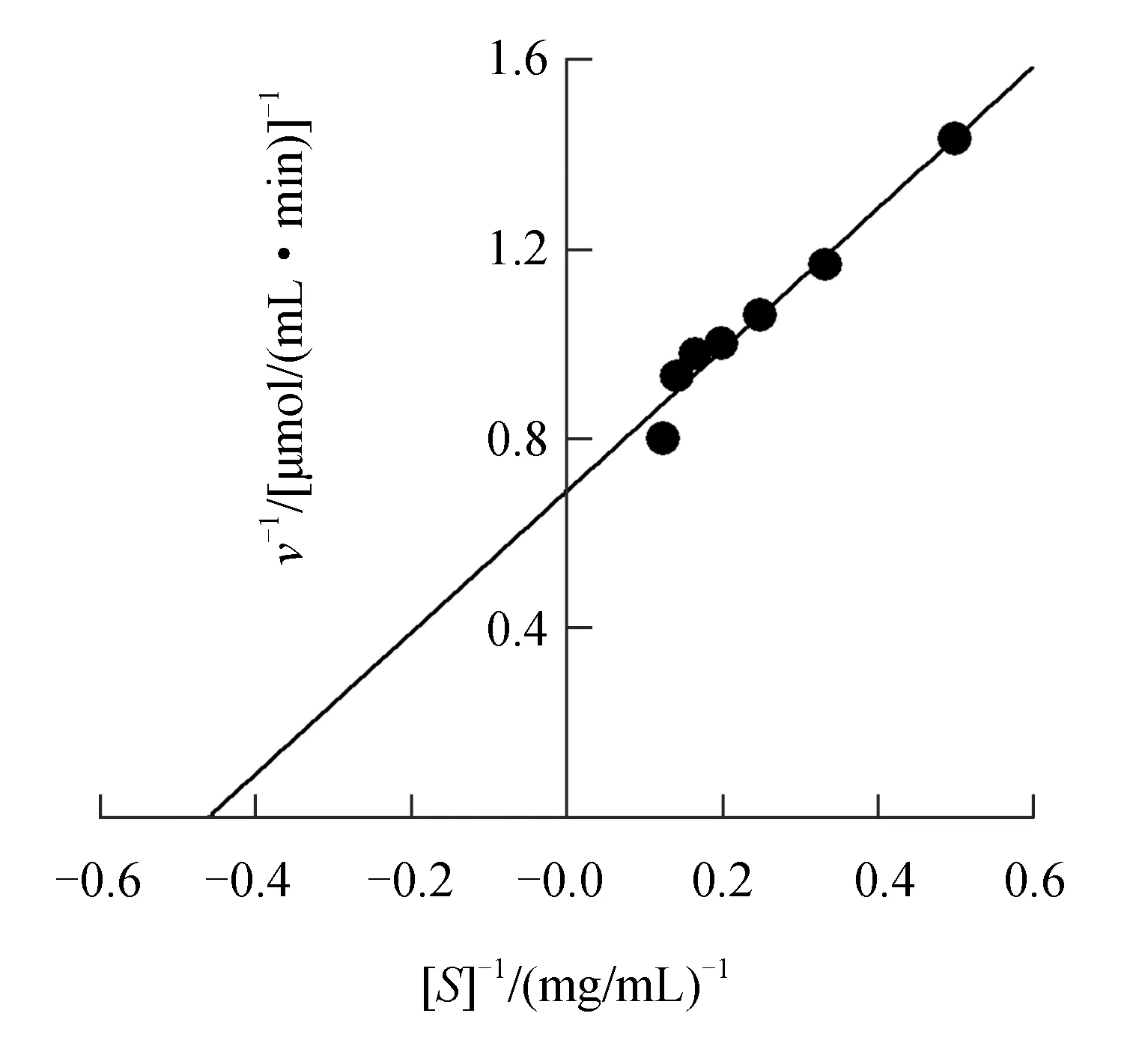
图5 中国鲎几丁质酶米氏常数米氏常数的测定
2.4 金属离子对中国鲎几丁质酶活力的影响
2.4.1 正一价金属离子对酶活力的影响
2.4.2 碱土金属离子对酶活力的影响
由图6可见,在0~5.0 mmol/L浓度内,碱土金属离子Ca2+和Ba2+对中国鲎几丁质酶有微弱的激活作用,1.0 mmol/L Ca2+和Ba2+可分别使酶活力提高10.1%、11.3%,但Mg2+对中国鲎几丁质酶活力影响不大。
2.4.3 过渡金属离子对酶活力的影响
由图7可见,过渡金属离子Fe2+对中国鲎几丁质酶活力影响不大;而Co2+在低浓度时对中国鲎几丁质酶先表现为激活,后随Co2+浓度增大逐渐转为抑制作用,5 mmol/L Co2+可使几丁质酶活力提高16.3%,而20 mmol/L Co2+则可使酶活力下降14.3%。Ni2+和Mn2+对中国鲎几丁质酶活力均呈抑制作用,10 mmol/L的Ni2+和Mn2+可分别使几丁质酶活力下降27.4%和41.6%。
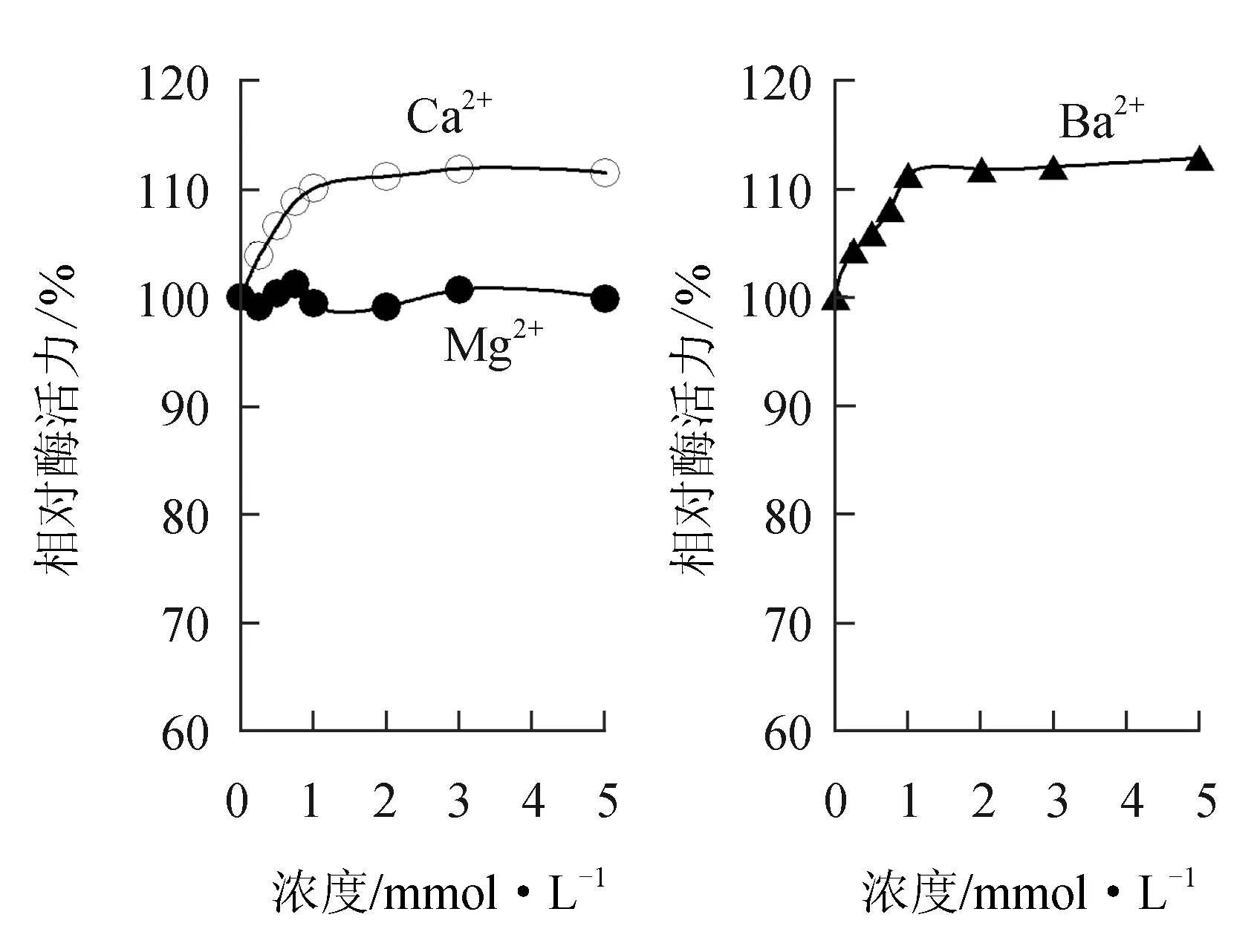
图6 正二价碱土金属离子对中国鲎几丁质酶活力的影响
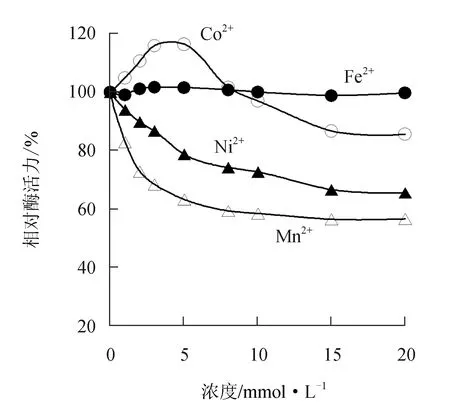
图7 过渡金属离子对中国鲎几丁质酶活力的影响
2.4.4 正三价金属离子对酶的效应
由图8可见,低浓度的Fe3+对中国鲎几丁质酶有微弱的激活作用,但随Fe3+浓度的增大对几丁质酶反而有微弱的抑制作用,5 mmol/L Fe3+能使几丁质酶活力提高4.3%,而20 mmol/L Fe3+对几丁质酶抑制了9.2%。Al3+对中国鲎几丁质酶活力具有一定的抑制作用,10 mmol/L的Al3+可使几丁质酶活力下降18.6%。
2.4.5 重金属离子对酶活力的影响
由图9可见,低浓度的Cu2+对中国鲎几丁质酶有微弱的激活作用,但随Cu2+浓度的增大逐渐呈现出对几丁质酶的抑制作用,10 mmol/L Cu2+能使几丁质酶活力下降39.5%;而Cd2+、Pb2+、Zn2+和Hg2+等重金属离子对中国鲎几丁质酶均呈不同程度的抑制作用,10 mmol/L的Cd2+、Pb2+、Zn2+和Hg2+可分别使几丁质酶活力抑制17.5%、23.9%、33.1%和83.0%,Hg2+对几丁质酶的抑制作用最强。

图8 Fe3+和Al3+对中国鲎几丁质酶活力的影响
2.5 有机溶剂对中国鲎几丁质酶活力的影响
由表1可见,甲醇、乙醇、异丙醇和正丙醇对中国鲎几丁质酶均有抑制作用,抑制作用顺序为甲醇>乙醇>异丙醇>正丙醇;丙酮对中国鲎几丁质酶有一定的激活作用,10%体积分数的丙酮会使酶活力提高16.0%;二氧六环和二甲亚砜在低浓度时对中国鲎几丁质酶有激活作用,随浓度升高,对几丁质酶转为抑制作用,2%体积分数的二氧六环和二甲亚砜可分别使几丁质酶活力提高7.7%和14.5%,而其在30%体积分数时,可分别使几丁质酶活力下降11.3%和23.1%。
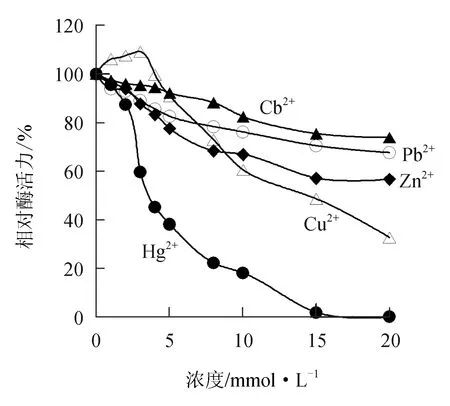
图9 重金属离子对中国鲎几丁质酶活力的影响
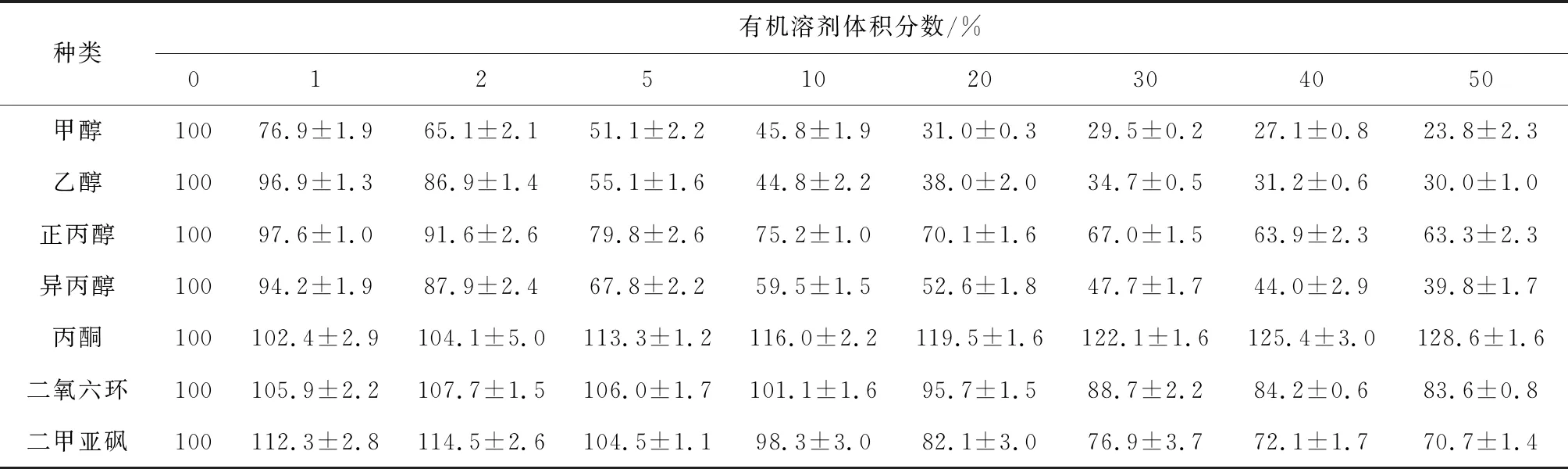
表1 7种有机溶剂对中国鲎几丁质酶相对酶活力的影响 %
3 讨 论
3.1 几丁质酶的稳定性
不同来源的几丁质酶对酸碱敏感度不同。凡纳滨对虾[15]几丁质酶酸碱稳定性区域为pH 4.6~7.0;而苏云金芽孢杆菌(Bacillusthuringiensisssp.colmeri)15A3[3]几丁质酶B酸碱稳定在pH 4.0~8.0。冯金荣等[17]研究的伊萨酵母(Issatchenkiaterricola)几丁质酶在pH 5.0~9.0内较为稳定,pH超出此范围,酶将迅速失活。在本研究中,中国鲎几丁质酶在pH 4.6~6.0内较为稳定,在pH>6.5和pH<4.5下酶失活加快,对酸碱较为敏感。
蚕蛹(Bombyxmori)[18]几丁质酶在温度45 ℃以上时酶失活速度加快;毛壳菌(Chaetomiumsp.)YMF1.00843[19]几丁质酶在温度高于40 ℃时易失活,酶稳定性较差。Kopparapu等[20]也从石榴(Punicagranatum)果汁中分离纯化到一种热稳定性很好的几丁质酶,温度在65 ℃内酶基本稳定。而中国鲎几丁质酶则具有较好的热稳定性,在20~60 ℃温度内酶基本稳定,60 ℃处理1 h后酶活力还保留88%,相比中国鲎外切型几丁质酶——N-乙酰-β-D-氨基葡萄糖苷酶,温度稳定性范围为20~50 ℃,两者最适温度均为55 ℃[16],因此,在鲎幼体生长的适宜水温(30 ℃左右)下,中国鲎内切和外切几丁质酶活力均较低。
3.2 金属离子对几丁质酶的影响
Li+和K+对海洋微生物短芽孢杆菌(Brevibacillussp.)Bsp1[21]几丁质酶活性有不同程度的激活作用,可分别使酶活力提高17%和3%,Na+对其又有微弱的抑制作用;而Li+对苏云金芽孢杆菌[3]几丁质酶B则呈现一定的抑制作用,Na+对其又有微弱的激活效应。此外,Na+和K+对中华根瘤菌(Sinorhizobiumsp.)L03[22]几丁质酶活性有不同程度的抑制作用;5 mmol/L Na+和K+可分别使疏绵状嗜热丝孢菌(Thermomyceslanuginosus)[23]几丁质酶活力提高45.6%和30.4%。本试验结果显示,K+、Na+和Li+对中国鲎几丁质酶几乎没有影响。
碱土金属离子常对酶呈激活效应。Ca2+和Mg2+对毛壳菌[19]和芽孢杆菌(Bacillussp.)Hu1[24]几丁质酶均有激活作用;50 mmol/L Mg2+和Ba2+可显著提高中华根瘤菌[22]几丁质酶的活性,Ca2+对其则呈现抑制作用。而Ca2+和Ba2+对凡纳滨对虾[15]几丁质酶活性也有一定激活作用,Mg2+对其却没有影响,这与本试验结果相似,1.0 mmol/L Ca2+和Ba2+可分别使中国鲎几丁质酶活力提高10.1%和11.3%,但Mg2+对酶活力影响不大。
过渡金属离子对酶活性的影响呈现多样性。Fe2+、Mn2+和Co2+对黏质沙雷氏菌(Serratiamarcesens)[25]几丁质酶有不同效应,Fe2+表现明显的抑制作用,Mn2+有微弱激活作用,Co2+又几乎没有影响;5 mmol/L Co2+可以使短芽孢杆菌[21]几丁质酶活性提高1.4倍,Ni2+对其则表现为抑制作用;而5 mmol/L浓度的Mn2+、Co2+和Fe2+对重组几丁质酶rchiGR52-1[26]均有明显的抑制作用,Ni2+对其又具有一定的促进作用。在本试验中,Fe2+对中国鲎几丁质酶活力影响不大,低浓度Co2+对酶表现为激活效应,之后随浓度增大转为抑制作用,Ni2+和Mn2+对酶具有不同程度的抑制作用。
Fe3+对毛壳菌[19]几丁质酶影响不大,对苏云金芽孢杆菌[3]几丁质酶B活性有促进作用,但又强烈抑制中华根瘤菌[22]几丁质酶的活性。在本试验中,低浓度Fe3+对中国鲎几丁质酶有微弱的激活效应,后随浓度增大转为抑制作用。此外,10 mmol/L Al3+可分别使蚕蛹[18]和凡纳滨对虾[15]几丁质酶失活5.2%和14.2%,在同样浓度下,Al3+可使中国鲎几丁质酶失活18.6%。
重金属经常是酶的抑制剂。Zn2+、Cu2+和Hg2+能强烈抑制短芽孢杆菌[21]几丁质酶活性;10 mmol/L Cu2+、Zn2+和Cd2+可分别使黏质沙雷氏菌[25]几丁质酶失活17.4%、28%和26.7%;Zn2+和Hg2+也可分别抑制疏绵状嗜热丝孢菌[23]几丁质酶活性;10 mmol/L Hg2+和Pb2+可使宛氏拟青霉(Paecilomycesvariotii)DG-3[27]产生的胞外几丁质酶(Chi46)完全失活;而凡纳滨对虾[15]几丁质酶在10 mmol/L的Cd2+、Pb2+和Hg2+中可分别失活11.7%、35.0%和95.6%。本试验结果表明,低浓度Cu2+对中国鲎几丁质酶表现为激活效应,后随浓度增大转为抑制作用,Cd2+、Pb2+、Zn2+和Hg2+对几丁质酶抑制作用顺序为Hg2+>Zn2+>Pb2+>Cd2+,10 mmol/L Hg2+可使几丁质酶活力丧失83.0%。
目前,金属离子对内切型几丁质酶的影响机制研究报道较少,但对具有外切酶性质的几丁质酶——N-乙酰β-D-氨基葡萄糖苷酶的影响机理研究较多。有研究表明,Hg2+对凡纳滨对虾[28]N-乙酰-β-D-氨基葡萄糖苷酶的抑制属于不可逆抑制,底物对Hg2+的抑制还具有保护作用,且Hg2+是通过与半胱氨酸的巯基共价结合从而导致酶失活的;而Zn2+对凡纳滨对虾N-乙酰-β-D-氨基葡萄糖苷酶的抑制则表现为可逆的非竞争性抑制作用,Zn2+可能是与N-乙酰-β-D-氨基葡萄糖苷酶蛋白的组氨酸或半胱氨酸结合,导致酶蛋白构象的变化,从而引起酶的失活[29];但是,Zn2+对拟穴青蟹(Scyllaserrata)[14]N-乙酰-β-D-氨基葡萄糖苷酶的抑制则是一种可逆的混合型抑制作用;此外,Cd2+对尼罗罗非鱼(Oreochromisniloticus)[30]精巢N-乙酰-β-D-氨基葡萄糖苷酶具有较强抑制作用,抑制类型属于竞争性抑制作用;但CuSO4对该酶的抑制则表现为非竞争性的抑制作用[31]。
因此,不同金属离子对几丁质酶有不同的影响,同一种金属离子对不同来源的几丁质酶效应也不同。
3.3 有机溶剂对几丁质酶的影响
酶依赖其活性中心与底物结合并产生催化反应,有机溶剂能渗透入酶的活性中心,降低活性中心的极性,从而增加酶与底物的静电斥力,降低了酶与底物的结合能力。因为不同有机溶剂的极性大小不同,必然对酶呈现不同的影响效应。本试验结果显示,甲醇、乙醇、异丙醇和正丙醇等4种有机溶剂对中国鲎几丁质酶均呈现抑制作用,其抑制作用的强弱与4种有机溶剂的极性大小(甲醇>乙醇>异丙醇>正丙醇)呈正相关,其中甲醇极性大,对几丁质酶的抑制作用最强。甲醇、乙醇和正丙醇对凡纳滨对虾[13]体壁几丁质酶也有类似的抑制作用。
丙酮对苏云金芽孢杆菌[32]几丁质酶活力有较强的激活作用,激活效果在2.5%~25%的体积分数内与体积分数成正相关;而在0~50%体积分数内,丙酮对凡纳滨对虾[13]几丁质酶也呈激活作用。本试验中,丙酮也同样具有促进中国鲎几丁质酶活力的作用。丙酮是非质子极性溶剂,酶蛋白与溶剂之间直接接触,蛋白质分子的表面结构有所变化,这些变化可能使几丁质酶活性中心的柔性增强,有利于酶功能的发挥。
有研究表明,低体积分数的二氧六环和二甲亚砜对凡纳滨对虾[13]几丁质酶有激活作用,且随体积分数升高激活作用减弱并逐渐转为抑制作用,与本试验中二氧六环和二甲亚砜对中国鲎几丁质酶的影响效应相似。二甲亚砜对苏云金芽孢杆菌[32]几丁质酶也表现为先激活后抑制的效应;但是,二氧六环在体积分数小于5%时,对苏云金芽孢杆菌[32]几丁质酶的影响不明显,当体积分数大于5%时,对酶开始呈现激活作用。
