不同溶氧浓度下非离子氨和亚硝酸盐对中华绒螯蟹的急性毒性
2019-08-19王煜恒李庆陈军王会聪张坤桑晓军
王煜恒 ,李庆 ,陈军 ,王会聪 ,张坤 ,桑晓军
(1.江苏农林职业技术学院畜牧兽医学院,江苏 镇江 212400;2.宿迁东湖生态农业有限公司,江苏 宿迁 223800)
目前,氨氮和亚硝酸盐对水产动物的急性毒性研究已有研究。陈佳毅等[3]研究表明:氨氮和亚硝酸氮对不同发育阶段罗氏沼虾Macrobrachium rosenbergii幼体均有毒性,育苗生产过程应控制育苗水体非离子氨和亚硝酸氮浓度分别不高于0.10mg/L和1.00mg/L。樊海平等[4]发现,大刺鳅Mastacembelue armatus幼鱼总氨氮、非离子氨和亚硝酸盐的安全浓度分别为7.61mg/L、0.46mg/L和0.0798mg/L。李波等[5]研究认为,氨氮和亚硝酸盐对黄颡鱼Pelteobagrus fulvidraco的半致死浓度和安全浓度随水中溶解氧含量的升高而增大,水体增氧能提高黄颡鱼对氨氮和亚硝酸盐的耐受能力。江敏等[6]和洪美玲[7]分别研究了氨氮和亚硝酸盐对河蟹溞状幼体和河蟹幼体半致死浓度和安全浓度,但是不同的溶氧浓度下上两种物质对河蟹毒性影响的研究还未见报道。
本文通过研究不同溶氧浓度下非离子氨和亚硝酸盐对河蟹的急性毒性,以了解河蟹在两种溶氧情况下对非离子氨和亚硝酸盐的耐受能力,并为河蟹养殖水质管理及病害防治提供参考。
1 材料与方法
1.1 材料
试验蟹来自宿迁东湖生态农业有限公司河蟹养殖场,选取健康活泼、规格一致的优质个体,甲宽(5.52±0.35)cm,甲长(3.55±0.12)cm,体质量(10.06±1.23)g,暂养7 d。试验用水为曝气2d的自来水,水温为(21±1)℃,pH 为(7.8±0.2),溶解氧含量(DO)为6.0~7.0 mg/L,氨氮浓度低于0.02 mg/L,亚硝酸盐浓度低于0.01 mg/L。
试验毒物为NaNO2和NH4Cl(分析纯),烘干至恒重后,分别精确配制成10g/L的母液,试验时按比例稀释至试验所需浓度。水体中氨氮含量采用纳氏试剂分光光度法测定,亚硝酸盐氮含量采用(N-1-萘基)乙二胺光度法,利用UV2100紫外分光光度计(上海/尤尼柯)测定。
1.2 方法
预试验确定了氨氮(非离子氨)和亚硝酸盐在正常溶氧量和过饱和溶氧下24h 100%死亡(24 h LC100)及 96h 0%死亡的质量浓度(96hLC0),在 24 h LC100及96hLC0之间按等对数间距设置6个浓度梯度,每个浓度设置3个平行,并设对照,具体浓度见表1。
过饱和溶氧条件下的毒性试验采用96h半静水法[8]。在50cm×30cm×23cm的塑料箱(试验水体为30L)中放入河蟹10只(养殖密度为3.33g/L),加入配置的母液至试验浓度,然后向水中充氧至水中溶解氧浓度为10~12 mg/L。用溶氧检测仪(美国YSI DO200)监测水中溶解氧的浓度,当氧气的浓度低于10mg/L时就向水体中充氧,以维持溶解氧的浓度。每24h全部换水一次,用水为含有与各个试验梯度相同浓度(溶氧、亚硝酸盐、氨氮)的水。试验中不投饵。
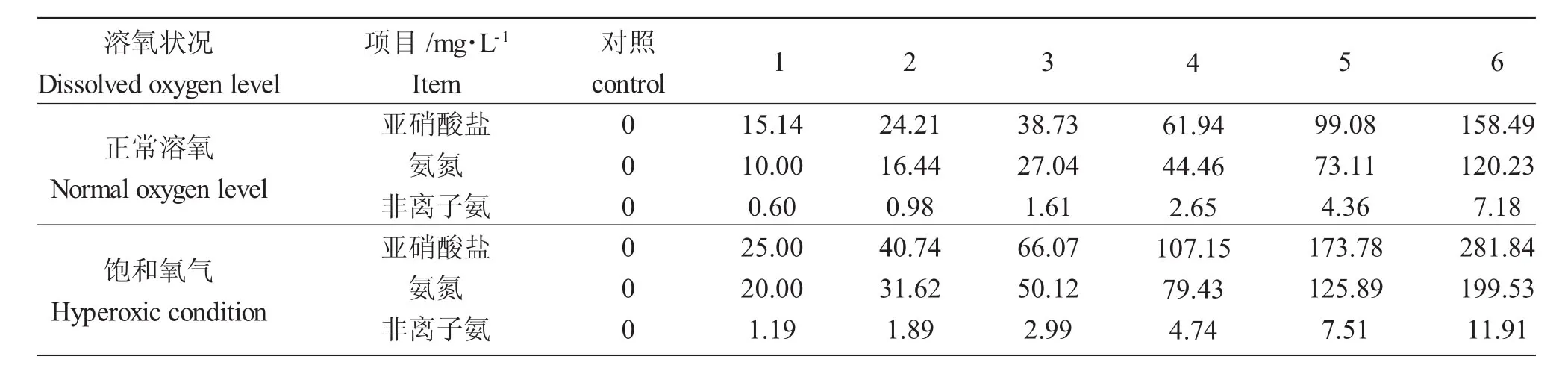
表1 试验中各组的氨氮和亚硝酸盐浓度Tab.1 The various concentrations of ammonia nitrogen and nitrite in the experiment
同时进行正常氧条件下的毒性试验,水体中溶解氧浓度维持在6.0~7.0mg/L,除了不向水体充氧外(当氧气的浓度低于5mg/L时向水体中充空气),其他试验步骤与过饱和溶氧条件下的毒性试验相同。
试验中检查、记录各个试验组河蟹的死亡情况,触动5s,河蟹无任何生理反应即视为死亡。
移民工程相关数据采集需要将经过评估后的移民基础开发数据导入程序和数据录入编辑工具,进行有效数据集中。首先将基础评估数据通过Excel文件直接存入数据库,根据收集到的实物指标和调查阶段数据,进行数据集中收录。为了减少数据录入工作量,提高工作效率,整个数据导入以Excel文件格式形式保证文件数据和数据库列表数据完全一致。通过Excel软件内部的COM组件,根据相应操作规则,对数据格式源文件进行文件域名检测,完全合格后,即可进行数据导入,其整体流程如图3。
1.3 数据处理与统计
采用SPSS18.0 Litchfied-Wilcoxon法(非参数检验法)计算不同溶氧浓度下氨氮(非离子氨)、亚硝酸盐对河蟹 24h、48h、72h、96h 的半致死浓度(LC50)和安全浓度(SC),按下式计算安全浓度:SC=0.1×96hLC50[8]
氨氮浓度为水体中的总氨氮浓度,采用《淡水水质标准》(GB3097-1997)规定的换算公式求得,由离子氨和非离子氨两部分组成,非离子氨的含量计算公式如下[9]。

其中,pKa=0.09018+2729.92/T(T为开氏温度,T=273+t℃)
2 结果与分析
2.1 中毒症状
试验结果表明:氨氮和亚硝酸盐对河蟹均有毒性,中毒症状类似。在最高浓度的氨氮和亚硝酸盐组中,从0.6h至lh开始呈现中毒征兆:河蟹最后一对步足拖着在水底来回爬动,其他步足频繁触碰盆壁,大约4h后,河蟹活动能力减弱,只有螯和步足轻微颤动,随着时间的延长,逐渐静止不动直至死去。较低浓度组的河蟹出现上述中毒症状的时间明显推迟,浓度越低出现中毒症状的时间越晚。
2.2 非离子氨对河蟹的毒性
2.2.1 正常溶氧条件下NH3对河蟹的毒性
进入正常溶氧条件下低浓度非离子氨组(低于1.61mg/L)的河蟹吐水频繁,活动明显,1.5h后活动能力减弱,只有步足轻微抖动,频繁碰触盆壁,3h后身体蜷缩,待在水底不动。3.5h后开始死亡,随时间的推移,24h后的死亡率为25%;高浓度NH3组(高于2.65mg/L)中毒症状同上,1h后开始死亡,24h的死亡率接近40%,96h后的死亡率在80%以上(表2)。正常氧条件下 NH3对河蟹的 24h、48h、72h 和96h LC50(95%可信限)分别为4.85mg/L(7.81~10.92 mg/L)、3.51mg/L(6.37~9.06mg/L)、2.74mg/L(5.37~7.95mg/L)和 2.00mg/L(3.96~7.30mg/L),安全浓度为 0.20mg/L(表 4)。

表2 正常溶氧条件下NH3对河蟹的毒性Tab.2 The acute toxicity of nonionic ammonia to Chinese mitten handed crab Eriocheir sinenisis at normal dissolved oxygen level
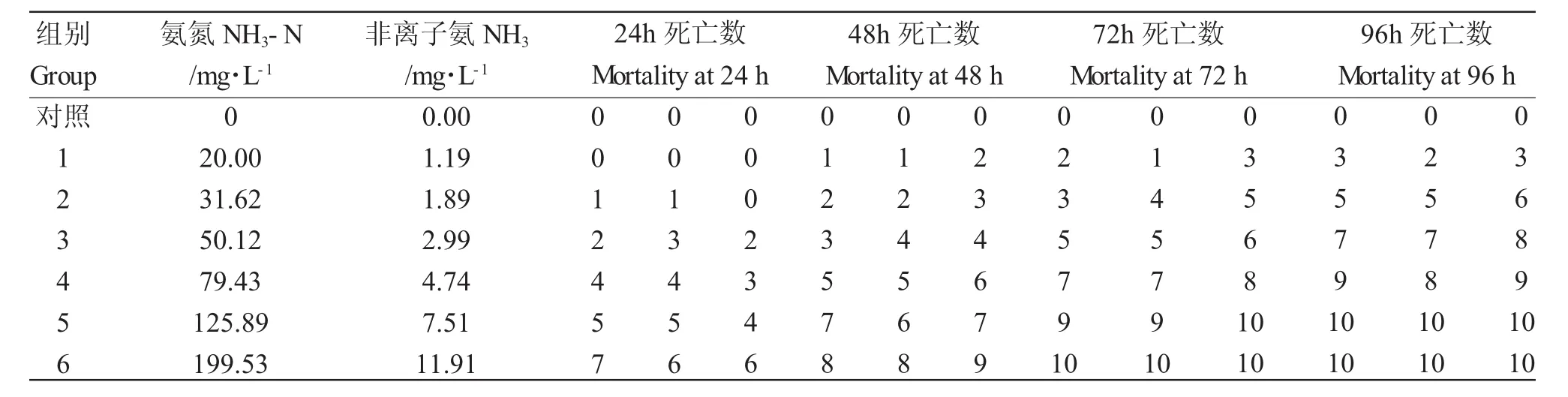
表3 过饱和溶氧浓度下NH3对河蟹的毒性Tab.3 The acute toxicity of nonionic ammonia to Chinese mitten handed crab Eriocheir sinenisis under hyperoxic conditions
2.2.2 过饱和溶氧条件下NH3对河蟹的毒性
在过饱和溶氧条件下低浓度NH3组(低于2.99mg/L)的河蟹0.5h后吐水频繁,活动明显,3h后活动力减弱,步足轻微颤动,频繁触碰盆壁,12h后身体蜷缩,待在水底不动。14h后开始出现死亡,随着时间的推移,24h后的死亡率约为20%;高浓度NH3组(高于4.74mg/L)中毒症状同上,2h后开始死亡,30h死亡率达50%,96h后死亡率为95%左右(表3)。由表4可知,过饱和氧条件下NH3对河蟹的24h、48h、72h和96h LC50(95%可信限)分别为8.07mg/L(13.31~17.56mg/L)、5.69mg/L(11.10~15.11 mg/L)、3.80mg/L(7.60~12.17mg/L)和 3.15mg/L(6.22~11.91mg/L),可见,过饱和氧使NH3对河蟹的半致死浓度大幅度提高,NH3的安全浓度为0.32 mg/L,为正常氧含量条件下的1.6倍。
2.3 亚硝酸盐对河蟹的毒性
2.3.1 正常溶氧条件下NO2-N对河蟹的毒性
在正常溶氧条件下,低浓度NO2-N组(低于38.73mg/L)的河蟹活动频繁,2h后活动能力减弱,只有螯和步足轻微抖动,待在水底不动,6h后开始出现死亡,12h的死亡率为20%;高浓度亚NO2-N组(高于61.94mg/L)中毒症状同上,2h后开始出现死亡,40h后死亡率达到 50%,72h后死亡率为100%(表5)。正常溶氧条件下,NO2-N对河蟹的24h、48h、72h和96 hLC50(95%可信限)分别为109.39 mg/L(169.30~218.33mg/L)、75.77mg/L(125.30~181.64 mg/L)、59.90mg/L(105.41~157.19mg/L)和 52.69 mg/L(92.00~153.28mg/L),SC 为 5.27mg/L(表 7)。
2.3.2 过饱和溶氧条件下NO2-N对河蟹的毒性
过饱和溶氧条件下低浓度NO2-N组(低于66.07mg/L)的河蟹1.5h时活动频繁,4h后活动能力减弱,仅螯和步足轻微的抖动,约8h后待在水底不动,12h后开始出现死亡,48h的死亡率为30%;高浓度NO2-N组(高于107.15mg/L)的河蟹0.5h开始出现上述中毒症状,3h后开始出现死亡,48h的死亡率为50%,96h后死亡率为90%(表6)。过饱和溶氧条件下,NO2-N对河蟹的24h、48h、72h和96h LC50(95%可信限)分别为182.41mg/L(295.21~403.57 mg/L)、131.92mg/L(234.16~293.98mg/L)、102.60mg/L(192.72~280.39mg/L) 和 80.61mg/L(143.92~267.51mg/L),较正常溶氧条件有大幅度提高。过饱和溶氧条件下,SC为8.06mg/L,为正常氧条件下的1.53倍(表7)。

表4 NH3对河蟹的半致死浓度(LC50)和安全浓度(SC)Tab.4 The LC50and SC values of non-ionic ammonia for Chinese mitten handed crab Eriocheir sinenisis

表5 正常溶氧条件下NO2-N对河蟹的毒性Tab.5 The acute toxicity of nitrite to Chinese mitten handed crab Eriocheir sinenisis at normal dissolved oxygen level
3 讨论
3.1 NH3的毒性危害

多种甲壳动物的氨氮和NH3的LC50和SC已有报道,如红螯螯虾Cherax quadricarinatus[11]、克氏原螯虾Procambarus clarki[14]以及河蟹幼体[15]。本试验结果表明:在正常溶氧含量下NH3对河蟹24h、48h、72h和 96h的 LC50分别为 4.85mg/L、3.51mg/L、2.74 mg/L和2.00mg/L,SC为0.20mg/L。石俊艳等[15]研究结果显示:NH3对河蟹大眼幼体在4个时间段的LC50分别为 8.2mg/L、5.67mg/L、2.87mg/L和1.85mg/L,SC为0.185mg/L。本结果与之接近但又略有差异,这可能与试验动物的规格等有关。钟君伟等[16]认为,水产动物规格越大,其氨氮耐受力越强。在过饱和氧条件下,NH3对河蟹 24h、48h、72h和 96h的 LC50分别为 8.07mg/L、5.69mg/L、3.80mg/L 和 3.15mg/L,SC为0.32mg/L,是正常溶氧条件下的1.6倍。Thurston等[17]研究结果表明,随着溶解氧含量的降低,虹鳟Oncorhynchus mykiss呼吸频率增加,进入鱼体内氨量增大,毒性增强,证实了NH3的毒性与溶解氧浓度呈负相关。当水体中的溶解氧升高后,可以直接影响进入血液中非离子氨的量,增强血液的载氧能力和机体对NH3的代谢能力,降低了NH3的毒性作用[18]。水中溶氧增加后,可促进N的循环,加速将氨氮氧化成无毒的硝酸盐。NH3所占的比例不仅与溶氧有关,也与水体温度、pH及盐度有关。因此,在其他条件相同的情况下,提高水体中的溶解氧浓度可大幅度提升河蟹对氨氮和NH3的耐受能力。

表6 过饱和溶氧条件下NO2-N对河蟹的毒性Tab.6 The acute toxicity of nitrite to Chinese mitten handed crab Eriocheir sinenisis under hyperoxic conditions

表7 NO2-N对河蟹的半致死浓度LC50和安全浓度SCTab.7 The LC50and SC values of nitrite for Chinese mitten handed crab Eriocheir sinenisis
3.2 亚硝酸盐的毒性危害
亚硝酸盐是养殖水体中另一种常见的含氮毒性污染物,是氨氮在细菌硝化作用过程或硝酸盐在反硝化作用过程中产生[19]。NO2-N进入水生动物血液后,作为强氧化剂将血液中血红蛋白分子的Fe2+氧化成Fe3+,使血红蛋白失去载氧能力,造成有机体组织缺氧、代谢紊乱、神经麻痹甚至窒息死亡[20]。石俊艳等[15]研究显示:亚硝酸盐对河蟹3期和5期溞状幼体(Z3、Z5)、大眼幼体的SC分别为0.993、1.754和2.086 mg/L。江敏等[6]研究表明:亚硝酸盐对河蟹 3 期、4 期和 5 期溞状幼体(Z3、Z4、Z5)的 SC分别为 0.713 mg/L、1.348 mg/L、2.173 mg/L。本试验正常溶氧条件下,亚硝酸盐对幼蟹的SC是5.27mg/L,这与以上结果相差较大。这可能与河蟹的规格有关,河蟹规格越大,耐受亚硝酸盐的能力越强。本试验在氧气过饱和条件下亚硝酸盐的SC是8.06 mg/L,较正常溶氧条件下高53%。亚硝酸盐是氨转化为硝酸盐的中间产物,当水中溶解氧充足时,NO2-N在硝化细菌的作用下转化成毒性较小的硝酸盐,但在缺氧时反硝化菌可能会将其转化成毒性更强的NH3-N[6]。水体中溶解氧浓度的升高可以降低进入血液的NO2-N含量,提高血液的载氧能力和鱼体对NO2-N的代谢能力,降低了亚硝酸盐对鱼体的毒性[21]。
3.3 影响非离子氨和亚硝酸盐毒性的因素
影响NH3和NO2-N对水生动物毒性的因素可分为生物因素(水生动物的种类、发育阶段与规格及生理活动等)和非生物因素(栖息环境如水温、盐度、溶解氧含量和水质等)[7]。
NH3和NO2-N对不同种类水生动物的毒性相差巨大。本试验结果表明:正常溶氧条件下,河蟹对NH3较NO2-N更为敏感,毒性更易受过饱和氧的影响,这可能与两者对河蟹的致毒原理有关。养殖水体中高溶氧能有效抑制NH3和亚硝酸盐的产生,使有毒的NH3-N和NO2-N转化为无毒的硝酸盐,高浓度的溶解氧可以提高河蟹对NH3-N和NO2-N的耐受力。因此,在河蟹养殖中,可通过换水、种植水草、安装微孔增氧管和使用微生态制剂调水等方法增加养殖水体的溶解氧,来降低NH3和NO2-N对河蟹的毒性。
3.4 结论
正常溶氧条件下,非离子氨和亚硝酸盐对河蟹幼蟹的SC分别为0.20 mg/L和5.27 mg/L,而氧气过饱和条件下则分别为0.32mg/L和8.06mg/L。水体溶解氧浓度的升高可增强河蟹对非离子氨和亚硝酸盐的耐受能力。因此,在河蟹养殖中提高水体的溶解氧,可降低非离子氨和亚硝酸盐对河蟹的毒性效应,有利于河蟹的生长与健康。
