噬菌体在鲑鳟鱼细菌病治疗中的应用研究进展
2019-08-13曹永生李绍戊王荻卢彤岩牟振波
曹永生 ,李绍戊 ,王荻 ,卢彤岩 ,牟振波
(1.中国水产科学研究院黑龙江水产研究所,黑龙江 哈尔滨 150070;2.西藏自治区农牧科学院水产科学研究所,西藏 拉萨 850032)
近年来,细菌性疾病严重影响了我国鲑鳟鱼健康养殖[5],采用抗生素和化学药物配合治疗多是凭经验估计,不仅产生了多重耐药性菌株[6],也易引发食品安全问题。噬菌体可以“捕食”细菌,而与细菌耐药性无关,为解决耐药性问题带来了新的希望。
噬菌体较耐酸碱,可拌料投喂口服免疫,减少了免疫操作的工作量,避免了人为操作对鱼体的应激损伤[7];皮肤或鳃的细菌性疾病,则可采用药浴[8]。噬菌体对治疗鱼类细菌性疾病很有吸引力。本文通过综述鲑鳟鱼致病菌相关噬菌体的生物学特性、作用机理、研究现状和应用前景、问题及应对措施,以期为鲑鳟鱼类细菌病噬菌体疗法研究提供参考。
1 噬菌体的生物学特性
噬菌体能够感染细菌,是地球上含量最丰富的微生物。据估算,其总量达1031个数量级[9]。与其他病毒一样,噬菌体不具有细胞结构,依靠宿主的细胞成分和功能进行自身复制,产生子代。目前已知超过95%的噬菌体由具有尾部的蛋白衣壳包裹的线性、双链DNA组成,其余的噬菌体由无尾部衣壳包裹的双链DNA、单链DNA或RNA组成[10]。
根据形态和核酸类型,国际病毒分类委员会(International Committee on Taxonomy of Viruses,ICTV)将噬菌体分为尾病毒目Caudovirales和套式病毒目Nidovirale。根据尾部结构的长度和是否可伸缩,尾病毒目进一步分为尾部长而可伸缩的肌病毒科Myoviridae、尾部长而不可伸缩的管状病毒科Siphoviridae和尾部短而不可伸缩的短尾病毒科Podoviridae。
噬菌体的生活周期可分为两种,即裂解周期和溶原周期。烈性噬菌体通过受体识别,吸附于细菌表面,向细胞内注入自身遗传物质,利用宿主胞内的分子构建自身及酶类等物质,进行基因组复制和病毒蛋白的合成与加工,组装子代噬菌体,裂解细菌,释放子代噬菌体,完成噬菌体的裂解周期。温和噬菌体不急于裂解细菌,而是将其基因组在特定的位置插入到宿主染色体中,所插入的噬菌体基因组称为前噬菌体,含有溶原体的细菌细胞称为溶原体,前噬菌体随着细菌基因组的复制而复制,稳定存在于细菌基因组中。在细菌遭受刺激和不良环境影响时,溶原周期终止,进入裂解周期。前噬菌体的插入,通常会改变细菌的特性。有证据表明,细菌毒力基因和耐药性很可能与前噬菌体所携带的基因片段有关。因此,治疗细菌感染所用噬菌体必须为能裂解细菌的烈性噬菌体,且不能含耐药性、致病性和溶原化的基因片段[11]。
2 噬菌体治疗的优势及其作用机理
与抗生素相比,噬菌体治疗细菌病主要有以下优势:①能杀灭耐药菌。噬菌体通过感染-繁殖-裂解循环周期杀灭细菌,与细菌是否耐药无关;②特异性强,对除致病菌外的其他细菌无杀伤,对机体正常菌群基本无影响;③低毒、对环境影响小。噬菌体基本不引起强烈的机体反应,杀灭宿主菌后可自行消失;④噬菌体分离快速、成本低廉,且分布广泛,常与细菌相伴存在,用宿主菌为诱饵可在水、土壤和动物体内快速分离目标噬菌体;⑤接种途径多样,可通过口服、气雾、浸泡和注射等方式给药。
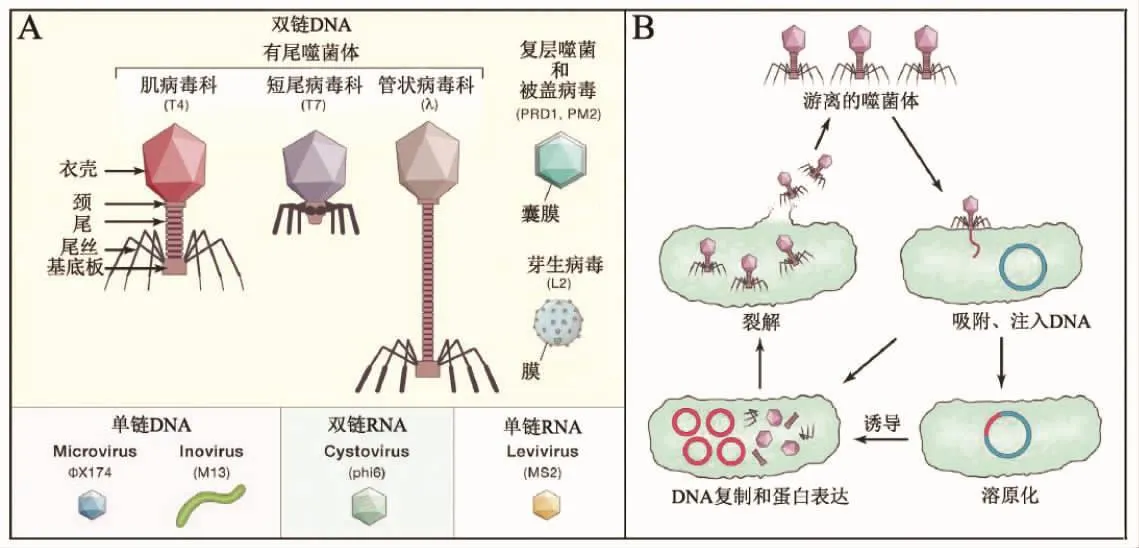
图1 噬菌体的分类(A)及生活周期(B)[10]Fig.1 The classification(A)and life cycle(B)of phages
纯化的噬菌体可直接用于治疗细菌性疾病。噬菌体在受体识别、DNA无法注入和无法合成自身所需物质等因素的影响下往往出现宿主谱较窄的情况[12]。窄的宿主范围可避免噬菌体对机体内正常菌群的副作用,但也限制了其对细菌的有效杀伤范围。所以,通过持续的筛选和鉴定,积累对细菌不同菌株具有裂解作用的噬菌体,将几种特异性较强的噬菌体以鸡尾酒法配合使用是确保噬菌体专一并有效的方法[13]。也可在掌握噬菌体的遗传背景和基因组结构的基础上,用分子生物学方法改造噬菌体,以拓宽其宿主谱[14]。采用直接疗法必须保证噬菌体全程具有活性,这需要充分了解所用噬菌体的理化和裂解特性。例如,对氯仿、温度和乙醚的耐受程度决定了噬菌体制备方案;最佳感染条件及其复制曲线决定了噬菌体的使用条件和方式[15]。
王星宇 男,1994年生于四川绵阳.现为空军工程大学信息与导航学院硕士研究生.主要研究方向为卫星通信,多址接入控制技术.
在解析了噬菌体的裂解机制后,可利用噬菌体中具有裂解活性的成分来杀灭细菌。裂解活性成分主要有穿孔素和裂解酶等。在细胞内复制到后期时,噬菌体可通过自身编码蛋白(穿孔素)在细菌的细胞质膜打孔,改变胞壁质,便于裂解酶与肽聚糖接触,发挥裂解作用。穿孔素的一级结构不保守,但氨基酸水平的差异不影响其发挥能。穿孔素主要由疏水跨膜区(hydrophobic transmembrane domain,TMD)和羧基端带有高电荷的亲水区组成。穿孔素分为三类:I类由95个以上的氨基酸组成,含有3个TMDs,金黄色葡萄球菌Staphylococcus aureus噬菌体和大肠杆菌Escherichia coli噬菌体λ的穿孔素均属于此类型;II类的长度为65~95个氨基酸,包含2个TMDs,如产气荚膜梭菌Clostridium perfringens噬菌体的穿孔素;III类穿孔素只有1个TMD,如噬菌体ΦCP26F穿孔素[16]。
裂解酶是噬菌体感染后期产生的一种细胞壁水解酶。肽聚糖是细菌细胞壁的重要组分,能保证细胞渗透压正常,一旦遭到破坏,细菌因渗透压的改变而裂解。噬菌体感染后期,穿孔素在细胞膜上打完孔,裂解酶穿过细胞膜接触并水解肽聚糖,引起细菌破裂,释放子代噬菌体[17]。裂解酶从外部直接接触到细菌肽聚糖也可引起细菌崩解。革兰氏阳性菌的细胞壁由90%的肽聚糖和10%的磷壁酸组成,肽聚糖易与裂解酶接触,而革兰氏阴性菌的细胞壁除肽聚糖外,还有脂类和蛋白,肽聚糖含量少且不易与裂解酶接触。因此,裂解酶主要应用于革兰氏阳性菌,但最近也有报道能裂解革兰氏阴性菌的裂解酶[18]。革兰氏阳性菌噬菌体裂解酶通过胞壁结合区(cell wall binding domain,CBD)与细菌结合,之后通过酶活区(enzymaticallyactive domain,EAD)特异性地破坏肽聚糖化学键,水解肽聚糖。革兰氏阴性菌的裂解酶则为仅含EAD的球形蛋白,以便穿过细菌外部的脂多糖和蛋白质,到达肽聚糖处[19]。
噬菌体穿孔素和裂解酶只攻击特定细菌,直接溶解细菌,不涉及到噬菌体复制过程,不易受宿主谱的限制和变异的影响。穿孔素和裂解酶本质为蛋白质,能借助现有的成熟体系大量生产、纯化和评价,可避免人们对直接采用本质为病毒的噬菌体治疗的担忧,具有良好的应用前景。
3 噬菌体在鲑鳟鱼致病菌治疗中的应用
近些年,针对鲑鳟鱼细菌病病原的噬菌体分离、鉴定和应用研究取得了一些进展,现按病原分类叙述。
3.1 嗜水气单胞菌Aeromonas hydrophila
嗜水气单胞菌为一种运动型革兰氏阴性杆菌,可引起鳃、脑、心、肠道、肾脏和肝脏等局部病变的败血症,发病率和死亡率很高[20],是我国淡水养殖鱼类的主要病原菌之一。
噬菌体pAh1-C和pAh6-C从河流水中分离获得,以嗜水气单胞菌(JUNAH)为宿主菌。经鉴定两株噬菌体均为肌病毒科,基因组为55kb和58kb的双链DNA。体外实验表明,pAh1-C和pAh6-C对鱼源致病性嗜水气单胞菌具有较高的裂解效力,潜伏期分别为30 min和20min,裂解量为60pfu/cell和10pfu/cell。给泥鳅Misgurnus anguillicaudatus一次接种上述两种噬菌体中的任一种均可显著提高嗜水气单胞菌感染的存活率,证实pAh1-C和pAh6-C在治疗鱼类嗜水气单胞菌病中具有良好的应用前景[21]。从污水中分离获得的嗜水气单胞菌致病株噬菌体VTCCBPA6属肌病毒科。根据衣壳蛋白基因gp23的进化分析和SDS-PAGE鉴定,可将其归为T4样病毒属。但根据gp23比对结果发现,VTCCBPA6与感染肠杆菌的T4样噬菌体更为接近,而不是感染气单胞菌的T4样噬菌体,说明该噬菌体是环境中出现感染嗜水气单胞菌的新型噬菌体[22]。为评价噬菌体控制嗜水气单胞菌引起的条纹鲶Pangasianodon hypophthalmus大量死亡的有效性,Le等从河水中分离获得了两株嗜水气单胞菌噬菌体。它们的宿主谱较广,甚至能够裂解多重耐药的嗜水气单胞菌分离株。其中一株噬菌体的潜伏期为10min,裂解量为213pfu/cell。该噬菌体的保护率可达到100%,对照组的存活率仅18.3%,证实所分离的噬菌体有成为防治气单胞菌病的新型制剂的潜力[23]。
3.2 杀鲑气单胞菌杀鲑亚种Aeromonas salmonicida subsp.salmonicida
杀鲑气单胞菌杀鲑亚种属于气单胞菌属,革兰氏阴性菌。感染后细菌可在心、肾脏、脾脏、肌肉和鳃等组织中聚集,引起组织病变。急性感染的鱼死亡时可能不呈现明显症状或病理变化,而在慢性感染阶段,鱼体可能昏睡、食欲不振和体表变黑,与大多数细菌性败血症相似。除了眼球突出外,腹鳍出血十分常见,特别是靠近胸基部、腹鳍和臀鳍区域,侧面骨骼肌可演变为液化性坏死和“血性疖疮”[24]。
噬菌体phiAS5不仅裂解耐药杀鲑气单胞菌杀鲑亚种,对气单胞菌属的其他细菌也有感染性。phiAS5基因组结构为线性双链DNA,全长22.5kb,G+C含量为43%,包含323个开放阅读框,69个启动子,33个转录终止区,24个tRNA编码基因。phiAS5的开放阅读框与T4样气单胞菌噬菌体同源性较高,与Aeh1亲源性最近[25]。Kim等证实气单胞菌噬菌体PAS-1对含有III型分泌系统的杀鲑气单胞菌AS05株具有裂解活性。在此基础上,用噬菌体PAS-1免疫虹鳟Oncorhynchus mykiss200h后,噬菌体被机体清除,此时可检测到短暂的抗PAS-1中和抗体,以感染复数为104的剂量免疫虹鳟可提高存活率、延长死亡时间,为PAS-1治疗杀鲑气单胞菌杀鲑亚种感染提供了关键临床数据[26]。GenBank中序列公开的12个烈性杀鲑气单胞菌杀鲑亚种噬菌体的基因序列比对结果表明,一些噬菌体的基因存在阳性选择;与宿主tRNA编码基因相比,噬菌体基因组G+C含量存在偏差。依宿主谱识别差异,12株噬菌体可分为三类,第一类噬菌体(编号59.1和56)的宿主谱较窄,只识别不超过5株宿主菌,第二类噬菌体(编号32、3、65.2和ASP37)的宿主谱居中,识别10-30株宿主菌,第三类噬菌体(编号IV-A和51)宿主谱较广,可裂解44株宿主菌,更适于临床应用[27]。
3.3 嗜冷黄杆菌Flavobacterium psychrophilum
嗜冷黄杆菌是黄杆菌属的革兰氏阴性菌,可引起虹鳟幼鱼综合症(RTFS)或细菌性冷水病。该菌主要感染幼鱼,病鱼近尾鳍部坏死,伴有大量粘液,剖检可见腹水、肠道炎症、脾肿大和肝脏变色。感染鱼和死亡鱼均可向水中释放细菌,通过外伤感染其它鱼体[28]。
2008年Stenholm等自丹麦一个虹鳟养殖场分离出了22株嗜冷黄杆菌噬菌体。它们的基因组大小不尽相同,主要为 8.5~12kb、48kb 和 90kb,分别识别23株嗜冷黄杆菌中的5~23株细菌。18株噬菌体具有各自的宿主谱,每个噬菌体对不同细菌的裂解活性、释放量、潜伏期明显不同。噬菌体FpV-5、FpV-6、FpV-8、FpV-9 和 FpV-11 的宿主谱较广,FpV-9的感染效率最高,特别是将FpV-4、FpV-9和FpV-21的鸡尾酒式组合可感染27株本地分离的嗜冷黄杆菌中的24株,具有良好的应用价值[29]。Madsen等用嗜冷黄杆菌及其噬菌体免疫虹鳟幼鱼。细菌和噬菌体自分离至免疫10d后,发现同时接种细菌和噬菌体时噬菌体在鱼体内存留时间长于单独注射噬菌体。细菌和噬菌体主要存在于肾脏和脾脏,偶见于脑部。pH4.5~7.5时对噬菌体感染活性影响较小,但pH3时其活性消失,在无宿主菌时,噬菌体在未处理湖水中保存55d后感染活力降低104倍;保存于至-80℃甘油中仍具有感染活性,而保存于20℃时活性降低10倍。噬菌体与鱼饲料混合时,对其感染活性影响较小。上述结果表明,噬菌体可用于治疗嗜冷黄杆菌的感染,伴药饵投喂可能是有效方法[30]。
序列比对结果表明,丹麦和智利的嗜冷黄杆菌噬菌体基因组大小39.302~89.01kb,GC含量27%~32%,丹麦噬菌体分离株不含有溶原化基因,而智利分离株为温和噬菌体。根据基因组成和含量,上述噬菌体可分为3个不同的基因簇,表明嗜冷黄杆菌噬菌体的遗传多样性有限,结构蛋白的氨基酸序列的不一致性达25%,可能与宿主菌的特异性决定有关[31]。
3.4 柱状黄杆菌Flavobacterium columnare
柱状黄杆菌为黄杆菌属的革兰氏阴性菌,可感染包括鲑鳟鱼在内的淡水鱼,引起“柱形病”。感染鱼早期呈非特异性,即昏睡、食欲不振,浮游于水面;特异性症状为皮肤变色、背鳍损伤、鳃小片尖端损伤,鳃坏死呈黄色。该病亦可由病鱼水平传播至健康鱼[32]。FCL-2为感染柱状黄杆菌的噬菌体,基因组大小为47142bp,GC含量为30.2%。比较结构蛋白发现,FCL-2与噬纤维菌属噬菌体phiSM亲缘关系最近。攻毒实验结果表明,虹鳟经FCL-2免疫后存活率(50%)显著高于对照组(8.3%),仅向循环水养殖系统中加入1次噬菌体就可使虹鳟免于柱状黄杆菌感染[8]。
3.5 鲁氏耶尔森菌Yersinia ruckeri
鲁氏耶尔森菌是革兰氏阴性肠杆菌,是鲑科鱼类肠炎红嘴病的主要病原。该菌宿主范围广,大多数鲑都易感,急性感染时,鱼种无明显症状,死亡率却很高;慢性感染时,鱼体色改变、功能失调和昏睡等,伴有腹水、眼球突出、皮肤淤血和鳃丝尖端局部出血。粘膜下层充血导致口腔和下颌充血,但并不是所有病鱼都出现这种症状。该病可水平传播,许多无症状带菌鱼和鸟类都可携带、储备鲁氏耶尔森菌[33]。Ahmadpour等自疑似肠炎红嘴病的病鱼中分离鲁氏耶尔森菌,也尝试在虹鳟养殖水体或污水处理厂水体中分离针对该菌的噬菌体,经双层琼脂法确定,所分离的噬菌体对鲁氏耶尔森菌具有裂解活性。Maragheh污水处理厂噬菌体分离株滴度最高,而Urmia污水处理厂所分离的噬菌体滴度最低。提取基因组DNA并利用限制性内切酶MspI进行切割,发现所分离的噬菌体基因组DNA切割后条带类似,基因组总长均小于λ噬菌体基因组。这表明污水处理厂可能是获得裂解鲁氏耶尔森菌噬菌体的重要来源[34]。
3.6 荧光假单胞菌Pseudomonas fluorescens
荧光假单胞菌为假单胞菌属革兰氏阴性杆菌,在自然环境中分布广泛,是感染野生或养殖鲑的条件致病菌。该菌可呈现慢性感染、无症状感染和急性出血性坏死,死亡率较高(>15%)。病鱼眼球突出、烂鳍、烂鳃、边缘出血性皮肤溃疡、两侧瘀点和体表变黑[35]。VW-6S和VW-6B为自中国纳帕海高原湿地分离获得的可感染荧光假单胞菌的噬菌体。电镜观察显示,这两株噬菌体的头部和长尾结构呈二十面体(分别为66.7nm和61.1nm),属管状病毒科。两株噬菌体的基因组大小为30~40kb,VW-6S的潜伏期和暴发期分别为60min和30 min,而VW-6B的潜伏期和暴发期均为30 min,二者感染的最适pH分别为8.0和10.0,温度高于60℃时活性迅速降低[36]。Radhakrishnan等从污水和土壤中分离获得了7株荧光假单胞菌噬菌体,分析了其宿主谱、形态、结构蛋白和基因组,发现5#噬菌体在污水中含量丰富(5.9×107pfu/mL),宿主谱较广,其结构蛋白和DNA带型与其他六株噬菌体明显不同,根基土壤周围的荧光假单胞菌分离株对污水中的噬菌体不敏感[37]。
3.7 金黄杆菌Chryseobacterium spp.
金黄杆菌是黄杆菌属的革兰氏阴性菌,广泛存在于环境中,近年来在患病虹鳟和大西洋鲑Salmo salar中均分离到该菌。病鱼体侧、肛门或尾柄处的皮肤和肌肉溃疡性病变[38]。从密歇根湖水中分离获得了 ΦFenriz、ΦHabibi、ΦMoody和 ΦVader四株噬菌体,均以大肠杆菌(ATCC8739)为宿主菌。与先前发现的噬菌体不同的是,这四株噬菌体可裂解包括金黄杆菌在内的五种不同门类的细菌(其他四种为绿脓杆菌Pseudomonas aeruginosa、大肠杆菌Escherichia coli、杆菌Arthrobacter sp.和微杆菌Microbacterium sp.)。它们的基因组大小均为65Kb左右,GC含量为54.9%左右,与绿脓杆菌噬菌体PB1聚为一类,推测这四株噬菌体的泛宿主谱特性可能与密歇根湖贫瘠自然环境所推动的竞争机制有关[39]。
4 噬菌体在鲑鳟鱼细菌病防控应用中面临的挑战
虽然噬菌体可直接杀死细菌,与细菌耐药性无关,也不影机体正常的菌群结构,具有良好的应用前景,但用噬菌体治疗鲑鳟鱼细菌病仍面临着一些有待解决的问题。
4.1 噬菌体的“脱靶”问题
细菌和噬菌体作为对手,常伴而行,通过各自的进化获得生存。为了保证噬菌体有效杀灭细菌,必须充分考虑噬菌体失效的诸多可能,做好应对准备。细菌的变异非常迅速,可通过阻止噬菌体吸附、利用限制性修饰系统切割噬菌体核酸、利用CRISPR/Cas防御系统切割噬菌体DNA、通过利他性自杀引起顿挫型感染和通过环境QS信号控制受体基因表达、降低高密度时细胞对噬菌体感染的敏感性等多种方式产生噬菌体抗性[12]。噬菌体的宿主范围有限,一种噬菌体仅能感染同一种细菌的若干菌株,甚至仅能感染一株细菌。为了防止噬菌体失效,持续分离噬菌体,尽可能扩大保藏容量,使噬菌体的宿主范围能覆盖流行菌株,是较为有效的应对方法。根据现有报道,可以优化分离策略以增加获得广谱噬菌体的可能。选择宿主菌时,不要仅选择一种细菌,而要采用混合宿主菌[40];分离来源要选择污水或贫瘠自然环境的水体[39]。用测序方法获得噬菌体的基因组信息,在此基础上进行基因工程改造也可增强噬菌体对细菌的识别性[41]。
人工合成噬菌体的裂解酶和溶菌酶是目前治疗细菌感染的研究热点,然而,鲑鳟鱼的致病菌几乎都为革兰氏阴性菌。它们的细胞壁结构复杂,裂解酶或溶菌酶在体外难以与目标分子接触。因此,用裂解酶或溶菌酶治疗鲑鳟鱼细菌病有一些局限性。利用EDTA、柠檬酸和苹果酸增加细菌外膜通透性,可使裂解酶杀灭革兰氏阴性菌,但这种方法难以临床应用[42]。能杀灭革兰氏阴性菌的裂解酶分子量较小,仅含EAD的球形蛋白,可以参照现有提高溶菌酶抗革兰氏阴性菌活性的方法,用不同蛋白酶水解裂解酶或溶菌酶,获得兼具裂解活性和穿透性的最小活性片段后,利用凝胶过滤色谱分离和液质联用鉴定活性最高的水解产物,利用其他分子生物学手段进行强化,即可保持裂解酶或溶菌酶原有抗菌能力,又能使发酵产品稳定[43]。
4.2 噬菌体的“安全性”问题
与抗生素不同,噬菌体为活的病毒,人们往往担忧应用噬菌体的安全性。(1)噬菌体与机体免疫系统之间的关系。有尾噬菌体诱导较弱,甚至不诱导机体免疫反应。更有实验表明,即使连续三次使用噬菌体ΦX174,大多数病人也未有不良反应,仅有少部分有皮疹、头痛和发烧等轻微症状[44]。还有更为详尽的实验数据。例如Hong等分别以高剂量(107PFU)和低剂量(105PFU)大肠杆菌O157:H7噬菌体免疫小鼠,发现免疫组小鼠的细胞因子水平与未免疫小鼠相当,与剂量无关,说明噬菌体免疫并未引起急性免疫反应。在另一个实验中,口服抗生素和噬菌体免疫3周龄猪两周后,两个处理组间的微生物种群差异不显著[45]。但有学者认为,噬菌体作为异源微生物进入机体后,同样可被宿主的免疫系统所识别,诱导机体免疫反应,甚至产生中和抗体。机体的这种免疫防御会干扰噬菌体发挥效应,而记忆免疫反应则会影响噬菌体的后续使用[46]。(2)噬菌体感染细菌后,在细胞内大量复制,后期裂解细胞使细菌内容物(包括内毒素)局部大量释放,而随着噬菌体大量产生子代,再次裂解细菌,这种不受控制周而复始的循环易引起炎症或过敏性反应,形成组织损伤。为了避免细菌内毒素大量释放,Paul等[47]利用基因工程方法使金黄色葡萄球菌噬菌体P954的裂解酶失能,制备了丧失裂解力的重组噬菌体。这种突变噬菌体与野生型识别的宿主范围并无差别,可感染细菌,但并不会使细菌细胞裂解,而用其免疫时,可使小鼠完全抵抗致死剂量的金黄色葡萄球菌攻击。(3)噬菌体可通过水平基因转移获得遗传学物质。噬菌体可向细菌基因组插入基因片段,改变细菌的特性(增强毒力或耐药性)。如噬菌体自身含有耐药基因CTXΦ,原噬菌体对霍乱弧菌的毒力增强;噬菌体也可因其基因组整合细菌毒力基因片段而产生毒素[11]。可以利用PCR方法剔除基因组中含有溶原基因、细菌毒力基因或耐药基因的噬菌体,选择应用安全的烈性噬菌体。(4)目前还没有一套标准的噬菌体临床审批和评价体系,限制了噬菌体相关知识产权的成果转化与应用。伴随噬菌体的应用中的这些问题,噬菌体裂解酶本质为一种能够裂解细菌的蛋白质,可利用现有的蛋白质类生物制品的生产和评价方法而逐渐走入人们的视野。最新研究结果表明,裂解酶LysGH15可杀灭耐甲氧西林金黄色葡萄球菌,虽然它可使机体产生特异性抗体,但这些抗体并未阻断LysGH15的结合能力和裂解活性。即使抗体达到最高点时,LysGH15免疫也可有效攻击小鼠,抵御体内抗致死剂量的细菌,且可减弱促炎症因子的表达,又不引起明显的副反应和组织器官的病理变化[48],这就为噬菌体的未来应用提供了可行的参照方法。
5 小结与展望
随着养殖强度的加大和环境的恶化,鲑鳟鱼类细菌传染性疾病时常出现,导致鱼类的大量死亡和品质下降。频繁、不规范的使用抗生素导致了多重耐药菌的出现,也易引起食品安全问题。噬菌体为可杀灭细菌且与其耐药性无关的微生物,为鲑鳟细菌性疾病的生物防治提供了新的可能。应坚持对我国鲑鳟鱼主要致病菌噬菌体进行持续分离和保藏,深入研究掌握噬菌体的特性、解析噬菌体的裂解机制和鉴定有效的裂解成分、建立噬菌体疗法的效果和安全评价体系,利用新思路和新方法优化噬菌体的使用方式,助力噬菌体在我国鲑鳟细菌性疾病治疗中的应用。
