基于mRNA和miRNA芯片探索影响结直肠癌肝转移的靶基因
2019-07-17苏轶男
苏轶男
结肠直肠癌(CRC)是世界上第三种最常见的恶性肿瘤,也是导致癌症相关死亡的第四大原因[1]。据估计,全世界每年约有130 万CRC 新发病例和近70 万死亡病例[2],CRC 的发病率和死亡率随年龄增长而增加[3]。尽管CRC 诊断和治疗方法有所改善,但超过50%的患者在治疗后仍会出现转移[4]。肝脏是CRC 转移最常见的靶向器官,肝脏转移被认为是CRC 最致命的进展之一,同时肝转移是最关键的预后风险因素[5]。原发性CRC患者术后5年生存率为69.5%~95.7%,而CRC 肝转移患者的术后5年生存率降至27%~41%[6]。因此,尽早发现CRC肝转移对于患者的预后至关重要。转移是通过多步骤事件来实现的,并且一些mRNA 和miRNA 被认为与肝转移相关,例如金属蛋白酶1 组织抑制剂(TIMP-1)[7]和miRNA-21[8]。然而,目前CRC中肝转移的相关机制仍然不清楚,生物标志物欠缺。本研究分析了GEO数据库中关于CRC 肝转移的miRNA 和mRNA 表达谱数据,以期能够找到影响CRC 肝转移的相关基因,为CRC的实验和临床研究提供参考。
1 材料与方法
1.1 芯片数据 本研究所用的数据集均来源于NCBI 的GEO数据库(http://www.ncbi.nlm.nih.gov/geo/)[9]。mRNA表达数据编号为GSE30687,包括2个原发性CRC样本和2个CRC肝转移样本,检测平台为GPL571[HG-U133A_2]Affymetrix Human Genome U133A 2.0 Array。miRNA 表达数据编号为GSE44121,包括9 个原发性CRC 样本和9 个发生肝转移的CRC 样 本 ,基 于 GPL16231 Nanostring nCounter Human microRNA Expression Platform芯片进行检测。
1.2 芯片数据预处理 基于R软件(版本号:3.6)中的affy软件包(版本号:1.62.0)[10],首先将mRNA的原始数据转换成R语言中可识别格式。然后,通过Robust-Multi-Array(RMA)方法[11]进行背景矫正和标准化处理,最终得到标准化后的表达值矩阵,用于后续的差异表达分析。对于miRNAs数据,首先得到它们的表达值矩阵数据,再通过preprocess Core 函数包(版本号:1.46.0)对数据进行标准化处理。
1.3 差异表达mRNAs 和miRNAs 的筛选 通过与原发性CRC标本相比较,利用limma函数包筛选出肝转移CRC样品中的差异表达mRNAs 和miRNAs。筛选阈值为P<0.05 和|log2FC|>0.5。此外,在样品中进行了差异表达mRNAs的双向聚类分析。
1.4 基因功能富集分析 利用DAVID(Database for Annotation,Visualization and Integrated Discovery,https://david.ncifcrf.gov/)在线工具对差异表达mRNA 进行GO 功能和KEGG通路富集分析,最显著的GO功能和KEGG通路筛选标准为P<0.05。
1.5 miRNA-mRNA 调控网络构建 本研究利用TargetScan预测差异表达miRNA 可能调控的靶基因,形成miRNA-mRNA 调控关系对,并且筛选出包含差异表达mRNA 的miRNA-mRNA 关 系 对[12],利 用 Cytoscape 软 件[13]构 建miRNA-mRNA 调控网络图。此外,筛选出“节点度”≥1 的基因。“节点度”是指与该基因相关联的基因数。
2 结果
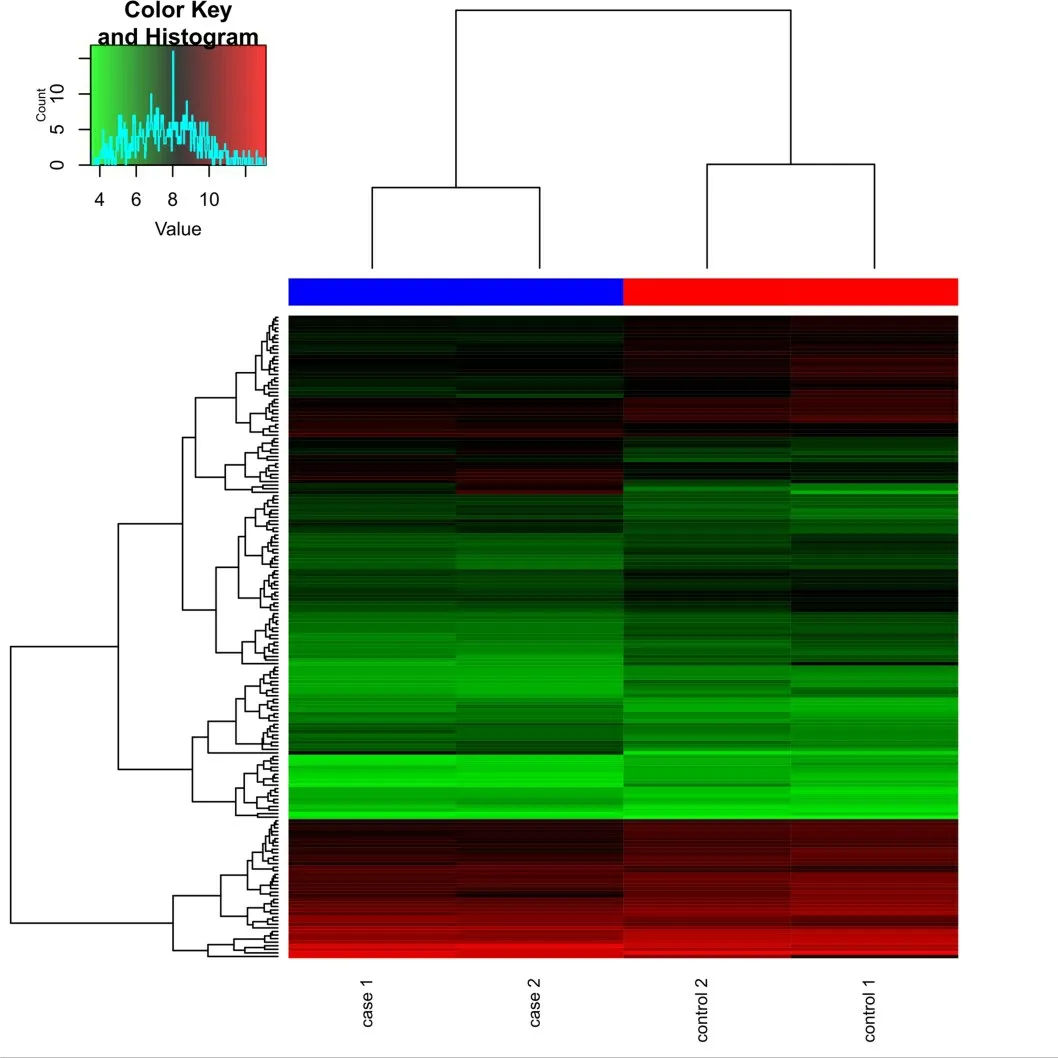
Fig.1 The two-way cluster graph of DEGs and four samples图1 差异表达mRNA和4个样本的双向聚类图
2.1 差异表达mRNA 和miRNA 在CRC 肝转移样本中发生差异表达的mRNAs 共180 个,其中表达下调的有116个,表达上调的有64个,其与mRNA表达数据中的4 个样本的双向聚类图,见图1。此外,与原发性CRC 样本相比,CRC 肝转移样本中的差异表达miRNAs共15个,其中6个miRNAs表达上调,9个miRNAs 表达下调。前30 个最显著的差异表达的mRNAs见表1;所有的差异表达miRNAs见表2。
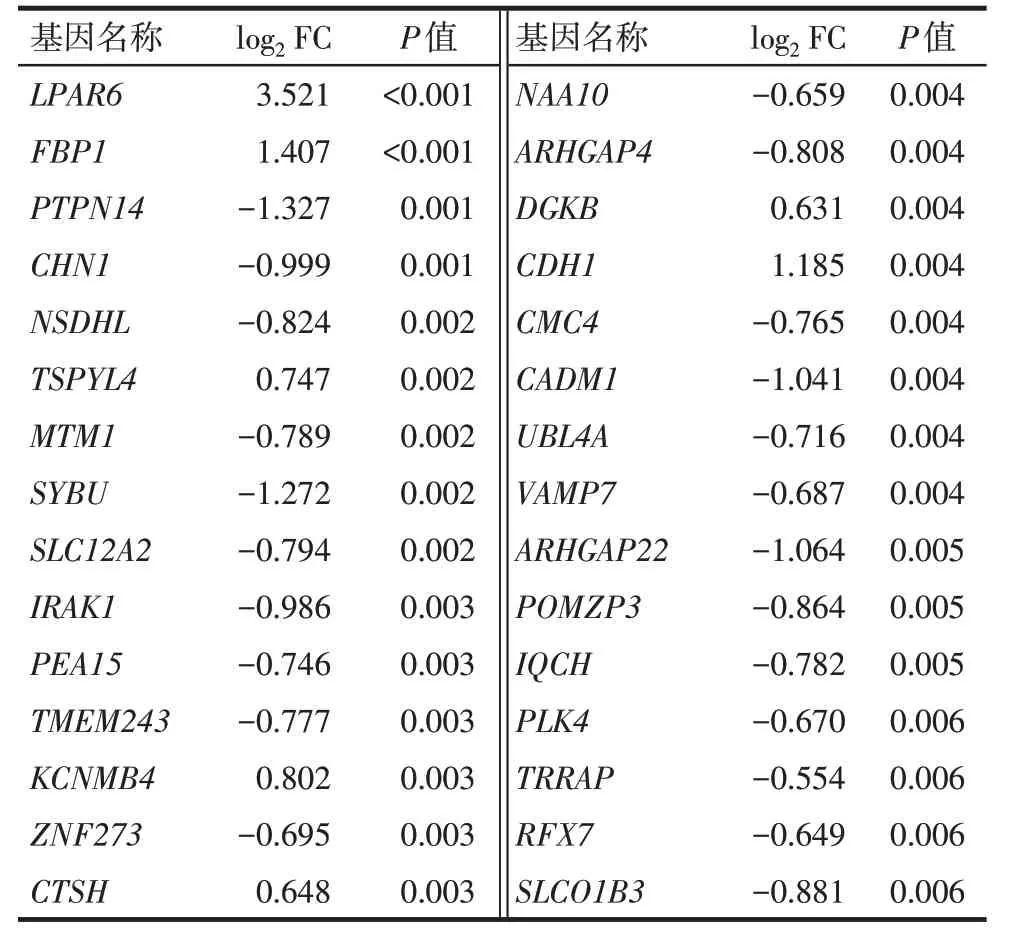
Tab.1 The top 30 most significant differential expression mRNAs in CRC samples with liver metastasis表1 结直肠癌肝转移样本中前30个最显著的差异表达mRNAs
2.2 功能富集分析 差异表达mRNAs富集于32个GO terms,其中包括11 个细胞组分(CC)、13 个生物学过程(BP)和8 个分子功能(MF)。根据P值由小到大排列筛选出的前10个GO terms,见表3。另外,这些差异表达mRNAs 主要富集在包括类固醇生物合成(steroid biosynthesis)和霍乱弧菌感染(vibrio cholerae infection)在内的2条通路中,见表4。
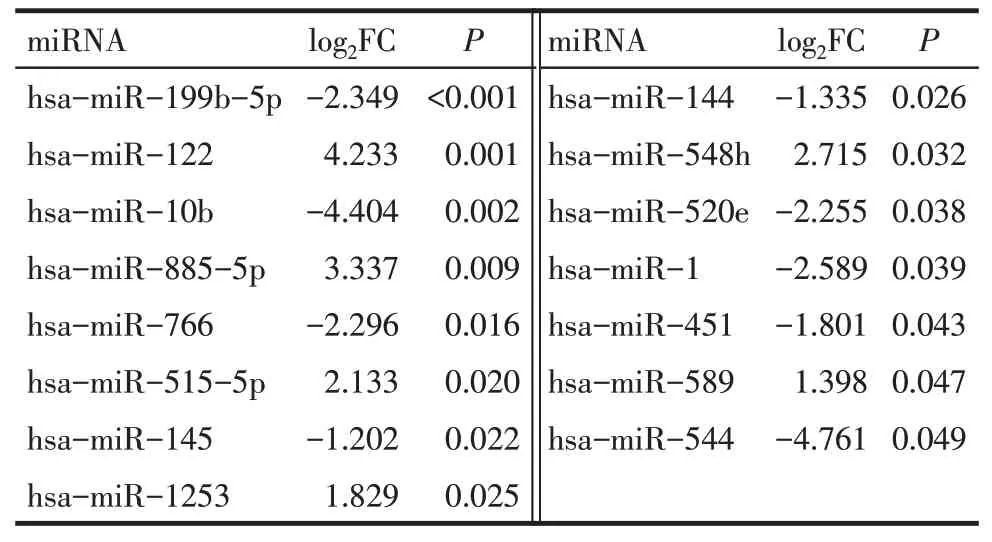
Tab.2 The differential expression miRNAs in CRC samples with liver metastasis表2 结直肠癌肝转移样本中差异表达miRNAs
2.3 miRNA-mRNA 调控网络 首先获得了由差异表达 miRNAs 调节的 555 个 miRNA-mRNA 关系对,其中差异表达mRNAs 参与的关系对为50 个。基于该50 个miRNA-mRNA 关系对构建了miRNA-mRNA网络图,见图2。具有较高节点度的前8个基因,包括纤连蛋白1(FN1)和骨髓嗜病毒整合位点1(MEIS1)等,见表5。
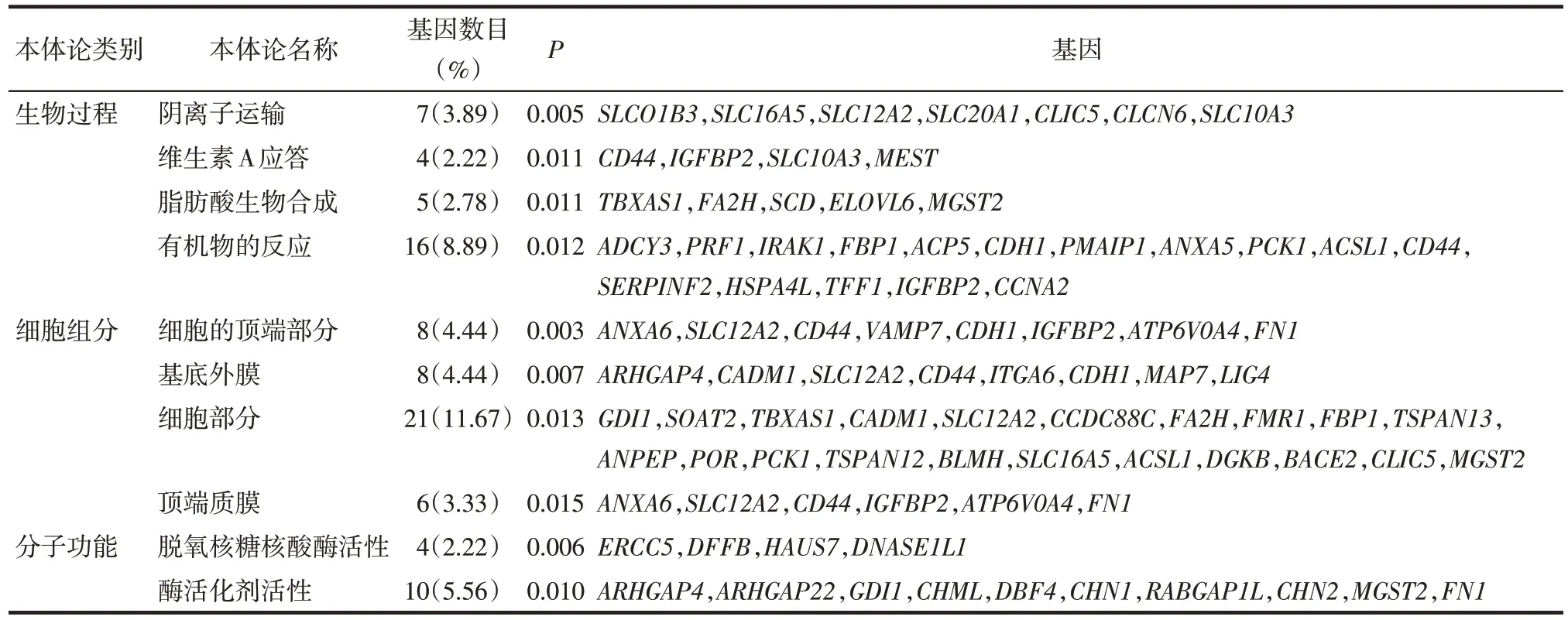
Tab.3 The top 10 enriched GO terms of differential expression mRNAs according to the P-value表3 根据P值筛选的差异表达mRNA富集的前10个GO terms

Tab.4 The enriched KEGG pathway of differential expression mRNAs表4 差异表达基因富集的KEGG通路
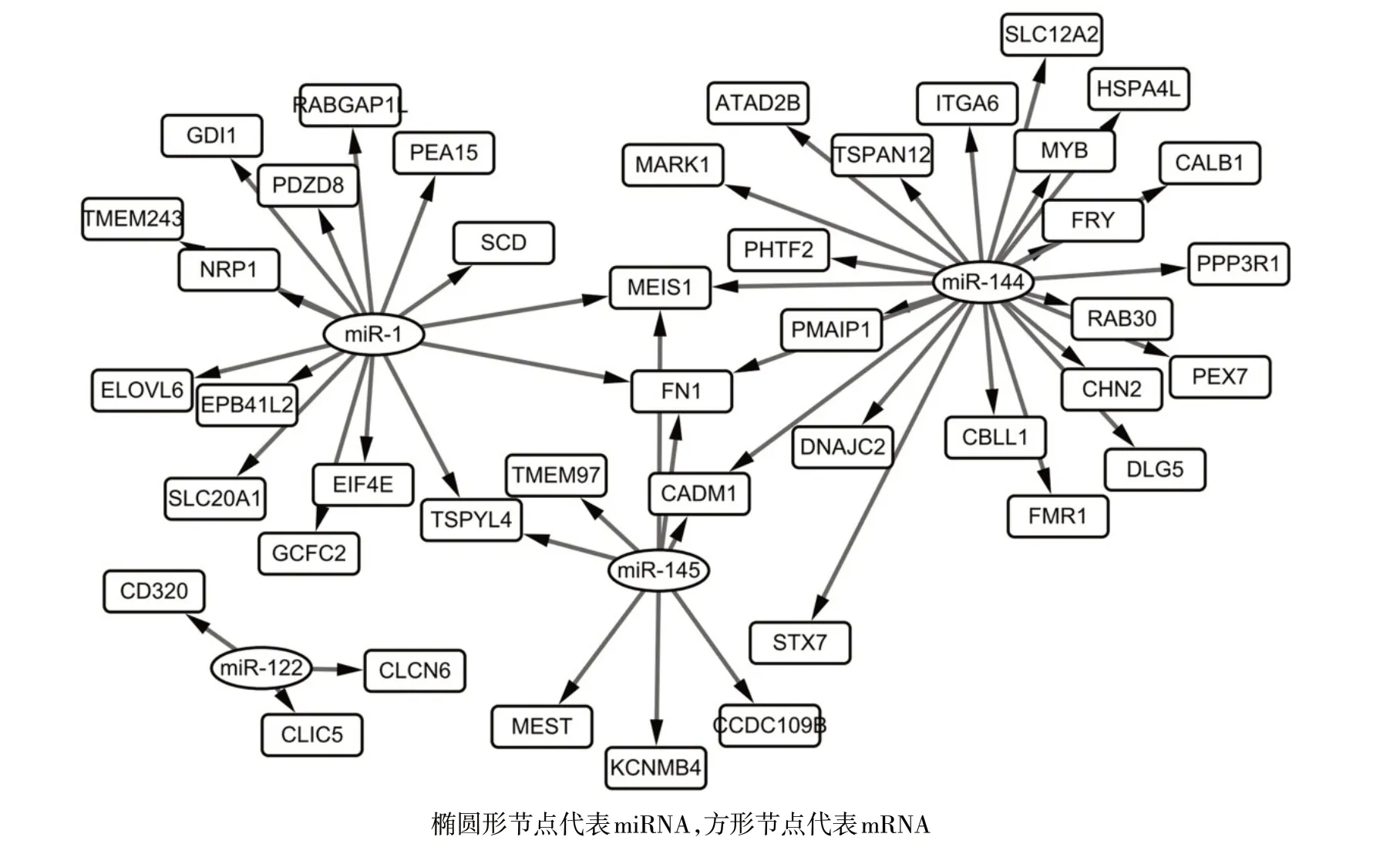
Fig.2 The miRNA-mRNA network图2 miRNA-mRNA网络图
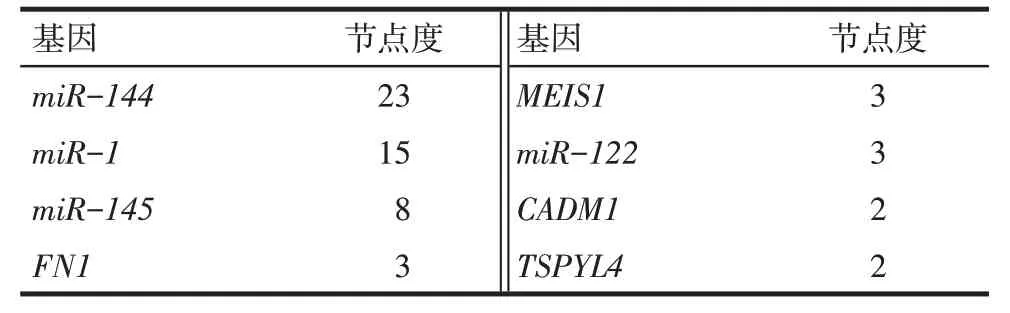
Tab.5 The top 8 genes with higher degree in the miRNA-mRNA network表5 miRNA-mRNA网络图中具有较高节点度的前8个基因
3 讨论
本研究结果显示,与原发性CRC 标本相比,在具有肝转移的CRC 标本中筛选出了差异表达mRNAs,并且它们主要富集于生物转化和质量相关的GO terms 中(表3),例如阴离子转运和脂肪酸生物合成。此外,前3 个最重要的生物学过程是阴离子转运(anion transport)、维生素A 应答(response to vitamin A)和脂肪酸生物合成(fatty acid biosynthetic)。阴离子转运在物质代谢和药物作用中起着关键作用,例如有机阴离子转运蛋白(OAT)主要参与调控许多小有机阴离子分子通过上皮屏障和体液隔室中的跨细胞运动[14]。人类小管多特异性OAT 在各种人类癌细胞中表达,包括CRC 细胞和耐药细胞[15]。OAT2 被认为是预测尿嘧啶-替加氟加亚叶酸(UFT/LV)治疗方案对CRC 患者治疗效果的生物标志物[16]。有机阴离子转运多肽1A2(OATP1A2)和有机阳离子转运蛋白6(OCT6)是三阴性乳腺癌对新辅助化疗方法病理反应的预测因子[17]。本研究结果显示肝转移的CRC 样品中筛选出的差异表达mRNA 主要富集于阴离子转运过程,表明阴离子转运相关的生物学过程可能与CRC 的肝转移有关。部分研究发现,维生素A 可以促进CRC 细胞凋亡[18]。另有研究认为,脂肪酸摄入是CRC的危险因素[19],脂肪酸分布影响CRC的预后效果[20]。本文研究显示维生素A应答和脂肪酸生物合成是差异表达mRNA 主要富集的生物学过程,提示维生素A应答和脂肪酸生物合成相关的生物学过程与CRC 的预后有关,并且对它们的探索可能有助于筛选作为CRC诊断和治疗的一些生物标志物。
CRC 是一种雌激素依赖性恶性肿瘤,类固醇硫酸酯酶可以控制组织内雌激素浓度。部分研究显示,CRC 中的类固醇硫酸酯酶表达可能会降低[21]。另一项研究发现,类固醇生物合成参与CRC 从腺瘤到癌的进展过程[22]。此外,一些性类固醇受体的遗传变异也可能与CRC流行病学的性别差异有关[23]。虽然很少有研究探讨霍乱弧菌感染与CRC 之间的关系,但通常认为病毒感染可能会增加患CRC 的风险[24]。 曹 燕 青 等[25]研 究 认 为 ,乙 型 肝 炎 病 毒(hepatitis B virus,HBV)感染降低了左半结直肠癌肝转移的风险,并提高了肝转移病灶的手术切除率。在本研究中,笔者发现差异表达mRNA 主要富集于类固醇生物合成和霍乱弧菌感染相关通路中,表明类固醇生物合成和霍乱弧菌感染可能会影响CRC的肝转移。然而,有必要进一步探讨这些通路是如何影响CRC肝转移的。
在构建的miRNA-mRNA 网络图中,FN1和MEIS1是节点度最高的两个基因。FN1基因编码纤维连接蛋白1,该蛋白可促进口腔鳞状细胞癌的转移[26]。FN1的转录激活也可促进CRC 的恶性行为,包括转移[27]。FN1的表达与结直肠癌的进展和转移密切有关[28]。此外,FN1是肝细胞癌转移的潜在靶点[29]。因此,FN1基因可能是 CRC 肝转移的潜在生物标志物。MEIS1是一个同源框基因,其调节髓样白血病的肿瘤发生和预后过程[30]。研究表明MEIS1基因在结直肠癌中表达下调,其是结直肠肿瘤发生的生物标志物,并且MEIS1可能在CRC 中起到肿瘤抑制剂的作用[31]。此外,在BRAF基因发生突变的CRC 中MEIS1启动子发生显著的甲基化,其与MEIS1表达降低有关[31]。本研究结果显示,MEIS1是肝转移的CRC 样品中非常重要的一个差异表达mRNA,表明MEIS1可能参与了CRC的肝转移,尽管很少有研究可以证明这一点。
综上所述,FN1和MEIS1可能是 CRC 肝转移的潜在生物标志物,但需要进一步的实验和临床研究来证明。此外,一些生物过程(例如阴离子转运、维生素A应答和脂肪酸生物合成)和通路(例如类固醇生物合成和霍乱弧菌感染)可能与CRC 的肝转移有关。
