中度限食对肥胖小鼠胰岛β细胞分泌功能的影响
2019-07-17高秀莹周迎生朱巍
高秀莹,周迎生,朱巍
肥胖是2 型糖尿病公认的危险因素,肥胖不仅可引起外周胰岛素抵抗,而且会导致胰岛β 细胞功能紊乱,具体表现为胰岛素分泌受损,早期并不伴β细胞数量的下降[1]。限食(calorie restriction,CR),即每天固定限制热量摄入,对肥胖、2型糖尿病采用最多的限食方式是将每日热量摄入减少15%~40%,即摄入热量约1 200~1 800 kcal/d,长期维持。亦有一些研究采用的极低热量饮食(<800 kcal/d,即将每日热量摄入减少约50%~70%),短期干预[2-4]。目前对于限食的程度尚无具体的分级标准,本研究参照文献[5],将极低热量饮食称为重度限食,将30%~50%限食称为中度限食,将<30%限食称为轻度限食。临床研究显示,重度限食可改善甚至逆转肥胖和2 型糖尿病患者中存在的β细胞功能紊乱。部分研究给予极度肥胖的2 型糖尿病患者短期极低热量饮食(400 kcal/d,1周[2]或500 kcal/d,3周[3]),可改善胰岛素分泌紊乱。最近的一项研究给予30 例超重或肥胖的2 型糖尿病患者8 周的极低热量流质饮食(624 kcal/d),可使40%的患者糖尿病完全缓解,并恢复第一时相胰岛素分泌[4]。然而因重度限食有营养不良、低血糖、电解质紊乱等不良反应,致使患者难以长期坚持,且终止后易出现体质量反弹[6],目前国内外指南均不推荐2型糖尿病患者长期接受极低热量饮食[7-8]。而对肥胖患者或动物模型轻中度限食的研究,则主要关注其对胰岛素抵抗的改善[9-12],而缺乏对胰岛β细胞功能的深入探讨。目前轻中度限食能否逆转肥胖诱导的β细胞功能紊乱尚不明确。因此,本研究采用饮食诱导的肥胖小鼠为模型,进行中度(40%)限食干预,使其体质量恢复正常,通过在体和离体胰岛实验明确中度限食能否从形态和功能上逆转肥胖对β细胞的损伤。
1 材料与方法
1.1 材料
1.1.1 实验动物 4周龄雄性C57BL/6小鼠80只,体质量9~11 g,购于北京维通利华公司,饲养于首都医科大学SPF级实验动物房,许可证号:SCXK(京)2012-0001,动物合格证号:11400700057273。普通饲料及高脂饲料均购自美国Research Diets公司。
1.1.2 主要试剂与仪器 胶原酶Ⅺ、Histopaque 1077、胎牛血清均购自美国Sigma 公司;RPMI 1640培养基、DMEM 培养基均购自美国Gibco 公司;牛血清白蛋白购自美国Amresco 公司;小鼠超敏胰岛素酶联免疫吸附试验(ELISA)试剂盒购自美国Alpco 公司;鼠源胰岛素单克隆抗体购自美国Santa cruz公司;兔/鼠通用型链亲和素-辣根过氧化物酶试剂盒购自北京康为世纪公司;其他试剂均为分析纯,购自北京化工厂。SD111 型体视显微镜购自重庆重光公司;3111 型CO2培养箱购自美国Thermo公司;DMI 4000B型倒置相差显微镜购自德国Leica公司;ECLIPSE 80i/90i型正置显微镜购自日本Nikon公司;Synergy4型多功能酶标仪购自美国BioTek公司。
1.2 方法
1.2.1 动物分组及模型建立 小鼠予以普通饲料适应性喂养1周后,按随机数字表法分为对照组(NC AL组,n=20)和高脂组(n=60)。对照组饲喂普通饲料(D12450J,脂肪供能比10%,16.1 kJ/g),高脂组饲喂高脂饲料(D12492,脂肪供能比60%,21.9 kJ/g),均喂养8周,高脂组出现典型肥胖,体质量均值≥对照组体质量均值35%作为饮食诱导肥胖(diet-induced obese,DIO)小鼠成模的标准。其后将高脂组随机分为以下3组(n=20):高脂对照组(HF AL组,继续自由进食高脂饲料)、高脂转普食组(HF→NC 组,换为普通饲料,自由进食)、高脂限食组[HF→NC CR 组,进食普通饲料,每日喂食量=正常对照组每日摄食量(前3 d平均值)×60%]。NC AL组继续自由进食普通饲料,所有动物均自由饮水。限食组小鼠经预实验确定限食干预时间为3 周(此时,HF→NC CR 组的体质量接近NC AL组)。
1.2.2 腹腔葡萄糖耐量试验(IPGTT)和胰岛素耐量试验(ITT) IPGTT:小鼠禁食过夜16 h,给予腹腔注射25%葡萄糖(2 mg/g),鼠尾采血,分别测定空腹及糖负荷后15、30、60、120 min 的血糖及胰岛素水平。并计算:(1)胰岛素生成指数=[15 min 胰岛素-空腹胰岛素(μg/L)]/[15 min 血糖-空腹血糖(mmol/L)],评估早时相胰岛素分泌[13]。(2)梯形面积法计算0~120 min血糖曲线下面积(AUC血糖)和胰岛素曲线下面积(AUC胰岛素),评估第二时相胰岛素分泌。ITT:小鼠不禁食,腹腔注射0.75 IU/kg 重组人胰岛素注射液,分别测定注射前及注射后15、30、60、120 min的血糖水平,并分别计算注射后15、30、60、120 min的血糖占基线(注射前)血糖的百分比。
1.2.3 胰腺组织胰岛素免疫组化染色及定量 实验终点取小鼠胰腺,常规石蜡包埋,5 μm切片,切片脱蜡至水,抗原修复,灭活内源性过氧化物酶,封闭,滴加鼠源胰岛素一抗(1∶400稀释),4 ℃湿盒过夜,次日滴加生物素标记羊抗鼠二抗,二氨基联苯胺(DAB)显色,脱水,中性树胶封片。光学显微镜下观察并采集图像,以细胞胞浆棕黄染色为胰岛素阳性细胞。每组5只小鼠,每只小鼠随机选取10张切片(2张切片间隔至少200 μm,避免重复测量同一个胰岛),应用NISElements 专业图像分析软件计算胰腺β 细胞面积(%)=胰岛素阳性染色面积/切片中胰腺组织面积。
1.2.4 小鼠胰岛的分离、纯化 实验终点每组取10只小鼠分离胰岛。1%戊巴比妥钠(80 mg/kg)腹腔注射麻醉,体视显微镜下,通过胆总管穿刺、逆行灌注胶原酶Ⅺ(1.5 g/L)[14],使胰腺充分内消化,迅速摘取整个胰腺,放入50 mL 离心管中,37 ℃水浴消化10 min,加入40 mL预冷的Hank's平衡盐溶液(HBSS),摇匀终止消化,1 400 r/min 离心15 s,弃上清,共洗涤3 次,第3 次洗涤后经600 μm 不锈钢滤网过滤,然后加7 mL Histopaque 1077重悬沉淀,沿管壁轻轻加入7 mL DMEM,2 300 r/min离心10 min,小心吸出中间层的胰岛至含有HBSS的培养皿中,体视显微镜下,用移液枪人工挑取胰岛。每150个胰岛加入6 mL RPMI 1640 完全培养基,过夜培养恢复,倒置显微镜下拍照,应用Image-Pro Plus 3.0 软件测量胰岛直径,将胰岛直径分为3个等级:50~<100 μm,100~200 μm,>200 μm,计算不同组间胰岛各个等级的分布比例。
1.2.5 离体胰岛葡萄糖刺激的胰岛素分泌(GSIS)及胞浆胰岛素含量测定 GSIS:过夜培养的胰岛换含0.5%BSA的KRB缓冲液,于CO2培养箱中预孵育1 h,体视显微镜下,吸取包膜完整、大小一致的胰岛种于24 孔板,每孔10 个,分别加入含2.8 mmol/L、16.7 mmol/L 葡萄糖的刺激液,每个浓度设 3 个复孔,于CO2培养箱孵育1 h,冰上终止胰岛素分泌,吸取上清-80 ℃保存,ELISA 法待测胰岛素浓度。胞浆胰岛素含量测定:GSIS 刺激前,收集 5 个胰岛至 1.5 mL EP 管中,每只小鼠采样3 次,加入1 mL 冰的酸-乙醇溶液(盐酸1.5%,乙醇75%,蒸馏水23.5%),涡旋15 s,反复冻融后超声破碎3 次,4 ℃裂解过夜,次日4 ℃13 000 r/min离心20 min,吸取上清-80 ℃保存,ELISA法检测胰岛素浓度。
1.3 统计学方法 所有数据应用SPSS 16.0软件进行统计分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析或重复测量设计的方差分析,组间多重比较行LSD-t检验;计数资料以例(%)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 限食对小鼠体质量的影响 经过8周的高脂喂养,高脂组小鼠显著肥胖,体质量较NC AL组增加了45.1%,均成功建立了DIO模型。经过3周的限食干预,HF→NC CR 组小鼠的体质量恢复正常。对于HF→NC 组,尽管实验终点时较HF AL 组小鼠体质量下降了26.1%,但与NC AL 组相比,体质量仍未降至正常,见图1。
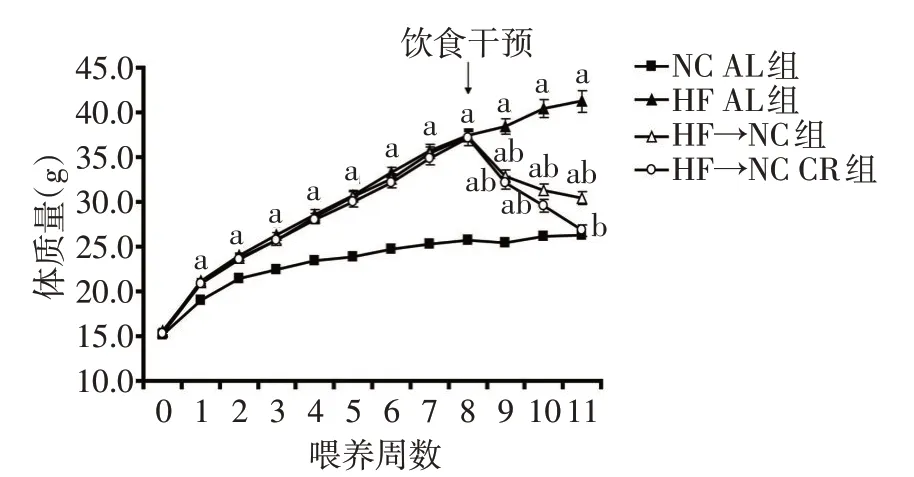
Fig.1 The changes of body weights during the experiment in the four groups图1 实验进程中各组小鼠体质量变化
2.2 限食对糖耐量、早时相和第二时相胰岛素分泌及胰岛素敏感性的影响 与NC AL 组比较,HF AL组糖负荷后15、30、60、120 min 的血糖、胰岛素及血糖占基线的百分比均明显升高;与HF AL 组比较,HF→NC 组和 HF→NC CR 组糖负荷后 15、30、60、120 min的血糖、胰岛素及血糖占基线的百分比均明显降低(均P<0.05),见图2。与NC AL 组比较,HF AL 组小鼠的空腹血糖、空腹胰岛素、AUC血糖和AUC胰岛素均明显升高(均P<0.05);与HF AL 组比较,HF→NC组和HF→NC CR组小鼠的空腹血糖、空腹胰岛素、AUC血糖和AUC胰岛素均降低(均P<0.05),且除HF→NC 组空腹胰岛素仍高于NC AL 组外,其余指标均恢复至正常。HF→NC CR 组胰岛素生成指数高于HF AL组(P<0.05),其余组胰岛素生成指数差异均无统计学意义,见表1。
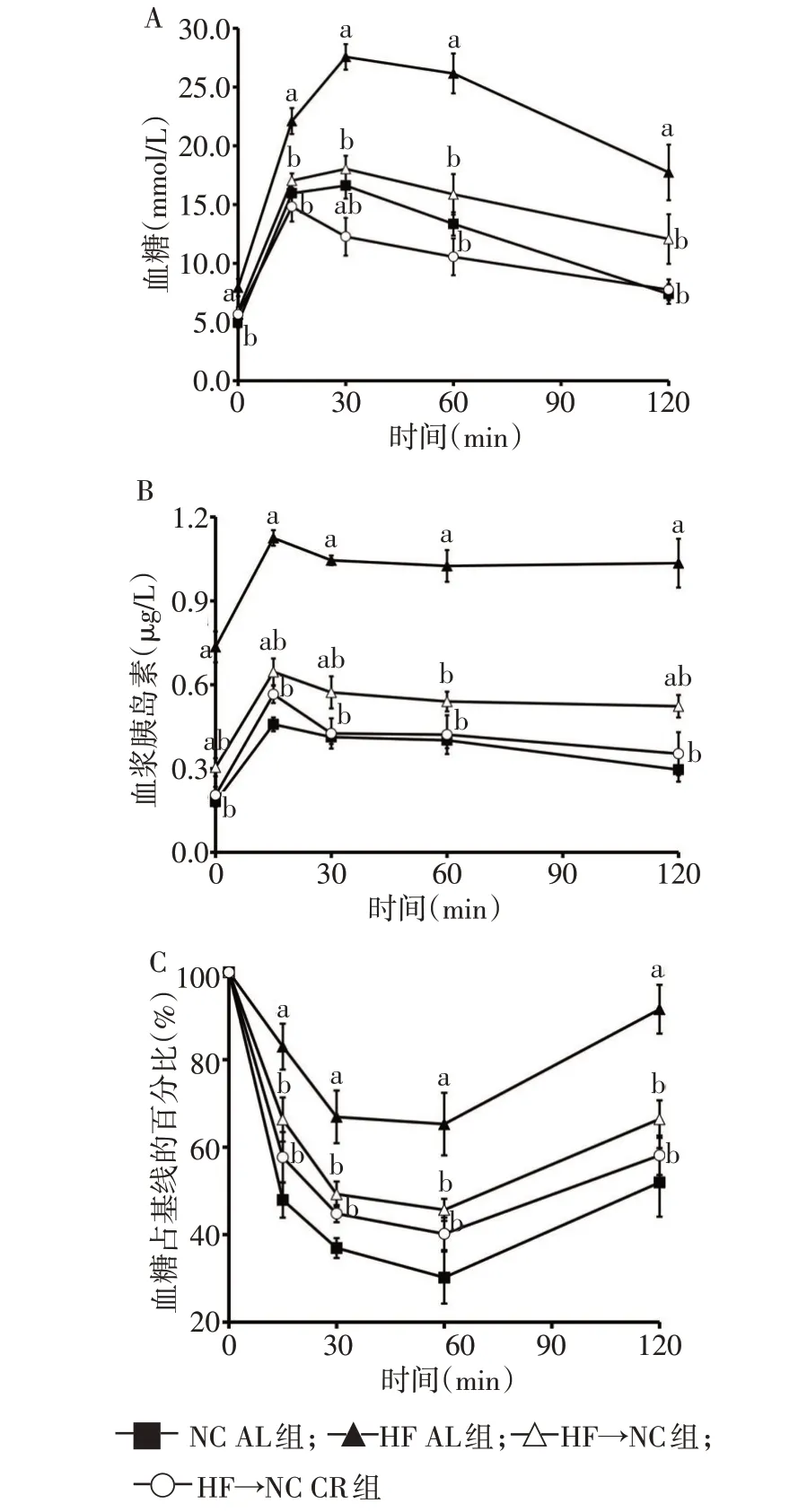
Fig.2 Intraperitoneal glucose tolerance test and insulin tolerance test图2 IPGTT及ITT
Tab.1 Effects of calorie restriction on β-cell function表1 限食对β细胞功能的影响 (±s)
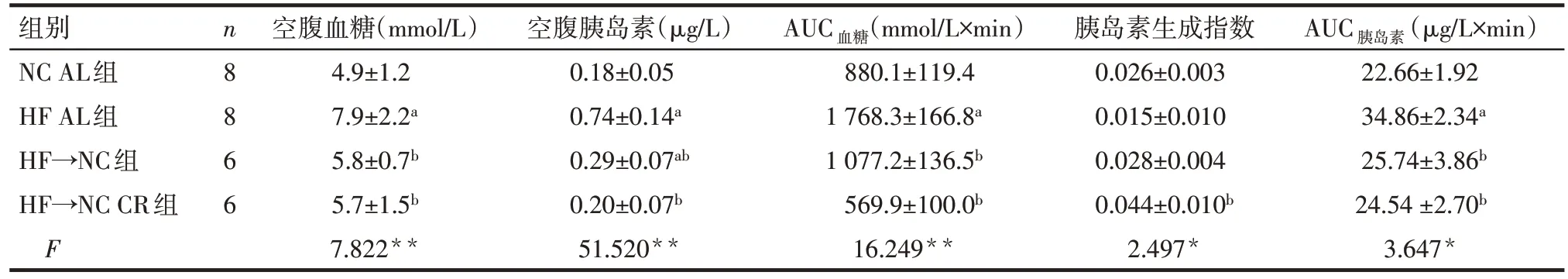
Tab.1 Effects of calorie restriction on β-cell function表1 限食对β细胞功能的影响 (±s)
*P<0.05,**P<0.01;a与NC AL组比较,b与HF AL组比较,P<0.05
组别NC AL组HF AL组HF→NC组HF→NC CR组F n8866空腹血糖(mmol/L)4.9±1.2 7.9±2.2a 5.8±0.7b 5.7±1.5b 7.822**空腹胰岛素(μg/L)0.18±0.05 0.74±0.14a 0.29±0.07ab 0.20±0.07b 51.520**AUC血糖(mmol/L×min)880.1±119.4 1 768.3±166.8a 1 077.2±136.5b 569.9±100.0b 16.249**胰岛素生成指数0.026±0.003 0.015±0.010 0.028±0.004 0.044±0.010b 2.497*AUC胰岛素(μg/L×min)22.66±1.92 34.86±2.34a 25.74±3.86b 24.54±2.70b 3.647*
2.3 限食对胰岛β 细胞面积的影响 HF AL 组胰岛β 细胞面积较NC AL 组增加了3.3 倍(P<0.05);HF→NC 组胰岛β 细胞面积虽较HF AL 组降低,但仍高于NC AL组(P<0.05);HF→NC CR组胰岛β细胞面积较HF AL组降低(P<0.05),且与NC AL组差异无统计学意义。见图3。
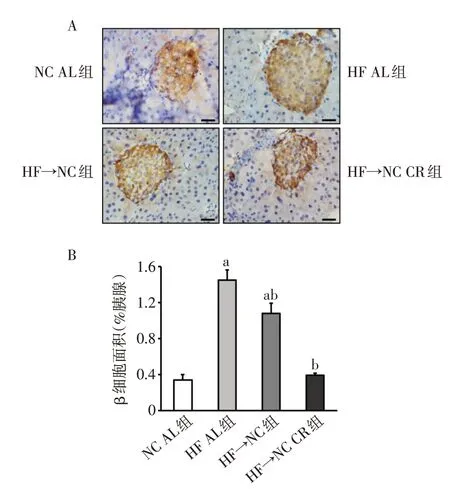
Fig.3 Effects of calorie restriction on islet β-cell area图3 限食对β细胞面积的影响
2.4 限食对离体胰岛形态的影响 体外分离的胰岛经过夜培养后包膜完整、呈自然的棕黄色,可用于后续的功能实验,见图4A。每只小鼠可分离出200~400个胰岛,大多数胰岛的直径分布在100~200 μm。HF AL 组胰岛明显肥大,>200 μm 的胰岛比例较NC AL 组增高(P<0.05);HF→NC 组和HF→NC CR组胰岛的分布比例均恢复正常,见图4B。
2.5 限食对离体胰岛GSIS 及胞浆胰岛素含量的影响 HF AL组胰岛表现为缺陷性的胰岛素分泌,即:与NC AL组相比,基础胰岛素分泌增加了30.6%,而高糖刺激的胰岛素分泌降低了52.1%(P<0.05)。HF→NC组胰岛尽管基础胰岛素分泌恢复至正常水平,但高糖刺激的胰岛素分泌较HF AL 组并无改善(P>0.05)。经过限食干预后,HF→NC CR组胰岛的基础和高糖刺激的胰岛素分泌均恢复正常,见图4C。HF AL组单个胰岛的胰岛素含量较NC AL组增加了28.3%(P<0.05),HF→NC 组和HF→NC CR 组的胞浆胰岛素含量均降至正常水平,见图4D。
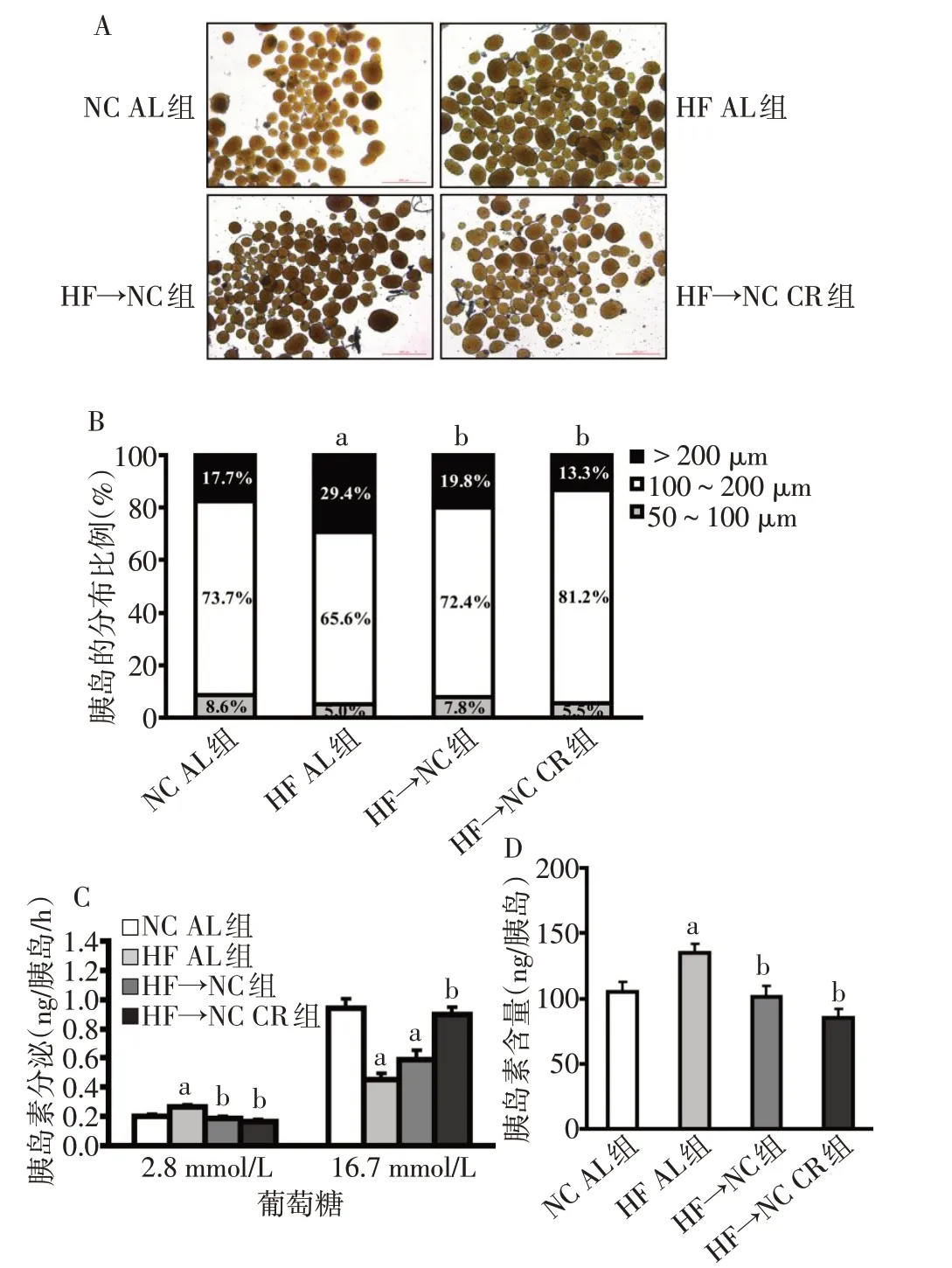
Fig.4 Effects of calorie restriction on the morphology and function of isolated islets图4 限食对离体胰岛形态及功能的影响
3 讨论
目前,肥胖已成为严重的公共卫生问题[15]。肥胖对胰岛β 细胞的损伤表现为早期代偿性增生、胰岛素高分泌,逐渐出现胰岛素分泌时相受损,继而出现β 细胞形态改变及数量下降,逐步进展到β 细胞功能衰竭的终末状态。研究证实在胰岛β细胞仅有分泌功能障碍,而未出现显著的组织学改变之前,早期干预,其功能受损是可逆的。限食能有效减低体质量,改善β 细胞功能[16]。研究显示,重度限食(极低热量饮食)可快速逆转肥胖和2 型糖尿病患者中存在的β细胞功能紊乱,恢复第一时相胰岛素分泌,甚至使部分患者的糖尿病完全缓解[4,17-18]。
本研究成功建立了饮食诱导的肥胖小鼠模型,结果显示,HF AL组出现糖耐量受损,胰岛β细胞面积及胞浆胰岛素含量代偿性增加,而早时相胰岛素分泌趋向降低、第二时相胰岛素分泌显著升高,这种现象常见于糖耐量异常及早期的2 型糖尿病患者[19],与此一致的是,该组离体胰岛实验亦显示高糖刺激的胰岛素分泌障碍,这与既往研究结果相符[20-21],提示高脂组的β 细胞功能紊乱并非由于胰岛素储备不足,而是由于缺陷性的分泌。
本研究对饮食诱导的肥胖小鼠进行中度限食或高脂饮食转为普通饮食干预,结果显示,经过3 周40%的限食干预,HF→NC CR 组小鼠体质量降至正常,并且糖耐量、胰岛素分泌和胞浆胰岛素含量均恢复正常。与重度限食的不良反应和体质量反弹相比,本研究采用的中度限食策略,易被患者接受,体质量反弹少[22],可行性强。尽管重度限食研究和本研究所采用的限食方式和干预时间不同,均证实在肥胖和2型糖尿病的早期阶段,限食干预能够逆转β细胞功能紊乱。
本研究中,高脂饮食转为普通饮食3周后,HF→NC组小鼠的糖耐量恢复正常,体质量有所降低但未正常,同时,该组小鼠的早时相胰岛素分泌及离体胰岛高糖刺激的胰岛素分泌较HF AL 组并无改善。Agardh等[23]研究表明DIO小鼠经高脂饮食转为低脂饮食4 周,可使糖耐量正常,体质量降低,这与本研究相符,然而,与本研究结果不同的是,该研究显示早时相胰岛素分泌亦有改善,造成这种差异的原因可能与该研究干预时间较长有关。此外,既往多个研究显示,使血糖恢复正常需较短的干预时间,而使胰岛素分泌恢复正常则需较长的干预时间[10,17],正如HF→NC 组小鼠所示,尽管它们的血糖已经恢复正常,但仍存在胰岛素分泌缺陷。这也提示除使血糖恢复正常之外,重建β细胞功能亦应作为肥胖和2型糖尿病干预研究的的主要终点和靶点。
综上所述,40%的中度限食干预至体质量正常,能逆转饮食诱导肥胖小鼠的胰岛β细胞分泌功能紊乱,重建葡萄糖稳态。本研究支持在肥胖和2 型糖尿病的早期阶段,仅通过饮食干预即可逆转β 细胞功能障碍,并为限食应用于临床实践提供了参考依据。进一步阐明限食对β细胞保护的机制将为2型糖尿病的防治提供有效的靶点。
