胶原蛋白膜用于大鼠胃壁缺损修复的可行性及有效性研究*
2019-05-09翟文斌赵黎黎陈颖彤陈嘉伟范志宁
翟文斌 赵黎黎 陈颖彤 陈嘉伟 刘 莉 王 敏 王 翔 范志宁
(南京医科大学第一附属医院消化内镜科,南京 210029)
医源性消化道穿孔是消化内镜检查及治疗过程中一种罕见但危及生命的并发症,具有较高的致病率和病死率[1]。外科手术修补一直是急性消化道穿孔的标准治疗方式,但创伤大,并存在术后吻合口狭窄、吻合口漏或瘘等并发症可能。回顾性研究[2,3]表明,外科手术修补内镜下穿孔并发症发生率为25%~36%,病死率7%~10%。穿孔早期发现、快速修补、创面快速愈合是改善预后的重要手段。内镜可快速发现和修补小穿孔,如钛夹夹闭、荷包缝合、内镜金属夹系统(over-the-scope clips,OTSC)缝合、支架植入等[1,4,5],但仅限于小穿孔。穿孔快速修补和消化道完整结构重建是重要难题。目前常用的方法主要有自体组织移植、异体组织移植及人工合成组织替代品移植。前两种存在供体严重受限和免疫排斥反应等问题,人工合成材料目前是研究热点。不同材质补片用于消化道穿孔修补已取得良好效果,但大多以瘢痕修复、组织异生为主,新生组织结构和功能难以恢复[6]。目前,聚乳酸(polylactic acid,PLA)膜配合胶原纤维胶在内镜黏膜下剥离(endoscopic submucosal dissection,ESD)术后穿孔或预防ESD术后迟发性穿孔方面得到较好的临床效果[7~9],但术后需要禁食和应用质子泵抑制剂。
引导组织再生(guide tissue regeneration,GTR)胶原蛋白膜是一种独特的疏密复合双层网状结构的人造Ⅰ型胶原蛋白膜,目前在骨科、神经外科、五官科等手术中用于促进组织修复和再生[10~12],取得良好效果,目前在消化道缺损领域尚缺乏相应的研究。本研究探讨GTR胶原蛋白膜在大鼠胃壁缺损修补的可行性及有效性,并与临床已在使用的PLA膜进行对比。
1 材料与方法
1.1 实验动物
33只健康SD大鼠(8周龄,250~260 g)购自南京医科大学实验动物中心[SYXK(苏)2018-0020],饲养于南京医科大学五台校区动物房,室温25 ℃,湿度10%~20%,每天保持12 h昼夜循环,自由摄水和饲料。实验操作经过南京医科大学实验动物伦理审查委员会批准(IACUC-1809024),并按照实验动物使用的3R原则给予人道关怀。适应性饲养4天后进行手术造模,手术当天33只大鼠体重(260.1±2.7)g。
1.2 实验方法
1.2.1 主要试剂和仪器 2%戊巴比妥钠,2%碘伏,75%乙醇,生理盐水,4%多聚甲醛,手术刀,手术剪,纱布,电刀(桂林市立康电子医疗设备有限公司),GTR医用胶原蛋白膜(福建省博特生物科技有限公司),PLA膜(广州弘健生物医用制品科技有限公司)。
1.2.2 动物模型建立及手术修补 所有SD大鼠术前禁食12 h,禁水6 h,腹腔注射2%戊巴比妥钠(3 ml/kg)麻醉。腹部皮肤备皮,取头高脚低仰卧位(与水平面呈30°角)固定于手术操作台上,消毒,铺单。剑突下腹部正中切口,逐层切开腹壁2 cm,暴露胃体大弯及胃底,以电刀全层切开胃底近胃体大弯侧,形成7 mm×7 mm胃壁穿孔。实验组(n=25)以与穿孔相同大小的胶原蛋白膜修补,对照组(n=8)以PLA膜修补胃壁缺损,均以6-0丝线间断缝合补片和胃壁,逐层关闭腹腔。术后禁水6 h,禁食24 h后恢复正常饮食。术后实验组大鼠分为5笼饲养,每笼5只;对照组饲养至术后6周。
1.2.3 观察指标 术后每天测量体重,观察生命体征及精神状态,饮食情况,有无腹胀、腹泻、腹膜炎发生。实验组分别于术后第3天、1周、2周、4周、6周从各笼中抽取1只共5只,2%戊巴比妥钠5 ml/kg腹腔注射麻醉致死,对照组于术后6周同法处死,观察腹腔粘连情况、胃壁缺损修复情况,黏膜缺损面积按照缺损部位长径×短径×π/4计算。取出部分新生胃壁及其周围正常组织,4%多聚甲醛溶液固定,常规石蜡包埋,切片,厚度5 μm,HE染色观察组织的基本结构和形态,组织修复与再生过程中肉芽组织增生、炎性细胞浸润、成纤维细胞与纤维细胞增殖、新生血管生成情况。Masson染色观察组织修复过程胶原蛋白的增生和沉积。
1.3 统计学分析
2 结果
2.1 大体观察
所有大鼠胃壁穿孔建模和修补术成功完成。
实验组25只大鼠术后生存情况良好,无死亡,无腹胀、腹泻,无腹膜炎表现,无腹腔脓肿及消化道漏,体重术后短暂下降后稳步上升,生长情况良好,术后1~6周体重变化见表1。术后3天,大鼠腹腔未见明显感染,胶原蛋白膜依然保持良好结构,与正常胃壁组织紧密贴合(图1A),无胃内容物漏至腹腔。1周以后,所有大鼠胃壁穿孔完全闭合(图2A),缺损部位浆膜面与腹壁或腹腔脏器稍有粘连。术后1周,黏膜面穿孔部位黏膜上皮缺损范围(39.79±0.55)mm2,未见明显组织挛缩;术后2周,缺损面积(7.40±0.43)mm2,术后4周减至(0.91±0.08)mm2,术后6周黏膜完全再生(图2B),未见明显瘢痕组织形成,缺损部位浆膜面和腹壁或腹腔脏器均有轻度粘连对照组大鼠(n=8)术后3天内3只死亡,解剖见穿孔修补部位再次穿孔,大量食物、消化液漏至腹腔;1只腹泻,1周后恢复正常,其余4只未见明显异常,存活率62.5%(5/8),明显低于实验组[100%(25/25)](Fisher检验,P=0.010)。术后体重变化见表1,对照组大鼠体重均低于实验组(P<0.05)。术后6周缺损部位浆膜面和腹壁或腹腔脏器均有轻度粘连,黏膜缺损面积(1.39±0.20)mm2,显著大于实验组术后4周黏膜缺损(0.91±0.08)mm2(t=-5.029,P=0.001)。
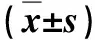
表1 2组大鼠术后体重 g
2.2 组织病理分析
实验组术后3天见胶原蛋白膜与正常组织紧密贴合,两者相融,胶原蛋白膜表面大量细胞爬行及肉芽组织增生,炎性细胞浸润(中性粒细胞为主)(图1B、C、D);术后1周,缺损处新生组织表面黏膜缺如,结构紊乱,炎性细胞及巨噬细胞浸润,成纤维细胞增生,新生毛细血管形成(图3B);术后2周,新生组织结构紊乱,正常黏膜向缺损部位爬行延展,部分缺损部位黏膜层恢复,炎性细胞浸润明显减少,巨噬细胞及成纤维细胞增生,新生毛细血管密度进一步增加(图3A、B);术后4周,新生组织黏膜上皮细胞进一步爬行,黏膜缺损进一步减少,成纤维细胞减少,部分转化为纤维细胞,新生血管结构正常化(图3A、B);术后6周,新生组织黏膜完全再生,黏膜下层和肌层结构显示清晰,趋于正常化(图3A、C),高倍镜下见成纤维细胞明显减少,黏膜下层纤维细胞排列整齐有序(图3B)。整个修复过程,未见胶原蛋白过度增生,未见明显纤维化(图3C);也未见明显瘢痕组织增生(图2B)。
对照组术后6周缺损部位新生组织黏膜尚未完全再生,仍有部分缺损,新生部位组织结构紊乱,大量炎性细胞浸润,明显多于实验组,大量成纤维细胞增生,部分新生血管生成,组织再生和修复程度明显劣于实验组术后4周水平(图3)。
3 讨论
随着消化内镜技术的发展,内镜黏膜切除术(endoscopic mucosal resection,EMR)、内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)对于消化道早癌的微创诊治得到广泛认可[4,13~15],但其并发症消化道穿孔却是临床上急需解决的难题,目前常用方法为内镜下修补、腹腔镜或开腹手术修补等[1,4,5];穿孔较大或污染较重时可能需要部分消化道切除或造瘘。
消化道完整结构修复和功能重建一直是重大挑战,各种促进组织再生和修复的材料是目前研究的重点。聚四氟乙烯(polytetrafluoroethylene,PTFE)在1993年首次应用于大鼠胃壁缺损修补,成功封堵大鼠胃壁缺损[16],但主要为组织纤维化异生修补,没有正常黏膜再生;后续实验中,PTFE修补部分实现黏膜再生,但新生黏膜非常薄,难以重塑正常功能[17~19]。新型的小肠黏膜下层组织(small intestinal submucosa,SIS)应用于大鼠胃壁缺损修补[20],只实现了部分黏膜再生。类似研究对其进行功能评估显示,6个月后胃再生部分出现肌肉收缩,伴有完整的黏膜、黏膜下层和肌肉再生[21],修复周期较长。Spiliopoulos等[6]用经过戊二醛处理的马的心包组织作为补片修补兔的胃壁穿孔,实现胃壁穿孔的快速修补,但依然是一种瘢痕修复,术后2个月缺损再生部位都没有黏膜再生。各种生物材料补片处于不断研究中,但目前依然没有完美的材料。PLA膜和纤维蛋白胶目前已在临床上成功用于ESD术后穿孔修补或预防迟发性穿孔,并取得较好的临床效果[7~9,22,23]。
胶原蛋白是细胞外基质的重要组成成分,能够促进细胞增殖[24]。本实验采用的GTR胶原蛋白膜以牛腱为主原料,通过酶降解法提取Ⅰ型胶原,去除胶原蛋白中的末端抗原肽,有效降低胶原的免疫原性;并经过生物改性处理,具有独特的双层网状结构,实现降解时间可控,提高力学和生物学性能[25]。本实验将此胶原蛋白膜与目前已得到临床应用的PLA膜进行对比,探讨GTR胶原蛋白膜用于大鼠胃壁修补的可行性及有效性,为GTR胶原蛋白膜辅助内镜下修补消化道穿孔提供相关实验依据。因目前内镜下无法实现致密的连续缝合,本实验经腹修补胃穿孔采用疏松的间断缝合,但实验组所有大鼠术后无腹胀、腹泻及腹膜炎的表现,也未发生腹腔脓肿或消化道漏,健康状况良好。对照组3只大鼠术后3天内再次出现修补部位穿孔,死亡,可能是由于本实验术后仅禁食1天,且没有应用质子泵抑制剂,PLA膜被胃酸等消化液所腐蚀。临床上PLA膜用于内镜下修补消化道穿孔或预防ESD术后穿孔一般穿孔或创面都比较小,且配合胶原蛋白胶封堵创面,术后禁食4~7天且常规应用质子泵抑制剂,所以取得较好的临床效果。本实验在术后仅禁食1天且没有应用质子泵抑制剂的情况下,GTR胶原蛋白膜取得明显优于PLA膜的结果,说明GTR胶原蛋白膜致密层一侧在激发自体修复反应过程中能发挥隔膜屏障作用,保护缺损组织再生所需要的空间,促进损伤区域早期自我修复。术后3天胶原蛋白膜与胃壁贴合(图1A),胶原蛋白膜疏松侧大量肉芽组织增生,伴有炎性细胞浸润(图1B、C、D),说明疏松层一侧可为肉芽组织和微血管的生长提供支架,促进组织细胞增殖和生长因子等局部富集,形成有利于组织再生的微环境,促进组织快速修补,仅1周时间实现缺损、穿孔有效闭合,且新生部位黏膜部分再生,至术后6周缺损部位黏膜完全再生;而对照组PLA膜修补术后6周黏膜面依然存在(1.39±0.20)mm2的黏膜缺损,低于实验组术后4周水平(P<0.01)。实验组术后1周组织中炎性细胞、巨噬细胞和成纤维细胞增生与新生肉芽组织并存,新生毛细血管生成,但无炎性细胞的过度增殖(图3)。损伤早期的炎症反应是组织修复所必需的,但过度的炎症反应会导致炎症因子大量激活,促进成纤维细胞过度增殖,分泌过多的胶原纤维,进而导致瘢痕组织增生[26],使一期愈合变为二期愈合,阻碍组织结构恢复。此胶原蛋白膜去除了胶原蛋白中的末端抗原肽,有效降低免疫原性,避免免疫和炎症反应过度激活;纵观整个修复过程,既没有明显的瘢痕形成及组织挛缩(图2B),也没有胶原蛋白过度增生,无明显纤维化(图3C)。说明胶原蛋白膜在促进组织修复和再生过程中并不完全依靠炎性细胞浸润、成纤维细胞增殖及其分泌的胶原纤维实现修补,GTR胶原蛋白膜的生物学特性及其特殊结构在修复过程中也扮演重要角色。术后6周新生部位黏膜、黏膜下层和肌层结构趋于正常化(图3),此胶原蛋白膜不仅实现穿孔快速修补,还促进组织再生和结构恢复。而对照组术后6周新生部位组织结构依然紊乱,炎性细胞大量浸润(图3)。
综上,GTR胶原蛋白膜独特的双层结构能够快速封堵缺损部位,促进组织再生,重建消化道完整结构,实现组织结构和功能恢复,效果明显优于PLA膜。该类材料将为难治性消化道瘘的快速康复带来希望。
