免疫相关胆汁淤积性肝病的病理学特征
2019-05-08
免疫相关胆汁淤积性肝病是一组由异常自身免疫介导的肝胆炎性疾病,包括以小胆管损伤为主的原发性胆汁性胆管炎(PBC )和以中大胆管病变为主的原发性硬化性胆管炎(PSC)、免疫球蛋白G4相关性硬化性胆管炎(IgG4-SC)。这些疾病的诊断常需结合临床表现、血清自身抗体及肝脏组织学进行综合判断,尤其是临床表现非特异性、自身抗体阴性的患者,肝脏病理组织学在诊断中发挥着重要作用。本文就这些疾病的病理组织学表现作一综述。
1 PBC
原发性胆汁性胆管炎(PBC ),以往称为原发性胆汁性肝硬化,后因并非所有患者都进展为肝硬化而更名[1]。PBC是一种慢性肝内胆汁淤积性疾病,组织学上以Hering管和小叶间胆管破坏为特征[2]。PBC多见于中年妇女,临床表现为黄疸和瘙痒,结合碱性磷酸酶(ALP)升高和血清抗线粒体抗体(AMA)阳性即可确诊。通常无需行肝脏活组织检查,仅当AMA阴性或怀疑合并其他疾病时需行组织学检查[3]。
1.1 组织学表现
PBC超早期病变为Hering管(CK-19标记)的破坏消失,早期的特征性表现为慢性非化脓性破坏性胆管炎(CNSDC),又称旺炽性胆管病变。以CD8+T细胞为主的炎性细胞攻击小叶间胆管(直径40~100 μm),可伴有嗜酸性粒细胞和浆细胞浸润,偶见B细胞组成的淋巴滤泡及CD1a+的郎罕细胞[4]。有趣的是,大多数AMA阳性、ALP正常者也会有明显的胆管病变[5]。受损的胆管出现上皮水肿、不规则及凋亡,可见淋巴细胞浸润(图1A)及基底膜破坏。胆管破坏后磷脂样物质渗出诱发周围组织细胞吞噬及上皮样细胞聚集,形成非干酪样坏死性上皮样肉芽肿(图1B),CD11c免疫组织化学可提高检出率[6]。结节性再生性增生也较为多见[7]。早期PBC的组织学分布不均,大块或多处活组织检查有助于提高确诊率。随着病变进展,破坏的胆管会缺失,仅留下淋巴细胞聚集灶或过碘酸-雪夫(PAS)阳性的胆管基底膜残留物。胆管往往与肝动脉伴行,门管区若出现孤立的肝动脉需警惕胆管缺失的可能,必要时加用CK7或CK19以明确胆管数量,一般至少超过1/2门管区未见胆管即定义为胆管缺失。
门管区炎性反应和胆管破坏通常会延伸至相邻肝小叶,引起肝细胞损伤,形成类似于自身免疫性肝炎或病毒性肝炎的界面性肝炎。与之不同的是,PBC的界面炎常表现为胆汁性,即增生的细胆管可随浸润的炎性细胞伸入肝界板内。肝细胞出现羽毛样变、铜结合蛋白沉积、胆汁淤积及Mallory-Denk小体,部分呈胆管上皮化生(CK7染色阳性,图1C)。此外,胶原纤维沉积会导致纤维间隔形成。中期PBC的典型表现为胆管缺失伴有胆汁淤积、桥接纤维化。随着病变的进一步进展,PBC患者会出现胆汁性肝硬化(终末期)。与病毒性或酒精性肝硬化不同,PBC所致肝硬化的再生不太显著,硬化结节中央仍保留中央静脉,纤维间隔中见细胆管反应,周围常有水肿形成的空晕样结构,且结节大小不一,形成“七巧板样”结构。
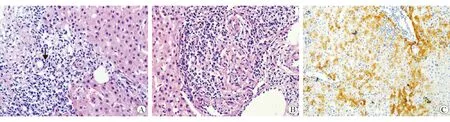
图1PBC的组织学特征A淋巴细胞浸润胆管(箭头) 苏木精-伊红染色 ×400B非干酪样坏死性上皮样肉芽肿 苏木精-伊红染色 ×400C肝细胞胆管上皮化生 CK7染色 ×200
1.2 分级和分期
PBC分期常沿用Scheuer和Ludwig系统[8-9],两者差异不大,均简单而易于操作,但其存在的问题是:(1)判断的主观性较大;(2)肝脏活组织检查的标本较小,易产生抽样误差;(3)不能反映胆汁淤积程度。2010年Nakanuma等[10]提出了新的分级分期系统,其分期系统包括3项指标:纤维化、胆管缺失和肝细胞内铜结合蛋白(地衣红染色阳性),每项分值为0~3,根据总和判断组织学进展程度。分级系统将胆管损伤和肝细胞损伤(包括界面炎和小叶炎)分开计算。新系统较老系统更为复杂,但其优势在于:(1)通过纤维化、胆管缺失和胆汁淤积这3项指标来判断分期更为精准;(2)新增的胆管和小叶炎性反应强弱可反映免疫损伤的程度;(3)可有效减少肝脏活组织取材时因病变程度分布不均而引起的样本误差[11-12];(4)与生物化学指标及Child-Pugh分级有更好的相关性,可为终末期患者提供更多的预后预测信息[13]。
1.3 鉴别诊断
1.3.1 PSC PSC的典型组织学表现为“洋葱皮样”纤维化,与以旺炽性胆管损伤为表现的PBC鉴别并不困难。但当两者的组织学表现均不典型时(如细胆管反应、胆管缺失、慢性胆汁淤积),鉴别较为困难。一般而言,PSC的炎性反应程度较轻,门管区中度炎性反应则PBC的可能性大。
1.3.2 自身免疫性肝炎 少数PBC患者与自身免疫性肝炎(AIH)患者可出现自身抗体交叉阳性,且PBC可有轻度界面性肝炎,AIH亦可伴有胆管损伤。组织学上最有效区分AIH与PBC的表现为,前者有小叶内炎性反应和嗜酸小体,但没有旺炽性胆管病变及胆管缺失。
1.3.3 药物性肝损伤 该病也会出现门管区炎性反应、细胆管反应和胆汁淤积,其与PBC的不同之处在于,药物性肝损伤引起的细胆管反应较轻,往往不伴有纤维化,且胆汁淤积出现在病程早期。
1.3.4 大胆管梗阻 一般情况下,该病可通过影像学检查诊断,无需行活组织检查。急性期的组织学表现为门管区水肿,炎性细胞浸润及细胆管反应。小叶内胆汁淤积也可见,而PBC胆汁淤积一般见于晚期。此外,胆管缺失多见于PBC。
1.3.5 结节病 该病也可出现肉芽肿,但其数量较PBC更多,且肉芽肿周围常伴有网状纤维和纤维化,肺部常有病灶。
2 PSC
PSC是一种少见的以肝内外胆管弥漫性纤维化甚至狭窄为特征的进行性胆汁淤积性肝胆疾病,最终导致胆汁性肝硬化和肝功能衰竭[14]。
2.1 组织学表现
PSC的基本组织学改变是中等或大胆管(直径>100 μm)管周纤维化以及胆管上皮变性、萎缩,最终被透明瘢痕组织取代,少数仅累及小胆管。由于进展缓慢,不同患者可能在诊断时处于不同阶段,因此组织学多样。在病变初期,门管区轻度慢性炎性反应伴有细胆管反应,胆管和小叶内炎性反应均轻微(儿童患者例外,炎性反应较重),不伴有胆汁淤积。当病变进展后,门管区出现纤维化,进而出现桥接纤维化和肝硬化。部分活组织检查可见胆管缺失和典型“洋葱皮样”纤维化或纤维闭塞性胆管病变(图2)。值得一提的是,“洋葱皮样”纤维化常常被过度诊断,尤其患者伴有溃疡性结肠炎时。通常情况下,采用活组织诊断该表现时需结合其他梗阻性胆道疾病的表现。PSC主要累及大胆管,肝穿刺活组织检查的诊断率不高,采用手术切除标本更易诊断。因此,只有在诊断小胆管型PSC或怀疑PSC-AIH重叠综合征时才需行肝脏活组织检查[15]。
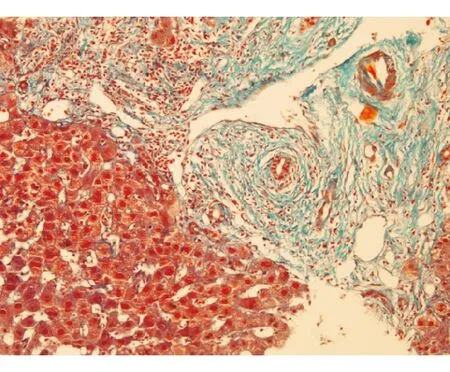
图2 PSC的“洋葱皮样”纤维化 MASSON染色 ×200
2.2 组织学分期
Nakanuma评分、Ishak评分及Ludwig评分系统均适用于PSC的组织学分期[16]。
2.3 鉴别诊断
PSC需与PBC、继发性硬化性胆管炎、缺血性胆管炎以及IgG4-SC鉴别(详见后文)。与PBC相比,PSC的胆管炎性反应程度往往较轻,以胆管上皮变性、萎缩、消失为主,有时可见胆管周围纤维化,而非干酪样肉芽肿则多见于PBC。继发性硬化性胆管炎往往发生于手术后、肝外结石、移植后等,结合临床病史和影像学检查易于鉴别。缺血性胆管炎是由于血流受阻造成局灶或广泛的胆管损伤,多见于外科腹部手术或创伤所致的肝动脉损伤、血栓性疾病等,其表现为上皮萎缩显著,进而脱落形成胆管铸型,可有胆管缺失。
3 重叠综合征
重叠综合征指某些患者既有AIH的临床和病理表现,又有PBC或PSC的特征。目前临床上主要包括AIH-PBC和AIH-PSC。有研究显示,5%~15%的PBC患者可合并AIH[17]。由于PBC可表现为门管区淋巴-浆细胞浸润及轻度界面炎,少数AIH患者也可表现为胆管损伤,因此组织学上诊断AIH-PBC重叠综合征需谨慎。诊断时组织学上需同时满足胆管炎和(或)胆管缺失及中-重度界面炎和(或)小叶炎。AIH-PSC重叠综合征需在确诊PSC的基础上,组织学检查见显著的界面性肝炎伴淋巴-浆细胞浸润。总而言之,只有存在典型的界面性肝炎,并有明确的旺炽性胆管病变或纤维阻塞性胆管炎时,才可考虑有重叠综合征的可能[18]。
4 IgG4-SC
IgG4-SC的临床表现为梗阻性黄疸、胆管狭窄、管壁增厚、包块形成及血清免疫球蛋白G4(IgG4)升高,其占所有IgG4相关疾病的5%~10%,常合并自身免疫性胰腺炎,多见于中老年男性,对激素治疗反应良好[19]。
4.1 组织学表现
IgG4-SC常累及大胆管,包括肝外、肝门部、门周部的胆管,故手术标本更易于诊断[19]。受累的胆管管壁弥漫性增厚,也可表现为炎性包块。IgG4-SC的组织学表现与其他脏器的IgG4相关疾病相似,主要包括:(1)大量淋巴-浆细胞浸润形成透壁性炎性反应,常伴随中量的嗜酸性粒细胞。胆管上皮通常完整,炎性反应局限于门管区,仅少量会延伸至小叶内。(2)纤维组织增生形成编织或螺旋状,称为席纹状纤维化(图3A)。(3)静脉管壁被炎性细胞和纤维组织包绕,形成闭塞性静脉炎。低倍镜下见到未成对的动脉时需警惕静脉闭塞可能,弹力纤维染色有助于显示病变,单纯静脉闭塞而无炎性细胞浸润则需排除血栓机化[20]。(4)IgG4阳性浆细胞计数应选择在最高表达区,观察3个400倍的高倍视野区(HFP)后取均值,手术切除标本的IgG4阳性浆细胞>100个/HFP或活组织检查标本的IgG4阳性浆细胞>10个/HFP有助于诊断(图3B)。此外,IgG4阳性细胞和(或)IgG阳性细胞>40%有助于区分IgG4-SC与其他淋巴-浆细胞性胆管炎[21]。IgG4-SC的活组织检查标本的组织学多样,门管区可有纤维化或浆细胞浸润、细胆管反应,小叶内炎性反应、胆汁淤积也可见。相对特征性的表现包括IgG4阳性浆细胞增多(>10个/HPF)及门管区炎性小结节(由梭形细胞、淋巴细胞、浆细胞和嗜酸性粒细胞组成)[22-24]。

图3IgG4-SC 的组织学特征A席纹状纤维化伴淋巴-浆细胞浸润 苏木精-伊红染色 ×200B大量IgG4阳性浆细胞浸润 IgG4染色 ×400
4.2 鉴别诊断
4.2.1 胆管癌 胆管癌和IgG4-SC均可表现为胆道梗阻,两者的影像学检查及临床表现相似,有时需手术后才能明确;尤其当血清IgG4在135~300 mg/dL时区分困难[25]。在组织学上,胆管癌组织中可见IgG4阳性浆细胞浸润,但多数是局灶性的。
4.2.2 PSC PSC的胆管损伤多在管腔面(胆管上皮),伴有溃疡形成,而IgG4-SC则表现为透壁性炎性反应,胆管上皮受累较少[26]。闭塞性静脉炎、席纹状纤维化及炎性包块提示IgG4-SC,PSC患者的静脉管腔也可能阻塞,但不伴炎性细胞浸润。需注意的是,PSC患者的大胆管可能有中量甚至大量的IgG4阳性浆细胞。研究显示23%(10/98)的PSC肝移植标本中,IgG4阳性浆细胞>10个/HFP[27];另一项研究则提示5%(2/41)的 PSC标本中IgG4阳性浆细胞>100个/HFP[28]。因此,IgG4-SC的诊断除了依据IgG4阳性浆细胞外,还需结合其他组织学表现。
4.2.3 滤泡性胆管炎 滤泡性胆管炎是一种罕见疾病,表现为肝门周围胆管狭窄,组织学上胆管周围见多个淋巴滤泡,可见IgG4阳性浆细胞,但呈局灶性分布,且IgG4阳性细胞和(或)IgG阳性细胞<40%[29],通常不伴有闭塞性静脉炎和席纹状纤维化。
5 结语
综上所述,病理组织学在免疫相关胆汁淤积性肝病的诊断中发挥着重要作用。通常PBC以门管区慢性非化脓性破坏性胆管炎为主,PSC则炎性反应较轻,以胆管周围纤维化为特征,IgG4-SC兼有炎性反应(IgG4阳性浆细胞浸润)和纤维化(席纹状纤维化)。在胆管损伤方面,PBC引起小胆管破坏,PSC造成中-大胆管萎缩,而IgG4-SC患者的胆管上皮损伤不明显。结合上述几点可对这3种疾病进行鉴别。对于组织学表现不典型的患者,病理科医生与临床医生加强联系和沟通有助于提高诊断率。
