β1肾上腺素能受体自身抗体表达增强对心房颤动及心房电重构的影响*
2019-05-05邵梦娇张玲商鲁翔石佳冯敏李耀东汤宝鹏周贤惠
邵梦娇 张玲 商鲁翔 石佳 冯敏 李耀东 汤宝鹏 周贤惠
近年来研究证实β1肾上腺素能受体自身抗体(β1 adrenergic receptor antibodies,β1AR)表达增强在心律失常发生中发挥一定的病理生理作用[1-2],在不适当窦性心动过速和房性心律失常患者中均可检测到β1AR表达增强[3-5]。而非瓣膜心房颤动(AF)患者血清中β1AR表达增强,同时自身抗体水平对导管消融术后复发起预测作用,是AF消融术后的独立预测因子[6]。然而β1AR表达增强诱发AF的机制,目前尚不清楚。笔者拟通过β1肾上腺素受体细胞外第二环功能表位肽段(β1多肽)建立β1AR阳性的兔模型,观察β1AR表达增强促进AF发生及维持是否与心房电重构相关。
1 材料与方法
1.1实验动物及分组 成年新西兰大白兔24只,体重为2.5~3.5 kg,由新疆医科大学动物中心提供[许可证号:SYXK(新)2010-0001],温度18~25℃,相对湿度40%~60%,光照明暗各12 h,每笼1只,自由摄食和饮水。实验设计和操作已通过新疆医科大学第一附属医院使用管理伦理委员会批准(许可证号:IACUC-20170420-03 ) 。
24只新西兰大白兔通过随机数字表随机分为两组:对照组(Con组,n=12)和β1AR组(n=12)。
1.2β1多肽免疫 每次免疫使用分离纯化的2 mg多抗原肽(包含β1受体细胞外第二环功能表位肽段氨基酸序HWWRAESDEARRCYNDPKCCDFVTNR,GenScript,Piscataway,NJ)[7],另外给予1 ml Freund′s佐剂(第1次免疫使用完全弗氏佐剂,第2次及以后使用不完全弗氏佐剂,美国sigma公司)用涡旋混合器充分混合,使其完全乳化。每两周免疫一次,共免疫4次。每次采用常规微量免疫法免疫兔,沿背部皮下多点注射。每次免疫前采耳缘静脉血备用。Con组为正常新西兰大白兔,与β1AR组同时开始饲养,除不加β1多肽外其余同β1AR组处理。
1.3β1AR水平的测定 于0、2、4、6 w采耳缘静脉血,收集的全血置于室温下1 h,3 000转离心取血清,通过酶联免疫吸附测定血清中抗体免疫情况,观察血清内抗体效价是否增加来验证造模是否成功。将β1AR多肽 (100 ug/100 ul)溶解于19.9 ml 无水硫酸钠中,配制成终浓度为5 μg/ml 的抗原包被液。将20 mL包被液,每孔以50 ul 量包被酶标板。血清按1∶10 000浓度进行倍比稀释后,以50 ug/孔在酶标板上加入倍比稀释的血清。带有碱性磷酸酶的山羊抗兔IgG用以检测结合抗体1 h后在450 nm测光密度值(OD),每次测定均设有空白对照和阴性、阳性对照。
1.4心内电生理检测 心内电生理检测包括心房有效不应期(AERP)的测定、AF诱发率、AF持续时间的测定及平均心率的记录。每只兔在免疫前的基础状态和免疫后8周行心内电生理检测。术前12 h禁食,6 h禁饮。氯胺酮 (20 mg/Kg)基础麻醉,3%戊巴比妥钠维持麻醉,静脉推注肝素1000 U抗凝。将兔仰位固定于兔台上,备皮、固定、气管插管和辅助呼吸,调节氧流量4~6 L / min,潮气量为10 mL/kg,呼吸压力0 ~ 2 KPa。采用LEAD- 7000 电生理仪(四川锦江电子科技)行心内电图和体表心电图监测。分离暴露颈静脉,切开后置入6F鞘管,经鞘管插入一根 4F十极电极(电极间距2 mm)至心内膜高右房(HRA)做记录电极,刺激电极为记录电极的相邻电极。以心内电生理图出现高大 A波小V波为理想记录图,固定电极导管,观察波形保证每只动物测量部位大致相同。①心房有效不应期(AERP)的测定:以高出窦性心率 10 %~ 20 %的频率起搏,脉宽0.5 ms, 测定起搏阈值。以起搏阈值 2 倍为输出电压, 采用 S1S2递减刺激测量AERP,S1S2=220 ms,S1∶S2=8∶1,步长 5 ms。以不能下传心房的最长的S1S2间期为 AERP。②AF诱发率及持续时间:测定通过Burst刺激(持续约3~5 s),20 Hz频率,2倍舒张期阈值电压。刺激的位置位于右心房,Burst刺激的位置选在A波大,V波很小的位置。记录刺激后非持续性或持续性心律失常的诱发情况。记录刺激后非持续性(<5 s)或持续性(≥5 s)心律失常的诱发情况。每只兔给予5次刺激,每组共给予60次刺激。心律失常的定义遵循Lambeth Conventions心律失常分类法[8]。窦性心动过速定义为规则,快速的心率≥200 次/分伴1∶1 房室传导,心房激动起源于窦房结,心内电图心房电图发生于P波的起始;房性心动过速: 规则,快速的心率≥200 次/分,有一个固定的A-A间期伴心内电图心房电图发生于P波之后(一般位于P波尖峰左右)。心房扑动:规律,快速的心房率≥250次/分,规律的明显的P波在QRS波之间。交界性心动过速:规则,快速的心房率≥200次/分,伴1∶1房室传导,心内电图中相关ECG导联心房电图恰好优先于QRS波群。AF:不规则,快速的心房率≥500 次/分,R-R间期绝对不等。心房率大于心室率。③平均心率的测定:至少连续测量10个心室周期后根据这10个心动周期的时间换算为一分钟的次数。反复测量3次取平均值。
1.5离子通道蛋白及缝隙连接蛋白水平的测定 安乐死处死动物后,留取左房心肌,厚约2cm。①应用Westernblot分析Kir3.1、Cav1.2及缝隙连接蛋白(Cx43,Cx40)的表达量,相应的一抗分别为Connexin 43 / GJA1小鼠单克隆抗体(ab11369,abcam公司;稀释比例:1∶400 )、缝隙连接蛋白40抗体(bs-1050R,北京博奥森公司;稀释比例:1∶500)、Anti-CACNAlC抗体(ab84814,abcam公司;稀释比例:1∶400)和Anti-KCNJ3(ab116126,abcam公司;稀释比例:1∶500)检测方法如以前研究所述,以内参β-actin(BM0627,博士德生物公司;稀释比例1∶600)条带光密度值作为标准 ,计算相关蛋白表达的相对量。②mRNA表达的检测:测量指标同westernblot,采用Trizol一步法提取总RNA并用DNA酶处理,按试剂盒说明一步法逆转录为cDNA,再进行聚合酶链反应(PCR)扩增RNA,双向引物由上海生物工程有限责任公司提供。用凝胶成像系统扫描分析,以内参 β-actin mRNA 条带光密度值作为标准 , 计算mRNA表达的相对量。上下游引物见表1。
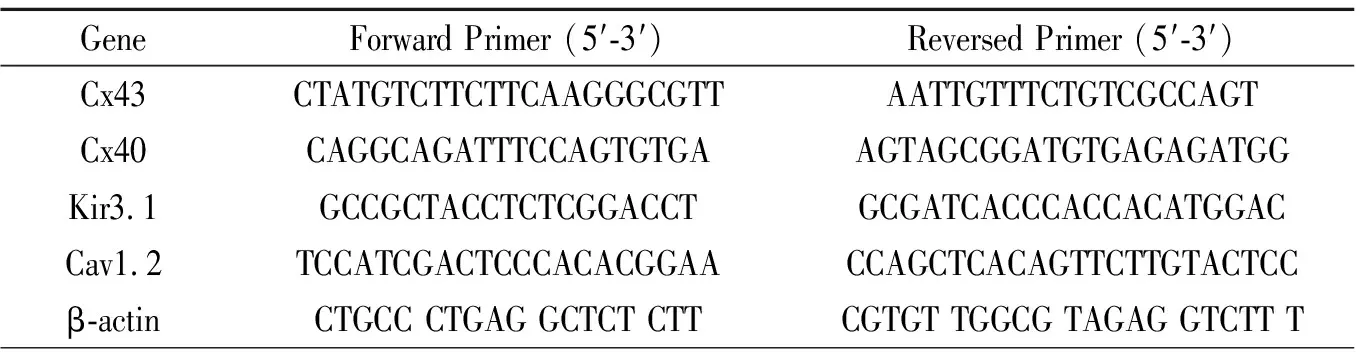
表1 PCR引物序列

2 结果
24只新西兰大白兔造模过程中无死亡,均完成实验。
2.1两组各时间点血清中β1AR的水平 0w时Con组与β1AR组抗体水平无差异(P>0.05)。与Con组相比,β1AR组随着时间点的推移血清中β1AR水平显著升高,与0w及Con组相应时间点比较有差异(P<0.05),见表2。
2.2AF诱发率及持续时间 免疫前Con组与β1AR组心律失常发生率无差异[8.3% (1/12) vs 8.3% (1/12),P>0.05], 两组均有1只发生窦性心动过速,无AF发生。免疫后β1AR组心律失常发生率高于Con组[83.3%(50/60) vs 18.3%(11/60),P<0.05]。其中β1AR组发生AF 20次,占33.3%,其中11次为持续性AF,持续时间(24.66±40.92)s;Con组未发生AF,见图1。

表2 两组各个时间点血清内β1AR表达水平/(ng/L)
注:w =周;与Con组比较,*P< 0.05 ;与同组0 w比较,#P< 0.05

A:Con组免疫前,Burst刺激后出现窦性心律,心率157次/分;B:β1AR组免疫前Burst刺激后出现窦性心动过速,心率240次/分;C:Con组免疫后Burst刺激后出现窦性心律,心率160次/分;D:β1AR组免疫后Burst刺激后出现AF,心率210次/分
图1两组免疫前后的心电图
2.3AERP及心率改变 两组免疫前AERP及心率无差异,Con组免疫后较免疫前心率增快,但AERP无差异。β1AR组免疫后较免疫前及Con组免疫后AERP缩短和心率显著增快(P均<0.05),见表3。

表3 兔模型免疫前后电生理指标
注:与Con组比较,*P<0.05;与同组免疫前比较,#P<0.05
2.4离子通道蛋白及缝隙连接蛋白的表达 与Con组比较,β1AR组Cx43和Cav1.2降低;Cx40和Kir3.1升高,见表4,灰度图见图2。
2.5离子通道蛋白及缝隙连接蛋白mRNA的表达 与Con组相比,β1AR组Cx43和Cav1.2显著降低, Cx40和Kir3.1显著升高,见表5。

表4 各组离子通道蛋白及缝隙连接蛋白表达相对值
注:与Con组比较,*P<0.05

图2 各组离子通道蛋白及缝隙连接蛋白的表达
3 讨论
β1AR是心脏G蛋白耦联受体(GPCR)成员,构成心脏β肾上腺素能受体补体的70%~80%,正常机体中含量低,无影响。病理性增高会诱发AF[5]。本研究用2 mg β1受体细胞外第二环功能表位肽段与等体积佐剂的混合,采用常规微量多次免疫法,背部皮下多点注射。经过6周β1AR的免疫,随着时间的推移血清中抗体效价增高,但未注射的对照组抗体效价基本无变化,可说明模型制作成功。β1AR升高会缩短ERP、提高AF发生率,并导致心房电重构,而电重构为已知的AF促发AF的机制之一,但β1AR致AF和电重构的具体机制尚不明确,可能与其能特异性识别受体第二胞外环,在体外心肌细胞中起着一种拟交感神经作用相关,拟交感作用可以引起肾上腺素分泌增加,激活β肾上腺素通路,促进离子通道改变,促进电重构[4]。

表5 各组离子通道蛋白及缝隙连接蛋白mRNA表达相对值
注:与Con组比较,*P<0.05
本研究还发现,β1AR表达增加会减少心房肌细胞Cav1.2、增加Kir3.1;减少Cx43、增加Cx40。 Cav1.2是钙电流,是复极相主要内向电流,其减弱使外向电流相对增加从而使心肌复极加快和ERP缩短。乙酰胆碱敏感钾通道(KAch)是由Kir3.1(GIRK1)和Kir3.4(GIRK4) 组成的四聚物从而加大了复极电流,缩短了AERP。我们猜测可能原因是:β1AR特异性识别受体第二胞外环,在体外心肌细胞中起着一种拟交感神经的作用,能激活β肾上腺素受体信号通路,通路激活后引起Gs和Gi蛋白激活,导致蛋白激酶A(PKA)激活和心肌细胞靶通道经环磷酸腺苷(cAMP)介导磷酸化[9]。而减少cAMP和PKA的产生使L型钙通道离子流密度减小,失活后恢复减慢[3]。Gs蛋白又能激活KAch,其开放促进K+外流使膜超极化,KAch的组成基因也相应的上调,从而加大了复极电流,缩短了AERP,使心房进一步发生电重构[10]。
Cx43和Cx40是构成心房细胞缝隙连接的主要亚基,Cx43是心肌缝隙连接通道含量最丰富的连接蛋白,在闰盘以端对端分布为主[11-12]。Cx40 绝大多数位于心肌横向边界参与心肌的横向传导,Cx40 表达水平的增加,就会导致心房肌局部传导各向异性不均匀一致,其结果是增加AF的易感性,与AF患者心肌易损性增加密切相关[13]。本研究中,与Con组相比,不管是在蛋白水平,还是mRNA水平上,β1AR组心房肌组织中 Cx40 表达水平明显增高而 Cx43 表达水平显著降低。可能的机制是:β1AR特异性拟交感神经的作用,而β1AR表达增强可以促进 Cx43的降解。也有研究表明,Cx43的低表达与Cx40的高表达与交感神经活性增强有关,而交感神经激活又可以激活β肾上腺素通路引起了心肌细胞离子通道改变,最终导致引起电重构[14]。因此,针对自身抗体阳性的AF患者,可能提供了一种调控自身免疫的新型治疗策略。
