高海拔环境下大鼠血浆、肺组织SOD活力和MDA含量及肺组织AngⅡ mRNA表达观察
2019-02-13石雪峰解友邦苟三玉蒋慧顾玉海
石雪峰,解友邦,苟三玉,蒋慧,顾玉海
(青海省人民医院,西宁810007)
高原低压低氧环境存在于中国约四分之一的地区,人类由低海拔地区进入高原,容易因环境氧分压变化造成组织缺氧从而引起急性或慢性高原病,严重影响人类健康。低氧及低氧/复氧可以导致内源性活性氧簇(ROS)爆发性产生,随之ROS再介导全身组织细胞反应,引起一系列的氧化应激反应。机体内氧自由基主要包括氧化应激所产生的氧簇不完全反应产物烷氧自由基(RO·)、超氧阴离子及羟自由基(-OH)等,易失去电子(氧化)或获得电子(还原),是一类化学性质很活泼的ROS。生理情况下,ROS的生成与抗氧化体系清除处于动态平衡,ROS在机体中发挥着有益作用,如清除衰老细胞、杀灭病原微生物等。一旦平衡被打破,ROS生成增多,氧化应激损伤随即启动,攻击DNA、脂质及蛋白质等造成机体损伤。活性氧化学性质活跃且形状不稳定,一般实验室应用氧化反应的产物间接反映氧化应激反应水平,常见的标志物有丙二醛(MDA)、超氧化歧化酶(SOD)[1]。肺组织作为机体的核心代谢器官,肺泡氧分压含量位居其他脏器之首,且富含线粒体,决定了其成为ROS攻击的主要器官。2014年11月~2018年2月,本研究通过模拟高海拔低氧环境观察大鼠血浆及肺组织中SOD活力、MDA含量及肺组织AngⅡ mRNA的表达变化,并探讨了三者之间的相关性,为探讨急性肺损伤的机制提供理论基础。
1 材料与方法
1.1 动物、试剂及仪器 6周龄左右的清洁级雄性Wistar大鼠,体质量110~120 g,适应性喂养1周;SOD、MDA检测试剂盒购自南京建成生物公司,TRIzol购自美国Invitrogen公司,反转录试剂盒购自日本TAKARA公司;低压氧舱室、-80 ℃低温冰箱、常温高速离心机、半自动生化分析仪、数显恒温水浴锅、全自动血常规分析仪、7500 FAST QPCR仪。
1.2 分组及待测血浆、肺组织的留取 56只Wistar大鼠中,低海拔组(兰州,海拔1 500 m)8只、中海拔组(西宁,海拔2 260 m) 8只及高海拔组40只(低压氧舱,模拟海拔5 000 m)。其中低海拔组在兰州采购当日取血样本及肺组织样本,中海拔组在西宁采购后饲养30 d取血样本及肺组织样本,高海拔组置于低压氧舱模拟海拔5 000 m,分别饲养1、3、7、15、30 d取肺组织样本,其中饲养30 d时同时取血样本。均留取肺组织上清和血浆在-80 ℃冰箱内保存,统一在西宁检测,各组间体质量比较,P均>0.05。肺组织上清的留取:将肺组织清洗、称重、研磨后收集于Eppendorf中,5 000 r/min离心5 min,留取上清。血浆抽取:抽取下腔静脉血约5 mL置于抗凝管内,3 000 r/min离心10 min,分离血浆,置于Eppendorf管内,均储存于-80 ℃冰箱内。
1.3 血浆及肺组织SOD活力、MDA含量的检测 采用水溶性四氮唑(WST-1)法检测各组血浆SOD活力,低海拔组及高海拔组饲养1、3、7、15、30 d大鼠肺组织SOD活力。采用硫代巴比妥(TBA)比色法检测各组血浆MDA含量,低海拔组及高海拔组饲养1、3、7、15、30 d大鼠肺组织MDA含量。
1.4 肺组织AngⅡ mRNA表达检测 采用qRT-PCR法。液氮研磨肺组织后加入TRIzol,按照产品说明书提取组织总RNA,并通过紫外分光光度计检测RNA的纯度及浓度。按照日本TAKARA公司逆转录试剂盒说明书进行逆转录,以逆转录获得的cDNA为模板,以β-actin为内参,用SYBR法检测AngⅡ mRNA的表达,AngⅡ引物:上游:5′-GGGAAGGGAATGAGGCTTAC-3′;下游:5′-GGTTGGCTGATGCTGCTTAT-3′;β-actin引物:上游:5′-GCGGGAAATCGTGCGTGAC-3′;下游:5′-GGAAGGAAGGCTGGAAGAG-3′,循环数为40个循环,以2-△△CT法计算目的基因相对表达量。
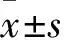
2 结果
2.1 不同海拔组大鼠血浆SOD活力、MDA含量比较 低、中、高海拔组血浆SOD活力分别为(19.98±1.57)、(19.06±1.24)、(10.34±1.19)U/mL,MDA含量分别为(2.28±0.68)、(2.76±0.34)、(10.34±1.19)nmol/mL,血浆SOD活力比较:低海拔组>中海拔组>高海拔组(P均<0.01);血浆MDA含量比较,低海拔组<中海拔组<高海拔组(P均<0.01)。
2.2 不同海拔组大鼠肺组织MDA含量、SOD活力、AngⅡ mRNA相对表达量比较 低海拔组,高海拔组饲养1、3、7、15、30 d血浆SOD活力分别为(439.85±33.80)、(554.07±24.59)、(486.78±18.78)、(403.71±16.57)、(341.98±17.89)、(295.98±11.08)U/mg prot,MDA含量分别为(1.81±0.24)、(2.39±0.35)、(2.99±0.34)、(3.44±0.30)、(4.03±0.88)、(4.66±0.74)nmol/mg prot,AngⅡ mRNA相对表达量分别为0.39±0.12、0.51±0.27、0.98±0.18、1.21±0.38、1.54±0.24、1.89±0.87。高海拔组饲养1 d肺组织SOD活力及MDA含量高于低海拔组(P均<0.05);SOD活力在高海拔组饲养1 d升高,随高海拔暴露时间的延长其活力呈逐渐降低趋势(P均<0.05);与高海拔组饲养1 d相比,饲养3、7、15、30 d MDA含量升高,且随高海拔暴露时间延长,MDA含量呈逐渐升高趋势(P均<0.05);与低海拔组相比,高海拔组饲养3、7、15、30 d AngⅡ mRNA表达升高(P均<0.05),且AngⅡ mRNA的表达随暴露于高海拔环境时间的延长呈逐渐升高趋势(P均<0.05)。
2.3 高海拔组大鼠肺组织AngⅡ mRNA与MDA、SOD的相关性 高海拔组大鼠肺组织AngⅡ mRNA表达与SOD活力呈负相关(r=-0.729,P<0.01),与MDA含量呈正相关(r=0.952,P<0.01)。
3 讨论
高海拔低压低氧环境存在于中国约四分之一的地区,人类由低海拔地区进入高原,容易因环境氧分压变化造成组织缺氧从而引起急性或慢性高原病,严重影响人类健康。目前关于高海拔低氧环境所致急慢性高原病发病机制尚不十分清楚,推测可能与炎性反应、肺内血管收缩、内皮功能紊乱、交感神经的激活等机制有关。本研究旨在通过研究高海拔环境下大鼠血浆及肺组织氧化应激反应及肺组织AngⅡ mRNA表达的变化,探索高海拔环境对肺组织的损伤机制。
氧化应激是指机体受到多种因素刺激后产生活性氧,从而导致机体氧化、抗氧化体系失衡。ROS是一系列化学性质活泼的含氧功能集团化合物,包括氧自由基和各种非自由基含氧物。一旦ROS相对或绝对增多就会造成氧化应激损伤,自由基积累和脂质过氧化反应增强使细胞膜蛋白的巯基受到了攻击,脂质微环境发生变化,蛋白质交联,从而破坏了膜的完整性和通透性,引起全身各个器官广泛性损伤。ROS作为细胞间的信使,可以活化多条信号通路,间接引起人体正常细胞的功能失调和结构破坏,从而引起全身多处器官功能损害。缺氧刺激产生的氧自由基来源于机体的各个细胞、溶酶体及线粒体等,可释放氧自由基进入血液循环。研究发现,通过给予氧自由基清除剂能够清除因缺血缺氧而产生的过多的氧自由基,减轻其对机体的损伤。
MDA是由氧自由基攻击细胞膜中的多聚不饱和脂肪酸引起脂质过氧化产生的,为氧化应激毒性中间产物,反映组织中自由基的含量和自由基引发的脂质过氧化反应程度、可以间接反映组织中ROS水平。SOD是体内重要的抗氧化酶,普遍分布于自然界中各个生物体内,可以催化超氧化物转化为氧气和H2O2。其作为主要氧自由基清除剂之一,功能是移除细胞中的超氧阴离子,当体内自由基生成增多时,它与O2-反应生成H2O2。机体内自由基通过线粒体或者细胞中SOD等抗氧化作用降低H2O2毒性,从而使自由基清除,保护细胞免受损伤。有研究显示,低氧条件下SOD的生成是降低的。至目前为止,多项研究[2,3]表明MDA、SOD参与了人类多种疾病的发生发展过程,研究者们也试图寻找通过减轻氧化应激反应达到治疗相关疾病的目的。
本研究结果显示,高海拔组MDA含量高于低海拔组及中海拔组,与既往报道[4]一致。另外,本研究还发现暴露于高海拔低压低氧环境中,随着低氧暴露时间的延长,大鼠肺组织中的MDA逐渐升高,可能与长期低氧环境下过多的自由基发生脂质过氧化作用有关,说明海拔越高大鼠肺组织中的细胞受自由基攻击的程度越严重。本研究还发现,随着海拔升高及暴露时间延长,高海拔组大鼠血浆MDA呈逐渐增高趋势,提示随海拔升高及暴露时间的延长,大鼠体内氧化应激反应增强,机体损伤加重。本研究结果显示,高海拔组饲养1 d SOD活力高于低海拔组,但随着高海拔暴露时间的延长高海拔组SOD活力呈逐渐降低趋势,这可能由于大鼠刚进入高海拔环境时由于低氧的急性应激使得肺组织SOD活力反应性增高,从而起到保护组织细胞免受氧化损伤的作用;随着模拟高海拔暴露时间的延长,SOD活力呈逐渐降低趋势,这可能与机体内自由基不断积累增多、清除自由基的系统不断消耗、抗氧化系统能力下降有关。
AngⅡ是一种可以在心血管系统中调控血压的肽类激素,是肾素-血管紧张素-醛固酮系统的一部分,可以引起血管收缩及血压升高。AngⅡ可以促进平滑肌细胞的增殖及迁移功能,其不仅在维持正常血管功能方面发挥重要作用,在很多疾病的病理生理学进程中亦发挥了重要调控作用,如睡眠呼吸暂停低通气综合征、心力衰竭等。有研究[7]发现,低氧可以损伤线粒体膜结构从而导致线粒体功能紊乱,并且可能通过调控AngⅡ的表达调控内皮组织功能。近年,多项研究[8,9]表明,AngⅡ可能参与了呼吸系统疾病发病的病理生理学过程,如参与了肺间质纤维化、急性肺损伤的细胞凋亡、炎症反应过程。研究[10]还表明,间歇性低氧时,Ca2+超载诱导AngⅡ表达升高从而使细胞损伤,并且有研究[11]显示,AngⅡ可能通过参与氧化应激反应、诱导肺上皮细胞凋亡等机制参与肺损伤的发生发展。本研究结果显示,高海拔组饲养3、7、15、30 d,大鼠肺组织中AngⅡ表达高于低海拔组,且随模拟高海拔暴露时间延长大鼠肺组织AngⅡ表达逐渐升高;高海拔组中,大鼠肺组织AngⅡ表达与SOD表达呈负相关,与MDA表达呈正相关,推测低氧可能通过促进AngⅡ表达及氧化应激反应参与了肺组织损伤过程,并且随低氧程度加重,肺组织AngⅡ mRNA表达增加及氧化应激反应增强,从而进一步加重肺组织损伤程度。
总之,高海拔环境下,大鼠氧化应激反应增强,肺组织AngⅡ mRNA表达增加,低氧可能通过促进AngⅡ表达及氧化应激反应参与肺组织损伤过程,但由于本实验动物偏少,观察时间偏短,缺乏长期的观察比较,且大鼠与人类之间存在一定的差异,所得出的结论仅是初步的,不能完全代表不同海拔高度对人体的影响。下一步的研究应该扩大实验动物样本含量,增加实验动物造模类型,研究动物在不同时间段下不同组织器官的变化规律,并招募合适的人群进行相关分析研究。
