干扰牛磺酸上调基因1表达对结直肠癌细胞增殖、凋亡、侵袭迁移的影响及其机制
2019-02-13黄少江阎吕军牛凯李青
黄少江,阎吕军,牛凯,李青
(陆军军医大学第二附属医院,重庆400037)
结直肠癌是消化道常见的肿瘤之一,目前手术切除是治疗结直肠癌最有效的方式,然而只有少数早期结直肠癌患者才能采用根除手术治疗[1],且手术后的肿瘤复发率仍较高,5年生存率很低[2]。研究证实,在结直肠癌的发生发展中存在多种基因和其编码蛋白的改变,越来越多的证据显示长链非编码RNA(LncRNA)的异常表达在结直肠癌的发生、迁移和侵袭中有重要作用[3, 4]。LncRNAs是一种长度大于200个核酸的RNA,能够识别互补序列,在RNA的转录后加工过程中有重要的意义,这些转录后加工的过程包括剪切、编辑、转运、翻译以及降解[5]。研究[6, 7]显示,LncRNA 牛磺酸上调基因1(TUG1)在胃癌、肝癌、乳腺癌、膀胱癌等多种肿瘤中发挥调控作用。也有研究[8, 9]显示,TUG1在结直肠癌中明显高表达并影响结直肠癌上皮间质转化过程,然而其具体作用机制尚未完全明确。本研究首先观察了LncRNA TUG1在结直肠癌细胞中的表达水平,然后探讨了干扰其表达对结直肠癌细胞增殖、凋亡、侵袭、迁移的影响及机制。
1 材料与方法
1.1 细胞、试剂 结直肠癌细胞系SW480、HCT-116、SW620和LoVo细胞和正常结肠上皮细胞系FHC细胞购自中国科学院上海细胞生物研究所。RPMI1640和L-15细胞培养基、Lipofectamine 2000(Invitrogen公司);FBS(Sigma-Aldrich公司);总RNA提取试剂盒(Takara公司);RNA反转录试剂盒、SYBR Green、荧光试剂、引物(Qiagen公司);兔抗细胞转化生长因子-β(TGF-β)、细胞内信号转导蛋白2(Smad2)和α-平滑肌肌动蛋白(α-SMA)(Cell Signaling公司)。
1.2 方法
1.2.1 细胞培养、分组与siRNA-TUG1转染 SW480、SW620和LoVo细胞采用含10%胎牛血清的L-15细胞培养基培养;HCT-116和FHC细胞采用含10%胎牛血清的RPMI 1640细胞培养基培养;放置于37 ℃、5% CO2平衡湿度培养箱中培养,定期观察细胞生长情况并进行换液。将转染siRNA-TUG1的细胞分为siRNA-TUG1组,转染siRNA-NC的细胞分为siRNA-NC组。细胞转染采用Lipofectamine 2000方法。转染前1 d,分细胞至6孔板,每孔细胞数为1×106/孔,每孔中加入不加抗生素的培养基1.5 mL,使转染时的细胞密度为30%~50%。其具体操作按照说明书进行。
1.2.2 结直肠癌细胞中TUG1、TGF-β、Smad2、α-SMA mRNA表达检测 采用qRT-PCR法。按照TRIzol试剂盒步骤提取结直肠癌细胞中总RNA,使用分光光度仪检测RNA浓度。GAPDH为内参。qRT-PCR按照SYBR Green试剂盒说明书进行反应体系的配制,反转录试剂盒合成cDNA。采用比较CT值法对获得的数据进行相对定量分析。TUG1在SW480、HCT-116、SW620、LoVo、正常结肠上皮细胞FHC中的表达分别为1.79±0.05、2.31±0.18、2.99±0.21、3.45±0.08、1.04±0.05,SW480、HCT-116、SW620、LoVo细胞中TUG1表达高于FHC细胞(P均<0.05),SW620和LoVo细胞中TUG1的表达高于其他结直肠癌细胞(P均<0.05),SW620和LoVo细胞作为后续试验的研究对象。
1.2.3 各组细胞增殖观察 采用CCK-8法。取对数生长期的各组细胞,以2×103个/孔接种到96孔培养板中,常规培养。各组细胞分别培养24、48、72 和96 h后,加人10 μL的CCK-8溶液,孵育10 min,用酶标仪测定405 nm波长的吸光度值。
1.2.4 各组细胞迁移、侵袭能力观察 采用Transwell法。在SW620和LoVo细胞转染24 h后,以1×104个/孔接种于24孔板Transwell中,每组设置3个复孔,并在上室加入200 μL RPMI1640培养基,下室加入600 μL RPMI1640培养基,在37 ℃细胞培养箱中培养22 h后取出上室,并吸取下室中培养液,加入结晶紫染色液100 μL/孔,染色10 min,PBS洗涤2遍,100倍显微镜下选取10个视野,计数迁移细胞,取平均值。在侵袭分析中,小室以基质膜包被,后续试验同迁移步骤。100倍显微镜下选取10个视野,计数侵袭细胞,取平均值。
1.2.5 各组细胞周期分析和凋亡观察 采用流式细胞术。取对数生长期细胞,以3×105个/孔接种于6孔板,胰酶消化收集转染24 h后细胞,PBS洗涤后制备成细胞悬液,加入预冷的70% 乙醇,4 ℃固定过夜。加入PBS洗涤2次后弃上清,加入PI工作液,室温下避光孵育30 min后,流式细胞仪检测细胞周期。用预冷的PBS洗涤2次,加入10 μL Annexin V-FITC和5 μL碘化丙啶染色液(0.25 mg/mL),轻轻混匀,室温避光孵育20 min,用流式细胞仪检测凋亡细胞。
1.2.6 各组细胞培养液TGF-β、Smad2、α-SMA蛋白检测 采用Western blotting法。在结直肠癌细胞中提取蛋白并进行蛋白定量,调节每份样品蛋白浓度,在上样缓冲液加入等量蛋白,煮沸,在SDS聚丙烯酰胺凝胶中进行电泳,电转至PVDF膜,封闭液室温封闭3 h,分别加入TGF-β、Smad2、α-SMA和GAPDH一抗4 ℃过夜,HRP标记二抗,室温孵育2 h,ECL发光剂检测转印膜上靶蛋白信号,具体操作按ECL说明书进行,然后于暗室中用膜对X线片曝光,所得X线片上的信号条带用吸光度图像扫描仪扫描采集图片,采用AlphaEase FC软件对图片进行灰度值分析。结果以GAPDH作内参,计算相对表达量。
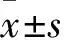
2 结果
2.1 各组SW620和LoVo细胞增殖能力比较 siRNA-TUG1组SW620和LoVo细胞中TUG1的表达水平较siRNA-NC组明显下降(0.57±0.12 vs 1.03±0.17;0.43±0.08 vs 1.00±0.18)(P均<0.05)。siRNA-TUG1组转染24、48、72、96 h,SW620细胞增殖活性分别为0.20±0.01、0.24±0.06、0.46±0.06、0.66±0.07,LoVo细胞增殖活性分别为0.21±0.01、0.27±0.07、0.43±0.06、0.78±0.07。siRNA-NC组转染24、48、72、96 h,SW620细胞增殖活性分别为0.20±0.01、0.35±0.07、0.68±0.13、1.14±0.11,LoVo细胞增殖活性分别为0.20±0.01、0.37±0.08、0.71±0.13、1.16±0.11。转染96 h,siRNA-TUG1组SW620和LoVo细胞的增殖活性较siRNA-NC组低(P均<0.05)。
2.2 各组SW620和LoVo细胞侵袭和迁移能力比较 siRNA- TUG1组SW620和LoVo细胞侵袭细胞数分别为(53±5)、(61±3)个/HP,迁移细胞数分别为(84±10)、(102±8)个/HP;siRNA-NC组SW620和LoVo细胞侵袭细胞数分别为(93±6)、(99±8)个/HP,迁移细胞数分别为(165±11)、(185±15)个/HP。siRNA-TUG1组SW620和LoVo细胞的侵袭、迁移能力较siRNA-NC组下降(P均<0.05)。
2.3 各组SW620和LoVo细胞周期分布和凋亡率 siRNA-TUG1组G0/G1、M、S期SW620细胞比例分别为55.10%±3.64%、8.72%±2.20%、22.53%±1.99%,G0/G1、M、S期LoVo细胞比例分别为57.60%±3.96%、9.15%±1.95%、21.53%±2.25%;siRNA-NC组 G0/G1、M、S期SW620细胞比例分别为39.12%±2.50%、8.90%±2.00%、40.53%±2.70%,G0/G1、M、S期LoVo细胞比例分别为35.30%±2.94%、8.90%±1.80%、37.54%±2.74%。siRNA-TUG1组G0/G1期SW620和LoVo细胞比例高于siRNA-NC组(P均<0.05),S期细胞比例低于siRNA-NC组(P均<0.05)。siRNA-TUG1组SW620细胞、LoVo细胞凋亡率分别为13.64%±1.56%、19.46%±2.41%,siRNA-NC组分别为5.93%±0.55%、7.47%±1.10%,两组各细胞凋亡率比较,P均<0.05。
2.4 各组SW620和LoVo细胞TGF-β、Smad2、α-SMA mRNA及蛋白相对表达量比较 siRNA-TUG1组SW620细胞TGF-β、Smad2、α-SMA mRNA相对表达量分别为0.49±0.05、0.37±0.04、0.25±0.02,蛋白相对表达量分别为0.51±0.05、0.39±0.04、0.29±0.03;LoVo细胞TGF-β、Smad2、α-SMA mRNA相对表达量分别为0.64±0.07、0.47±0.05、0.38±0.04,蛋白相对表达量分别为0.62±0.06、0.51±0.05、0.43±0.04。siRNA-NC组SW620细胞TGF-β、Smad2、α-SMA mRNA相对表达量分别为0.87±0.08、0.78±0.07、0.59±0.05,蛋白相对表达量分别为0.98±0.09、0.87±0.09、0.68±0.07;LoVo细胞TGF-β、Smad2、α-SMA mRNA相对表达量分别为0.88±0.09、0.79±0.08、0.68±0.07,蛋白相对表达量分别为0.96±0.09、0.83±0.08、0.74±0.07。siRNA-TUG1组SW620和LoV细胞TGF-β、Smad2、α-SMA mRNA和蛋白表达低于siRNA-NC组(P均<0.05)。
3 讨论
结直肠癌是我国常见的恶性肿瘤之一,其发病率位居全球恶性肿瘤的第3位,近年随着国人生活水平的提高、饮食习惯的改变、人口的老龄化以及结直肠癌普查的开展,我国结直肠癌的发病率呈明显上升趋势,严重影响人们的健康和生活质量[10]。
LncRNAs是肿瘤研究领域的一个新的成员,研究表明其在肿瘤的发生和肿瘤的抑制通路中发挥着重要作用[11]。在结直肠癌中存在多种LncRNAs的异常表达,包括HOTAIR、PVT1、SNHG1和AB073614等[12~15]。最近有研究显示,在结直肠癌中TUG1存在明显高表达,不仅影响患者预后还对结直肠癌细胞的上皮间质转化具有重要作用[16]。本研究结果显示,TUG1在结直肠癌细胞SW480、HCT-116、SW620和LoVo中的表达水平高于正常结肠上皮细胞FHC,说明结直肠癌细胞TUG1表达升高。进一步采用细胞实验验证TUG1对结直肠癌细胞的影响,采用siRNA-TUG1转染SW620和LoVo细胞,TUG1在细胞中的表达水平明显下降;同时低表达TUG1可以明显抑制SW620和LoVo细胞增殖活性,侵袭和迁移能力。说明低表达TUG1可以抑制结直肠癌的进展。在肿瘤细胞中细胞的凋亡率明显下降,因此促进肿瘤细胞的凋亡是抑制肿瘤进展的重要方式。有研究[17]显示,抑制TUG1表达后,能够促进肿瘤细胞的凋亡。在本研究中低表达TUG1后SW620和LoV细胞G0/G1期细胞比例明显升高,S期细胞比例明显下降,同时细胞凋亡率增加,说明TUG1可以将结直肠癌细胞阻滞在G0/G1期,同时诱导结直肠癌细胞的凋亡。
TGF-β在依赖Smads的信号通路中,能够诱导Smad2、α-SMA、Snail、HMGA2、Twist和ZEB等多种分子的表达[18]。HMGA2作为细胞核蛋白,不仅能够与细胞核内DNA结合,还能调控多种转录因子的表达,其可以上调锌指蛋白Snail和螺旋蛋白Twist的表达,Snail又能促进Slug和Twist的表达,在转录因子间的相互作用及调控下,能够使细胞上皮的程序化表达抑制,促进间质细胞的程序化表达,进而导致上皮间质转化[19]。有研究[20]显示,在慢性阻塞性肺疾病中TUG1能够通过调控TGF-β信号通路影响疾病的进展。另有研究显示,TGF-β信号通路在肿瘤的进展中具有重要作用。本研究中采用RT-PCR和Western blotting检测TGF-β、Smad2、α-SMA mRNA和蛋白的表达量,结果显示SW620和LoVo细胞转染siRNA-TUG1后,TGF-β、Smad2和 α-SMA mRNA和蛋白的表达水平较转染siRNA-NC的细胞明显降低,说明TUG1低表达能够抑制TGF-β信号通路。
综上所述,TUG1在结直肠癌细胞中明显高表达,干扰TUG1表达可能通过抑制TGF-β信号通路激活抑制结直肠细胞增殖、侵袭、迁移,阻滞细胞周期,促进细胞凋亡。TUG1有可能成为结直肠癌治疗的潜在靶点应用于临床,这需要进一步研究探讨。
