假肠膜明串珠菌胞外多糖的分离纯化及其抗氧化特性研究
2019-01-21叶广彬陈源红王长丽曹德民李根亮
叶广彬,陈源红,王长丽,曹德民,李根亮
(右江民族医学院,广西百色533000)
乳酸菌(lactic acid bacteria,LAB)胞外多糖(ex- opolysaccharide,EPS)是LAB在生长代谢过程中分泌的一种结构复杂的糖类化合物,具有抗氧化、抗肿瘤、增稠、絮凝及免疫调节等多种功能特性,广泛应用在食品、医药和化妆品等行业[1-2]。根据单糖组成不同,LAB EPS可分为同源多糖(homopolysaccharides,HoPS) 和异源多糖 (heteropolysaccharides,HePS)[3]。LAB HoPS根据糖单元内的连接方式和单糖成分不同,分为 4 类:(1)α-D-葡聚糖,单糖组成为葡萄糖,由α-1,6 糖苷键连接聚合,同时可能在 α-1,2、α-1,3 或α-1,4 位有分支结构;(2)β-D-葡聚糖,单糖组成为葡萄糖,糖单元以 β-1,2 键或 β-1,3 键连接;(3)β-D-果聚糖,单糖组成为果糖,以β-2,1键连接,可能在β-2,6处有分支结构;(4)其他,例如聚半乳糖,由结构一致的糖单元以不同的糖苷键连接聚合而成[4-5]。
能够产生EPS的LAB很多,大多分离于传统的发酵食品,如奶制品、黄豆酱、马奶酒、酸菜等。主要包括肠膜明串珠菌(Leuconostoc mesenteroides)、植物乳杆菌(Lactobacillus.plantarum)、嗜酸乳杆菌(Lb.acidophilus)、开菲尔乳杆菌(Lb.kefiranofaciens)、鼠李糖乳杆菌(Lb.rhamnosus)、嗜热链球菌(Streptococcus thermophilus)、瑞士乳杆菌(Lb.helveticus)和食窦魏斯氏菌(Weissella cibaria)等[6-11]。随着LAB研究的不断深入,其作为食品级工业生产菌,与其他微生物相比安全性高。然而LAB EPS产量低,菌株稳定性差,是制约其大规模生产的主要因素[12]。此外,由于LAB的种类及来源不同,其产生的EPS的结构和特性均有所差异。为了满足食品、医药等领域的需要,筛选具有产量高、益生作用强的LAB是目前多糖产业发展的主要方向。
本研究从东北酸菜发酵液中分离得到一株高产EPS的菌株,利用生理生化试验、形态学观察及16S rDNA序列分析,鉴定其种属地位。并利用生物化学手段分离纯化EPS,探究其抗氧化性质,为该EPS的分离纯化奠定基础,为益生元特性研究提供参考。
1 材料与方法
1.1 材料
酸菜发酵液:收集自哈尔滨农家自制酸菜。细菌基因组DNA提取试剂盒(M2023)、质粒小量提取试剂盒(M1603)、琼脂糖凝胶DNA回收试剂盒(L9014):TIANGAN股份有限公司。
1.2 培养基
MRS 培养基(100 mL):葡萄糖 2 g、胰蛋白胨 1 g、牛肉膏1 g,酵母提取物0.5 g,K2HPO40.2 g,无水乙酸钠0.5 g,柠檬酸铵 0.2 g,MgSO4·7H2O 0.058 g,MnSO4·H2O 0.025 g吐温-80 0.1 mL,用于供试菌活化及种子液制备;产糖培养基(MRS-S):用蔗糖代替MRS培养基中的葡萄糖。
1.3 仪器设备
SM20利用体视镜:长沙市秋龙仪器设备有限公司;BX43生物显微镜:奥林巴斯(深圳)工业有限公司;UV-2600紫外可见分光光度计:日本岛津公司;vario ELⅢ元素分析仪:德国Elementar公司。
1.4 方法
1.4.1 产EPS LAB的分离
取酸菜发酵液样品,根据稀释倒平板法[2]将稀释液分别涂布于含CaCO3的MRS平板上,30℃倒置培养48 h。挑取单个具有典型溶钙圈菌落接种于30 mL/100 mL MRS-S产糖培养中,30℃,静置培养36 h,测定EPS含量,筛选得到高EPS LAB。
1.4.2 高产EPS LAB的鉴定
观察高产EPS菌株的菌落形态特征和菌体形态特征。根据蔡妙英常见细菌系统鉴定手册[13]分类鉴定及试验方法测定高产胞外多糖菌株的生理生化特性,包括葡萄糖产酸产气试验、过氧化氢酶试验、氧化酶试验、明胶液化试验、脲酶及酯酶试验、精氨酸水解试验、淀粉水解试验以及糖发酵试验。
利用细菌基因组DNA提取试剂盒提取高产胞外多糖菌株基因组DNA,以P1:5'AGA GTT TGA TCM TGG CTC AG 3';P2:5'TAC GGY TAC CTT GTT ACG ACT T 3'为引物[14],按照Du等[2]方法进行16S rDNA部分序列扩增。PCR产物经1.0%琼脂凝胶电泳后,用DNA回收试剂盒回收目的片段并进行测序。
1.4.3 EPS的提取及纯化
根据Du等[15]的方法,取发酵液 300mL,4℃4000×g离心40 min。上清液中加入3倍体积预冷的95%乙醇,沉淀过夜,4℃12 000×g离心40 min收集沉淀,用250 mL超纯水30℃~40℃溶解多糖沉淀,加入250 mL 10%三氯乙酸,充分搅拌4℃静置10 h,4℃12 000×g离心40 min,向上清液中加入3倍体积预冷的95%乙醇,沉淀过夜,4℃12 000×g离心40 min收集多糖沉淀,重溶于超纯水中,装入透析袋(截留分子量14 000 Da)中,4℃透析2 d,每8 h时换一次水。将透析得到的EPS样品,利用Sephadex G-100凝胶过滤层析进一步纯化。上样后,用流速为1 mL/min的去离子水在室温下进行洗脱,每5 min收集一管,用苯酚-硫酸法测定糖含量,合并含有糖的试管,冷冻干燥处理24 h得到EPS纯品。
将上述得到的纯多糖配制成1 mg/mL的多糖溶液,利用紫外可见分光光度计进行波长扫描,扫描范围为190 nm~350 nm,检测多糖样品的纯度。
1.4.4 元素组成分析
利用元素分析仪测定纯多糖样品中碳元素、氢元素、氮元素及硫元素含量。根据样品量、热导检测器信号和标准曲线,计算样品中的元素含量。
1.4.5 总糖、蛋白质、糖醛酸含量的测定
利用苯酚硫酸法测定总糖含量[16];利用Bradford蛋白质染料结合法测定蛋白质含量[17];利用硫酸-咔唑法测定糖醛酸含量[18]。
1.4.6 抗氧化活性测定
1.4.6.1 总还原力测定
取不同浓度的多糖溶液1 mL与2.5 mL铁氰化钾溶液、2.5 mL磷酸盐缓冲液,50℃反应20 min,之后加入 2.5 mL三氯乙酸(trichloroethanoic acid,TCA)溶液,4 000×g离心30 min。取2.5 mL上清液与0.5 mL FeCl3溶液、2.5 mL去离子水混匀,反应10 min后,测定反应体系的OD700nm值。以VC为阳性对照[19]。
1.4.6.2 DPPH·清除能力测定
取不同浓度的多糖溶液2 mL与2 mL DPPH-乙醇溶液混匀,暗反应30 min,测定混合液的吸光值OD517nm。以VC为阳性对照[20]。根据公式1计算样品的DPPH·清除活性:
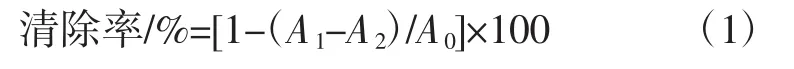
式中:A0为以水为对照的吸光值;A1为与DPPH·反应后的吸光值;A2为样品溶液的吸光值,即以水代替DPPH溶液,排除样品本身吸光度对结果的影响。
1.4.6.3 羟基自由基(·OH)清除能力测定
1 mL不同浓度多糖溶液与1 mL水杨酸-乙醇溶液、1 mL FeSO4溶液混匀,再加入1 mL H2O2溶液,37℃反应40 min后,测定OD510nm值。以VC为阳性对照[21]。根据公式2计算样品的羟基自由基清除能力:
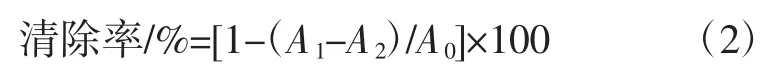
式中:A0为以水为对照的吸光值;A1为与·OH反应后的吸光值;A2为以水代替H2O2溶液的吸光值。
1.4.6.4 超氧阴离子自由基(O2-·)清除能力测定
1 mL不同浓度多糖溶液与3 mL Tris-HCl缓冲液混匀,25℃放置20 min,之后加入0.3 mL邻苯三酚溶液混匀,25℃反应5 min后,加入1 mL浓盐酸,测定OD325nm值。VC为阳性对照[22]。根据公式3计算样品的O2-·清除率:

式中:A0为加入邻苯三酚后的吸光值;A1为终反应吸光值;A2为只加入Tris-HCl缓冲液的吸光值。
1.4.6.5 H2O2清除能力测定
0.6 mL H2O2与1 mL不同浓度多糖溶液、2.4 mL磷酸盐缓冲液混匀,室温反应10 min,测定OD230nm值。以VC为阳性对照[23]。根据公式4计算样品的H2O2清除能力:
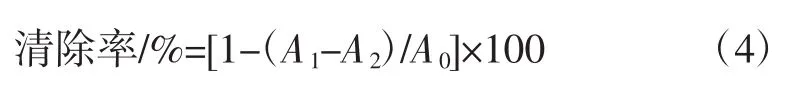
式中:A0为未加样品的吸光值,即以磷酸盐缓冲液代替样品;A1为加入H2O2溶液后的吸光值;A2为样品溶液的吸光值。
1.4.6.6 Fe2+螯合能力测定
1 mL不同浓度多糖样品,与0.05 mL FeCl2溶液混匀。向反应体系中加入0.2 mL菲啰嗪溶液,剧烈振荡,室温反应10 min,加水定容至3 mL。测定体系吸光值OD562nm。选取 EDTA·2Na为对照[24]。按照公式(5)计算样品的Fe2+螯合能力:
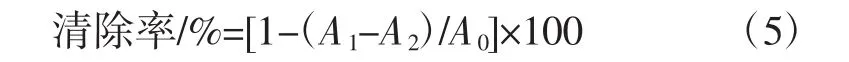
式中:A0为未加样品的吸光值,即以去离子水代替样品;A1为加入样品溶液后,反应体系的吸光值;A2为以水代替菲啰嗪溶液,反应体系的吸光值,排除样品吸光度的影响。
1.4.6.7 亚硝基(NO2-)清除能力测定
取不同浓度多糖样品置于具塞试管中,加入1 mL NaNO2溶液,37℃孵化2 h,加水至5 mL。按标准曲线绘制方法进行测定,根据标准曲线方程计算NaNO2清除量,并根据公式(6)计算NO2-清除能力[25]:
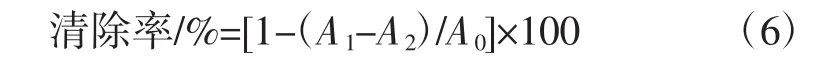
式中:A0为未加样品的吸光度,即以水代替待测样品;A1为加入样品溶液后,反应体系的吸光值;A2为以水代替NaNO2溶液时,反应体系的吸光值,排除样品吸光度的影响。
1.5 数据处理
每个试验处理均设置3个重复,数据以均值±标准差形式表示,统计检验的显著水平设定为0.05。利用JMP(Version 9.0.2,SAS,Inc)软件进行方差分析及多重比较,并用Sigmaplot(Version 10.0,Systat Software,Inc)软件绘图。
2 结果与分析
2.1 高产EPS LAB的分离与鉴定
本研究从酸菜发酵液中共分离得到4株典型LAB,其中 GX-1、GX-2、GX-3 和 GX-4四株菌可以明显产生EPS且菌株GX-3 EPS含量高于其它3株菌,达到(38.42±2.15)g/L。此外,该菌株产生的 EPS含量显著高于W.confuse KR780676 EPS(17.2 g/L)[26]和Leu.citreum SK24.002 EPS(2.4 g/L)[27],具有工业大规模生产EPS的潜力。菌株GX-3在MRS培养基上菌落为白色,表面光滑,凸起,不透明,近圆形,边缘整齐。在MRS-S培养基上菌落较大为乳白色,表面光滑,有光泽,附着黏性液体。该菌株革兰氏染色阳性,菌体呈串珠状,无鞭毛,不运动,不产芽孢。生理生化试验以及部分糖发酵试验结果如表1所示。
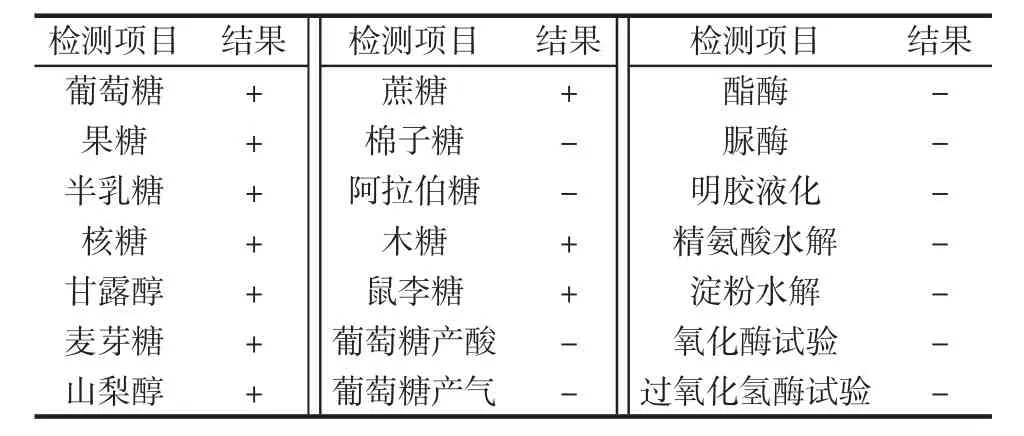
表1 菌株GX-3生理生化试验检测结果Table 1 Differential phenotypic characteristics of strain GX-3
由表1可知,菌株GX-3能以葡萄糖、果糖、半乳糖、核糖、甘露醇、麦芽糖、山梨醇、蔗糖、棉子糖、阿拉伯糖为底物进行发酵,而不能以木糖、鼠李糖为底物进行发酵;且能够利用葡萄糖产酸产气,脲酶及酯酶试验、明胶液化、精氨酸水解试验、淀粉水解、氧化酶试验、过氧化氢酶试验呈阴性。其结果与Leu.pseudomesenteroides生理生化特性基本一致。
16S rDNA序列分析表明,菌株GX-3部分序列长为1321 bp,与该序列相似性较高的相关菌株均为Leuconostoc细菌。菌株GX-3系统发育树如图1所示。

图1 菌株GX-3系统发育树Fig.1 The phylogenetic tree of strain GX-3
由图1可知,该菌株与Leu.pseudomesenteroides DRP-5基因序列的亲缘关系最近,相似性达到99%。结合GX-3生物学特性和生理生化结果分析,将GX-3鉴定为Leu.pseudomesenteroides,并命名为Leu.pseudomesenteroides GX-3。
2.2 EPS的分离纯化
GX-3 EPS经除菌体、除蛋白、乙醇分级沉淀等步骤后,经葡聚糖凝胶Sephadex G-100进一步层析,样品洗脱图呈现单一对称峰,表明XG5 EPS为分子量相对均一组分。波长扫描结果表明,XG5 EPS在19 nm~200 nm之间有最大的特征吸收峰,为碳水化合物的特征吸收。在260 nm和280 nm处无紫外吸收峰,说明无核酸和蛋白质污染,纯度较高。
2.3 GX-3 EPS化学组成分析
GX-3 EPS的C、H、N及S元素含量分别为(43.27±0.24)%、(7.87±0.02)%、(2.01±0.11)%和 (0.31±0.07)%。总糖、蛋白质、糖醛酸含量分别为(90.98±1.21)%、(0.52±0.03)%和(5.26±0.11)%。其中糖醛酸含量高于Flammulina velutipes EPS[28],蛋白质含量高于Lb.helveticus MB2-1 EPS-3(0.29%)[29],低于 Hyriopsis cumingii HCP-3 EPS(9.42%)[19]。
2.4 GX-3 EPS的抗氧化活性
2.4.1 总还原力
具有还原力的化学物质通过提供氢原子来阻断过氧化物的形成,从而破坏自由基反应链,最终发挥抗氧化作用。GX-3 EPS总还原力见图2。

图2 GX-3 EPS总还原力Fig.2 GX-3 EPS on reducing power
如图2所示,GX-3 EPS和VC的总还原力与样品浓度呈正相关,GX-3 EPS的总还原力始终低于VC,但显著高于Pediococcus pentosaceus SR2-2 EPS[23]。
2.4.2 对DPPH·的清除作用
DPPH·是一类较为稳定的合成自由基,能够将其清除的化学物质具有较强的自由基清除能力。GX-3 EPS对DPPH·的清除作用见图3。

图3GX-3 EPS对DPPH·的清除作用Fig.3 The GX-3 EPS on DPPH·clearance ability
如图3所示,GX-3 EPS的DPPH·清除率都随着样品浓度的增加而增大,但始终低于VC的清除能力。GX-3 EPS在5 mg/mL时的清除率最大,为(65.34±3.54)%。张玉龙等研究不同种类ESP对DPPH·的清除能力时发现,当ESP浓度为1.0 mg/mL时,其对DPPH·的清除率为33.53%~41.92%,低于本研究中EPS 对 DPPH·清除率[23]。
2.4.3 对·OH的清除作用
·OH是活性氧中最为危险而且活性最强的自由基,可以通过活体免疫作用产生,自由进入细胞膜,导致氧化应激损伤,尤其是对蛋白质造成破坏[30]。GX-3 EPS对·OH的清除作用见图4。
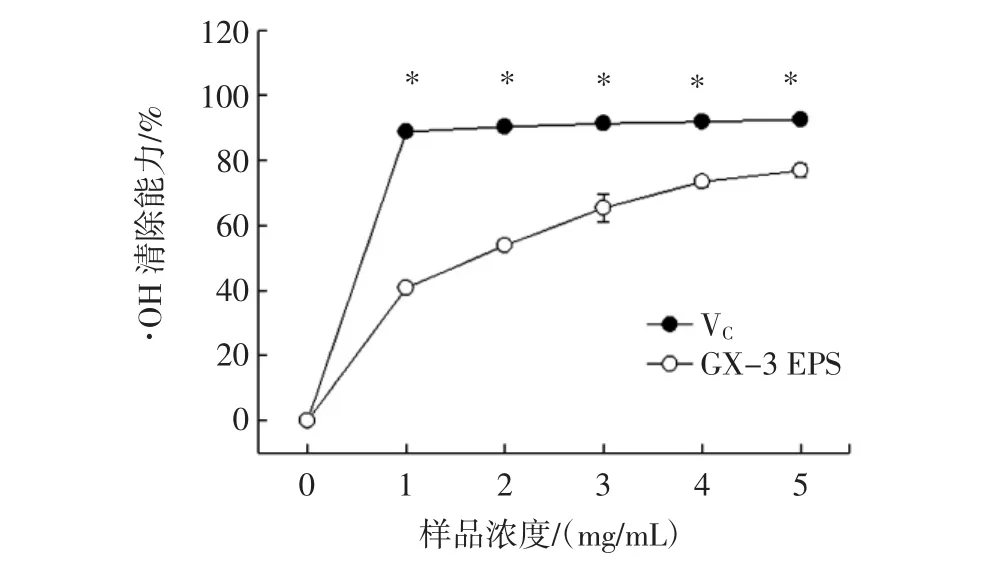
图4GX-3 EPS对·OH的清除作用Fig.4 The GX-3 EPS on·OH clearance ability
如图4所示。随浓度的增加,GX-3EPS和VC的·OH清除率呈现先升高后趋于平缓的趋势。当质量浓度达到5.0 mg/mL时,二者对·OH的清除率分别达到(78.24±3.52)%(EPS)和(95.56±2.14)%(VC)。崔静等[25]发现EPS6对·OH具有明显的清除作用,在质量浓度为2.0 mg/mL时,清除率高达91.5%,高于本研究中GX-3 EPS对·OH的清除率。
2.4.4 超氧阴离子(O2-·)自由基清除能力
O2-·是一种有毒性的活性氧,可以与大量生物活性分子发生反应,造成蛋白质、DNA、脂质等的氧化损伤。Huang等[31]曾报道,O2-·清除能力与分子中存在的能够促进O-H键释放氢离子的亲电子成分有关,如酮基、醛基等。GX-3 EPS对O2-·的清除作用见图5。
如图5所示。,随着GX-3 EPS和VC浓度的增大,清除率呈现先急速升高后保持平稳的趋势,当浓度大于1 mg/mL时,清除率提高幅度明显减小,在浓度为5 mg/mL时,GX-3 EPS和VC对 O2-·的清除率达到最大,分别为(95.44±4.21)%和(77.48±2.45)%。戚跃明等[32]等研究EPS对O2-·清除能力发现,在浓度为10 mg/mL时,O2-·清除率达到47.4%,显著低于本研究中的EPS清除效率(P<0.05)。由此可以看出,GX-3 EPS对O2-·具有一定的清除活性,其作为添加剂可以降低机体的损伤程度。
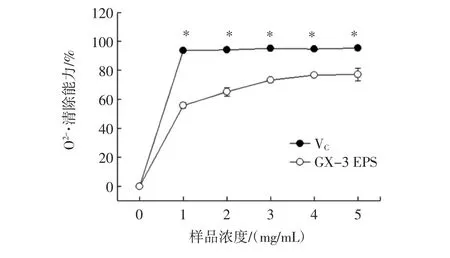
图5 GX-3 EPS对O2-·的清除作用Fig.5 The GX-3 EPS on O2-·clearance ability
2.4.5 H2O2清除能力
H2O2是细胞衰老的诱导因子之一,能够通过细胞膜,与细胞中的Fe2+或是O2-·作用生成·OH,缓慢地氧化机体,对机体造成氧化损伤[33]。GX-3 EPS对H2O2的清除作用见图6。
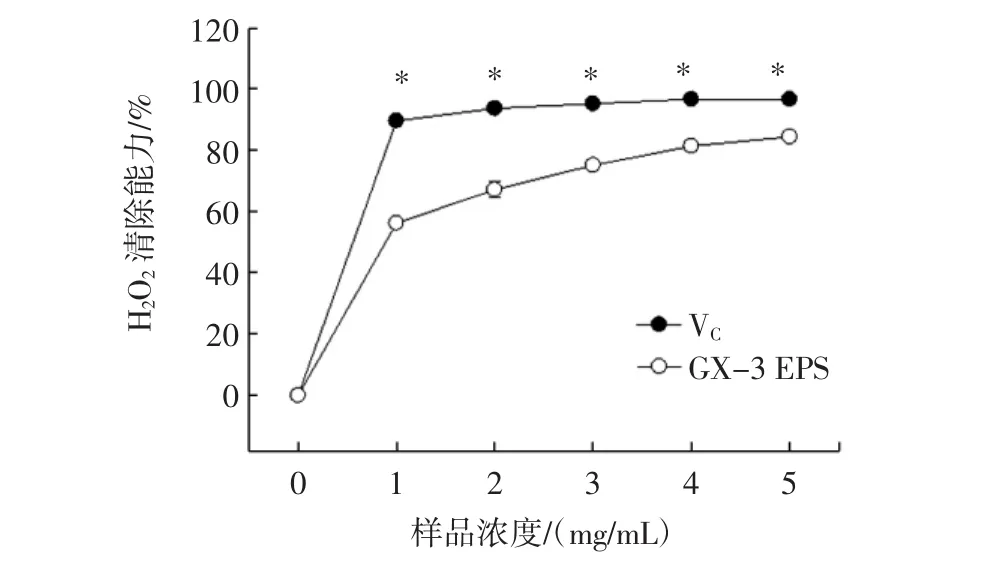
图6 GX-3 EPS对H2O2的清除作用Fig.6 The GX-3 EPS on H2O2clearance ability
如图6所示,GX-3 EPS的H2O2清除能力随着样品浓度的增加而增大,当样品浓度为5 mg/mL时,清除率为(82.78±3.76)%,显著高于紫枝GSP2 EPS的H2O2清除能力(48.12%)[32]。
2.4.6 Fe2+螯合能力
铜、铁等金属离子参与机体内许多氧化反应,导致机体氧化损伤[19]。GX-3 EPS对Fe2+的螯合能力见图7。
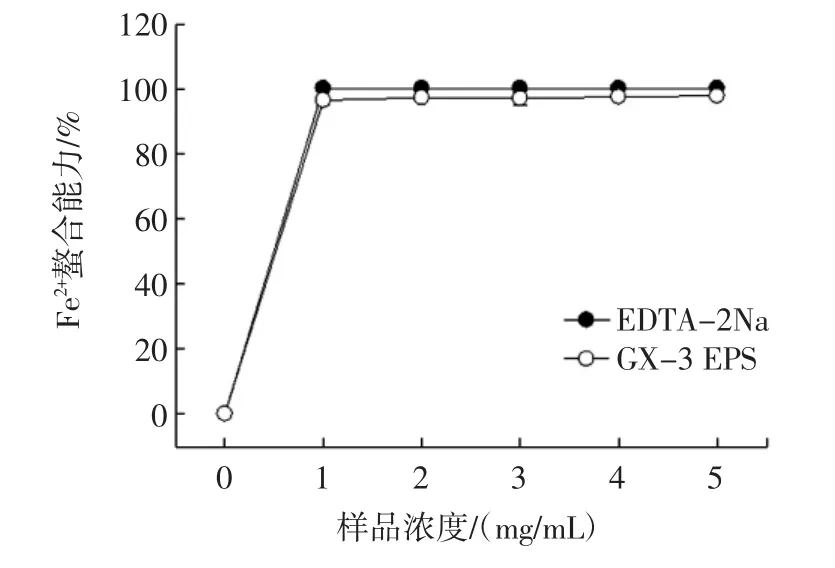
图7 GX-3 EPS对Fe2+的螯合能力Fig.7 The GX-3 EPS on Fe2+chelating ability
由图7可知,随着样品浓度的升高,Fe2+螯合能力呈现先快速上升后保持平稳的趋势,且GX-3 EPS的Fe2+螯合能力低于EDTA-2Na的Fe2+螯合能力差异不显著(P<0.05)。GX-3 EPS在浓度为 1 mg/mL 的 Fe2+螯合能力达到(92.37±2.34)%,显著高于Lb.graminis SR12-1 EPS[23]和 Enterococcus faecium BDU7 EPS[34]。Ker等曾发现EPS的金属螯合能力与其分子质量有关,且多糖分子的结构、组成及羟基的数量和位置也影响了螯合能力,具有螯合能力的多糖必须含有-OH、C=O、-S-、-O-、-COOH、-O-等官能团。因此可以看出,GX-3 EPS可能具有高分子质量及高分枝度的结构[35]。
2.4.7 NO2-清除能力
亚硝酸盐是一种剧毒物质,也是一种致癌物,在胃部酸性条件下可转变成的亚硝酸。亚硝酸可与胺类物质反应,生成具有强致癌作用的亚硝基胺类化合物,诱发人消化道癌等疾病[36]。GX-3 EPS对NO2-的清除作用见图8。

图8 GX-3 EPS对NO2-的清除作用Fig.8 The GX-3 EPS on NO2-clearance ability
由图8可知,GX-3 EPS具有较高的亚硝酸盐清除能力,在质量浓度为5 mg/mL时,清除率为(38.34±3.28)%,显著高于Pediococcus sp.SR2-1 EPS[(9.35±0.63)%)][23],但与 VC相比,GX-3 EPS 的 NO2-清除能力较低。
3 结论
本研究筛选得到一株高产EPS的LAB,经生理生化试验、形态学鉴定和分子生物学试验鉴定该菌株为Leu.pseudomesenteroides,并命名为 Leu.pseudomesenteroides GX-3。以该菌株为供试菌株,进行EPS分离纯化,得到高纯度 EPS,其产量为(38.42±2.15)g/L。此外,GX-3 EPS 具有较高的还原力,对 DPPH·、·OH、O2-·、H2O2、和NO2-均具有良好的抗氧化活性,清除效率随着浓度的增加而增强,最高分别为(65.34±3.54)%、(78.24±3.52)%、(77.48±2.45)%、(82.78±3.76)%和(38.34±3.28)%。因此,Leu.pseudomesenteroides GX-3发酵得到的EPS作为天然抗氧化剂具有良好的应用和开发前景。
