植物乳杆菌KF5胞外多糖合成条件的优化研究
2019-01-21梁增澜李慧张睿白小佳王艳萍李超
梁增澜,李慧,张睿,白小佳,王艳萍,李超,*
(1.天津科技大学新农村发展研究院,天津300457;2.天津科技大学食品工程与生物技术学院,天津300457)
乳酸菌(lactic acid bacterium,LAB)是一类能发酵 碳水化合物而产生大量乳酸的无芽孢、革兰氏阳性细菌的总称,广泛存在于动、植物体及发酵食品中。由于LAB被普遍认为是安全的(Generally Recognized as Safe,GRAS),在发酵过程中能够赋予食品以特殊的风味、口感以及功能性营养成分(如有机酸、胞外多糖等),因而由LAB发酵的食品普遍受到消费者的欢迎和喜爱[1]。其中,部分LAB能够在生长代谢过程中分泌黏液或荚膜多糖,被称为LAB胞外多糖(exopolysac-charides,EPS)[2]。LAB EPS 不仅能够赋予发酵乳制品良好的风味和口感,还能够有效改善产品的性能,如增强持水力、降低乳清析出率、增加黏度等[3]。此外,国内外相关研究表明LAB EPS具有多种生理活性,如抗氧化、抗肿瘤、调节肠道菌群、降低血清胆固醇、免疫调节等多种生物学功能[4],是新型食品级多糖的一种良好来源,可被广泛运用于食品工业化生产、化妆品和微生物制药等领域中。
自上世纪40年代成功开发出由肠膜明串珠菌(Leuconostoc mesenteioides)发酵生成的右旋糖酐作为代血浆的主要成分以来,微生物胞外多糖引起了国内外学者的广泛关注[5]。然而,LAB EPS的产量普遍偏低,这不仅与菌株特异性有关,还受诸多因素的影响,如培养基组分、培养条件等,因而限制了其工业化生产[6]。研究选取从我国西藏传统乳制品发酵剂——藏灵菇(Kefir粒)中分离得到的一株植物乳杆菌KF5(Lactobacillus plantarum KF5),对其进行EPS合成条件的优化,并对影响因素进行了分析。本研究旨在开发具有合成EPS特性的自主知识产权LAB菌株,为工业化生产EPS提供一定的理论基础和技术支持。
1 材料与方法
1.1 材料与试剂
乳清粉:内蒙古伊利集团股份有限公司;乳糖(AR):上海试剂二厂;胰蛋白胨(AR):北京奥博星生物技术责任有限公司;L-半胱氨酸盐酸盐、CH3COONa·3H2O、Tween-80等生化试剂:天津市化学试剂三厂。
植物乳杆菌 KF5(Lactobacillus plantarum KF5):分离自我国西藏传统乳制品发酵剂—藏灵菇(Kefir粒),保藏于保藏于发酵食品与微生物资源开发研究室。
1.2 仪器与设备
DY-2型厌氧培养箱:浙江义乌冷冻机总厂;JA2003型光电分析天平:上海精科天平厂;高压干燥灭菌锅:日本YAMATO公司;YXQGO2型蒸汽灭菌锅:山东新华医疗器械股份有限公司;紫外可见分光光度计UV-9100:北京瑞利分析仪器公司;Avanti J-E型柜式冷冻离心机:美国BECKMAN。
1.3 培养基
乳清培养基:乳清100 mL(取40 g乳清粉溶解于1 L蒸馏水中,调节pH值至5.5,沸水浴30 min,冷却,4℃ 8000 g离心 15 min,调节 pH值至6.4,沸水浴30 min,冷却,4℃ 8 000 g离心 15 min,取上清液,即为乳清液),乳糖1.0 g,胰蛋白胨0.5 g,L-半胱氨酸盐酸盐0.05 g,CH3COONa·3H2O 5.0 g,Tween-80 0.1 mL,矿物质溶液 1.0 mL(0.4 g/L MgSO4·7H2O,0.15 g/L MnSO4·4H2O,0.18 g/L FeSO4·7H2O,0.1 g/L NaCl),pH 6.2,115 ℃灭菌20 min。
1.4 方法
1.4.1 菌种活化
将保藏于-80℃甘油管中的L.plantarum KF5,于乳清液体培养基中连续活化两代,直至菌株活力恢复。
1.4.2 生长曲线的测定
将活化后的L.plantarum KF5以2%的比例接种于400 mL乳清培养基中,30℃静置厌氧培养(80%N2,10%H2,10%CO2)。以 2 h 为等时间段,将发酵液摇匀,取菌液于650 nm处测定吸光度。以时间为横坐标,OD650为纵坐标,绘制生长曲线。
1.4.3 培养过程中EPS合成量及pH值的测定
将活化后的L.plantarum KF5以2%的比例接种于400 mL乳清培养基中,30℃静置厌氧培养,以4 h为等时间段,将发酵液摇匀,取一定体积的发酵液测定pH值。然后将发酵液100℃水浴30 min,4℃、10 000 g离心15 min除去菌体,取一定体积的上清液装入透析袋,4℃蒸馏水透析(截流量6000 Da~8 000 Da),直至蒸馏水中无单糖检出。以苯酚-硫酸法[7]测定透析袋内EPS含量,确定培养过程中EPS合成量及pH值随培养时间的变化情况,并确定培养时间。
1.4.4 培养方式对EPS合成的影响
在确定了培养时间对EPS合成影响的条件下,将活化后的L.plantarum KF5以2%的比例接种于100 mL乳清培养基中,分别进行30℃和37℃静置厌氧培养,37℃静置有氧培养,确定不同培养条件对EPS合成的影响。发酵液处理同1.4.3。
1.4.5 接种量对EPS合成的影响
在确定培养时间、培养方式对EPS合成影响的基础之上,分别将L.plantarum KF5种子液以2%、3%、4%、5%的比例接种于100 mL乳清培养基中发酵培养,确定接种量对EPS合成的影响。发酵液处理同1.4.3。
1.4.6 培养基初始pH值对EPS合成的影响
在确定培养时间、培养条件、接种量对EPS合成影响的基础之上,将乳清培养基的初始pH值调整为5.5、6.0、6.5、7.0。将活化后的 L.plantarum KF5 以一定的比例接种于100 mL不同初始pH值的乳清培养基中进行发酵培养,确定培养基初始pH值对EPS合成的影响。发酵液处理同发酵液处理同1.4.3。
1.4.7 优化试验条件的正交试验
在单因素试验的基础之上为进一步优化试验,分别选取培养时间、培养基初始pH值、接种量为因素,以EPS产量为指标进行L9(34)的正交试验。利用SAS软件对正交试验结果进行数据分析,得出对EPS产量影响的显著因素,从而获得优化EPS产量的最佳条件,试验因素水平如表1所示。
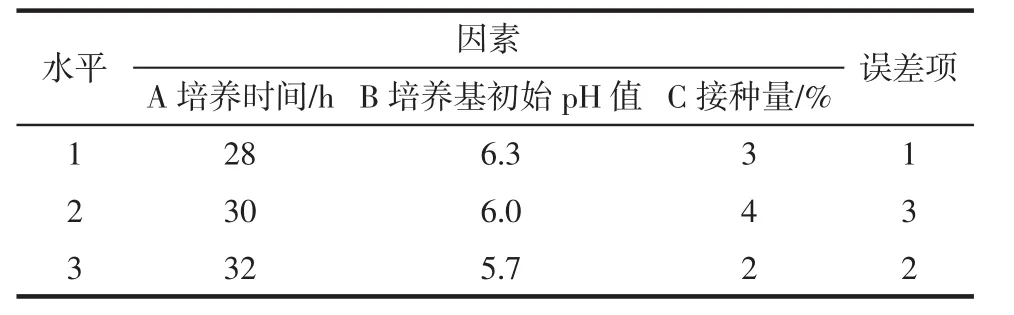
表1 培养时间、培养基初始pH值以及接种量对EPS合成的影响因素水平表Table 1 Factor levels of incubation time,original pH of medium and seed volume
2 结果与分析
2.1 L.plantarum KF5生长曲线的测定
微生物的代谢过程因种而异,不仅受培养基成分及培养条件的影响,也与种龄、接种量有直接关系[8-9]。L.plantarum KF5以2%的接种量接种于乳清培养基后,其生长曲线如图1所示。
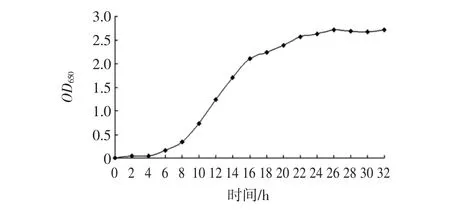
图1 菌株KF5生长曲线Fig.1 The growth curve of strain L.plantarum KF5
由图1可知,L.plantarum KF5在0~6 h期间处于延迟期,菌体细胞数目及菌液浑浊度在这期间变化不大,其生理状态经过适应后逐渐恢复,并开始生长。从第6小时到第24小时为对数生长期,菌体细胞在此期间代谢活跃,菌体数目呈几何级数递增,并且细菌数目和原生质总量的增加,这与菌液混浊度增加呈正相关。24 h后则进入稳定生长期,新繁殖细胞数目与死亡的细胞数目在此期间基本处于动态平衡的状态。
2.2 培养时间对EPS合成的影响
LAB EPS的合成量一般在菌株到达稳定期时最高,稳定末期合成量不再增加,衰亡期时EPS合成量则有所下降[10-12]。因此,通过控制培养时间可以在降低成本的同时提高EPS合成量。培养时间对L.plantarum KF5 EPS合成量及发酵液pH值的影响,结果如图2所示。
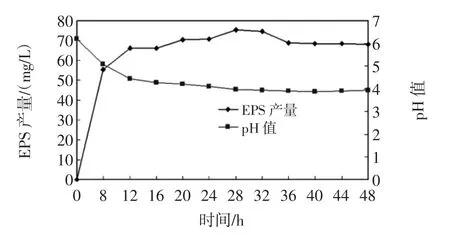
图2 EPS产量及培养基pH值随时间的变化Fig.2 Effect of incubation time on EPS production and pH
如图2所示,培养基的初始pH值为6.2,随菌株不断生长,其代谢产物—乳酸也不断积累,导致发酵液pH值的不断下降。在培养时间达到24 h即菌体进入稳定期后,细胞数目基本维持动态平衡,因而发酵液的pH值基本保持稳定,达到3.9。菌体处于稳定期后,EPS开始逐渐积累,EPS合成峰期出现在菌体稳定期之后即22 h之后,这与相关文献报道一致[13-14]。28 h时EPS产量达到最大(75.57 mg/L),但与32 h相差不大(74.64 mg/L)。在发酵后期(32 h后)EPS合成量逐渐下降,这是由于发酵液pH值的降低,菌株进入衰亡期。同时,培养基中的碳源不足以满足菌株的生长代谢,并且可能在菌株生长代谢过程中存在的糖基水解酶活力增高,导致EPS被降解[15]。LAB EPS在培养过程中的高降解率已成为其运用于工业发酵生产的重要瓶颈,因而可以通过优化培养和提取条件或者采用流加培养的方式改善EPS产量过低的难题[16]。
2.3 培养方式对EPS合成的影响
在发酵过程中,EPS作为乳酸菌的次级代谢产物,伴随其生长代谢而产生。因此,发酵过程中外界环境会影响乳酸菌的生长情况,进而影响EPS的积累[17-18]。在30℃静置厌氧,37℃静置厌氧和37℃静置有氧的培养方式对EPS合成量的影响,结果如图3所示。
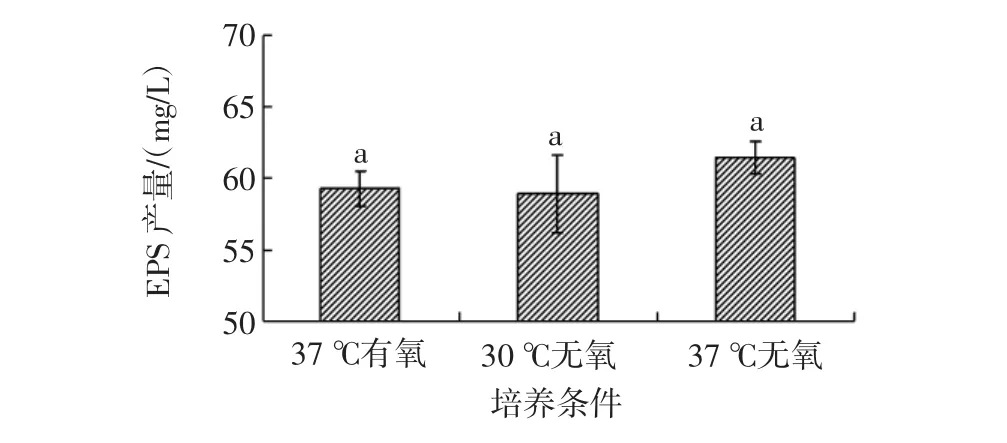
图3 不同培养方式对EPS合成的影响Fig.3 Effect of fermentation conditions on EPS production secreted by L.plantarum KF5
如图3显示,3种培养方式对EPS合成的影响无明显差异(p>0.05)。在37℃厌氧条件下,EPS的合成量达到最大。这可能由于在此培养方式下,菌体生长以及细胞壁大分子的合成都减少,从而使EPS输出所必需的脂类异戊二烯载体数量增加,可用于EPS的合成[19-20]。然而,从考虑成本的角度出发,37℃有氧培养的方式更适于工业化的应用。因此,后续试验均采用37℃有氧培养。
2.4 接种量对EPS合成的影响
适当的接种量不但能够节省发酵时间和成本,有效提高发酵液中最初的活菌数,而且有助于缩短菌体生长的延滞期,提高EPS的合成量[21]。不同接种量(2%~5%)对L.plantarum KF5的EPS合成量影响,结果如图4所示。
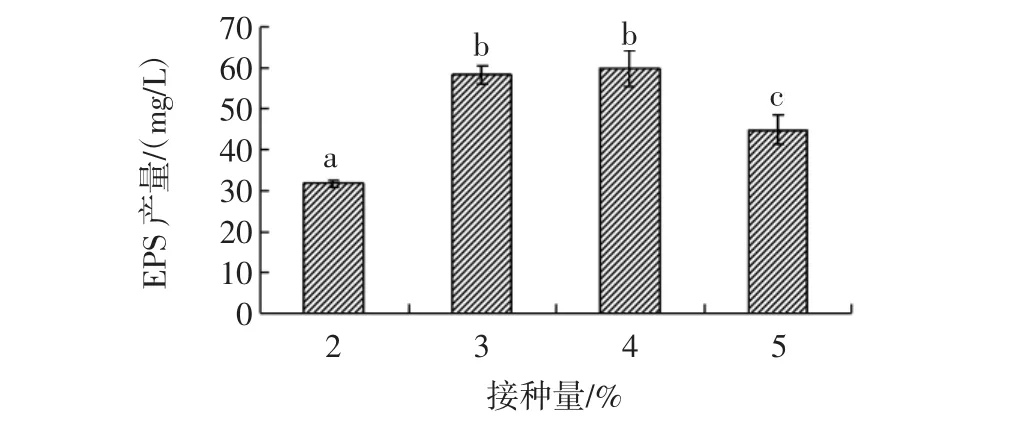
图4 不同接种量对EPS合成的影响Fig.4 Effect of inoculated amount on EPS production secreted by L.plantarum KF5
如图4所示,L.plantarum KF5在37℃静置有氧条件下,EPS的合成量随接种量的升高而增大,采用4%接种量时所合成EPS的量达到最大,为58.79 mg/L。继续增大接种量至5%时,L.plantarum KF5所合成的EPS量反而降低。这可能由于接种量过高,营养物质主要用于菌体生长,而EPS的积累受到限制,导致EPS合成量下降[22]。因此,从工业化生产成本考虑,后续试验采用4%接种量。
2.5 培养基初始pH值对EPS合成的影响
pH值是影响EPS合成量的关键因素之一,菌体在生长过程中多糖合成的pH值取决于糖基水解酶的最适pH值。菌体合成多糖的最适pH值在5.0~7.0之间[23]。培养基pH值对细菌产胞外多糖的影响归因于异戊二烯脂的运载活性,pH值的降低将使多糖的合成因失去脂中间体而受阻[17],且菌体生长过程中会产生乳酸及酶类,随着这些物质的积累,不仅会造成的培养基pH值降低而不利于菌体生长,而且分泌的酶类对胞外多糖有降解的作用。此外,pH值过高会抑制乳酸菌生长,也不利于胞外多糖累积[24]。因此,可以通过控制培养基pH值以达到提高EPS合成量的目的。培养基初始pH值对L.plantarum KF5合成EPS的影响如图5所示。
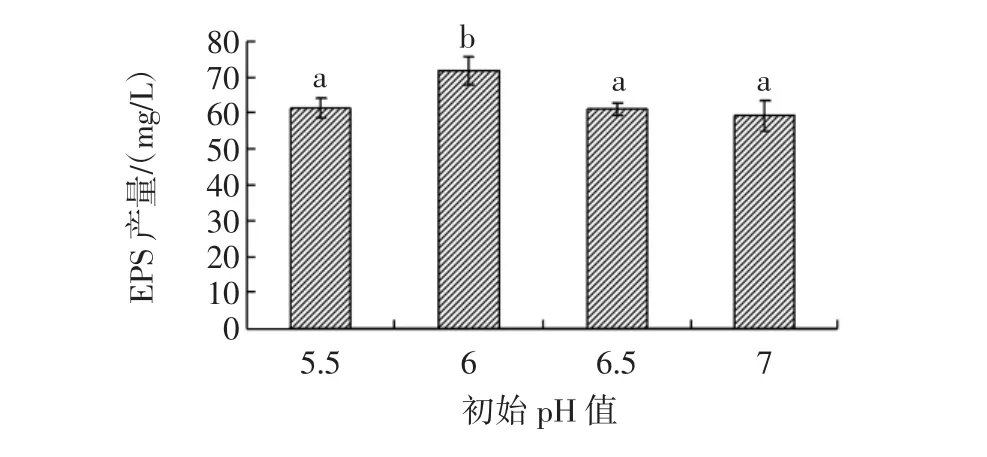
图5 培养基不同初始pH值对EPS合成的影响Fig.5 Effect of different initial pH on EPS production secreted by L.plantarum KF5
如图5所示,pH值为6.0时EPS的产量达到最大,为71.79 mg/L。这可能是由于其他初始pH值不适宜菌体合成EPS,并且使EPS的合成因子脂中间体减少[17],造成EPS的合成量降低。
2.6 L.plantarum KF5合成EPS的正交条件优化
2.6.1 正交试验结果
为确定L.plantarum KF5合成EPS的最适培养条件,在单因素试验的基础上,进一步通过正交试验优化培养条件。分别选取培养时间为因素A,培养基初始pH值为因素B,接种量为因素C,误差项为因素D;每个因素各取3个水平,以EPS产量为评价指标,进行L9(34)的正交试验,结果如表2所示。
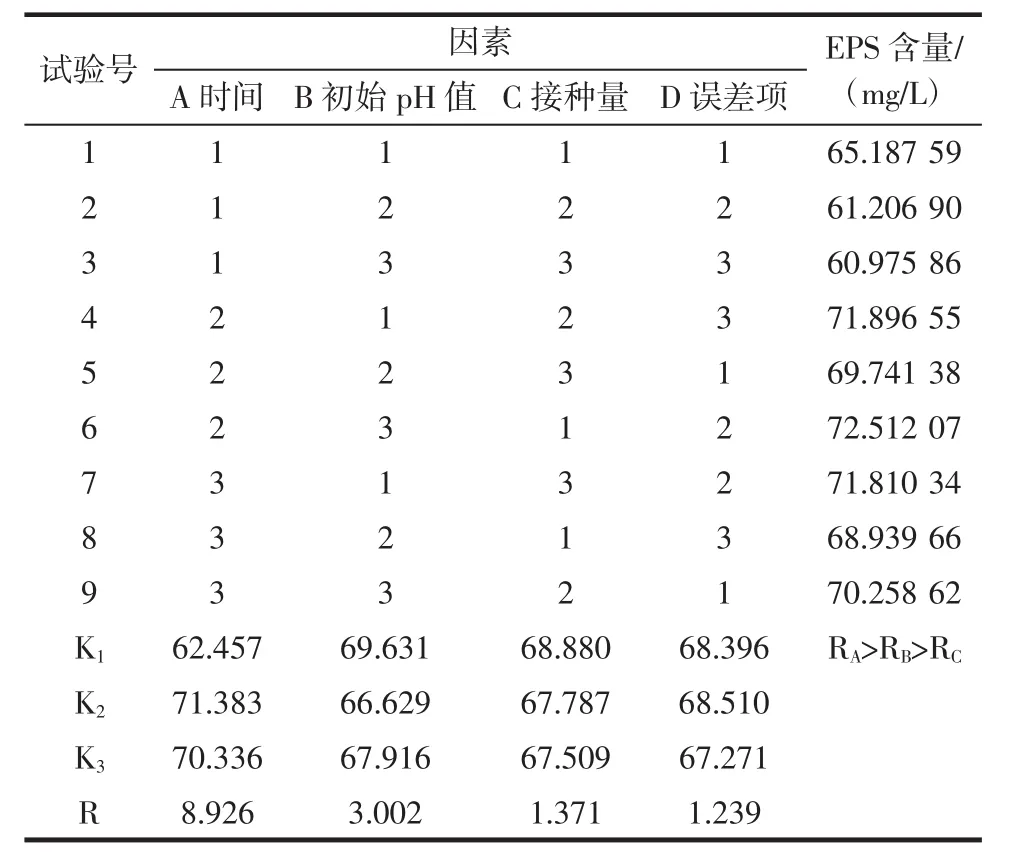
表2 正交试验表及结果Table 2 Table of orthogonal experimental designs and results
2.6.2 方差结果分析
方差分析见表3。
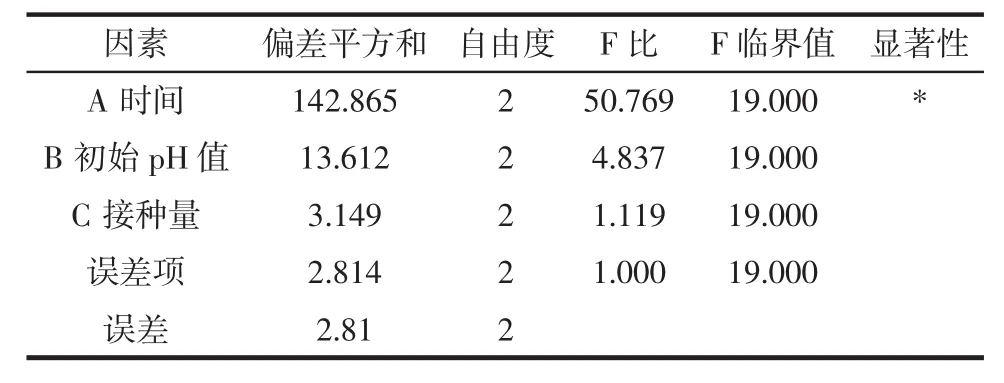
表3 方差分析表Table 3 Table of variance analysis
由正交试验结果可知:最优组合为A2B1C1,即培养时间 30 h,初始 pH 6.3,接种量 3%。RA>RB>RC,说明影响EPS产量的因素顺序为:培养时间>培养基初始pH值>接种量,并且初始pH值和接种量对EPS的合成影响不显著(p>0.05),培养时间影响显著(p<0.05)。在最优组合A2B1C1的条件下,进行验证试验,其EPS合成量达到95.58 mg/L,比正交优化前提高了26.48%。
3 结论
探讨不同培养条件,包括培养方式、培养时间、培养基初始pH值及接种量对L.plantarum KF5合成EPS的影响,并在单因素试验的基础之上对培养时间、培养基初始pH值及接种量进行了L9(34)正交试验。试验结果表明在37℃有氧培养情况下,最佳培养条件为:培养时间30 h,初始pH 6.3,接种量3%。初始pH值和接种量对EPS的合成影响不显著,培养时间影响显著(p<0.05)。在此条件下,L.plantarum KF5的EPS合成量达到95.58 mg/L,比正交优化前提高26.48%。
