何首乌肝毒性的物质基础、毒性机制与防控策略*
2019-01-18李亚梅夏伯候林丽美廖端芳
林 艳,李亚梅,吴 萍,夏伯候,林丽美,廖端芳
(湖南中医药大学药学院湘产大宗药材品质评价湖南省重点实验室,湖南 长沙 410208)
何首乌为蓼科植物何首乌Polygonum multiflorumThunb.的干燥块根,生首乌能解毒消痈,润肠通便,截疟;制首乌能补肝肾,益精血,乌须发,化浊降脂[1]。何首乌已在中医药防治、食品保健、洗护用品等方面广泛应用,在我国的年消费量达到6000吨。随着何首乌的广泛使用,何首乌致肝损伤的报道日益增多。本文将就何首乌肝毒性的物质基础、毒性机制及调控策略进行综述,为何首乌的生产开发和临床安全利用提供依据。
1 何首乌肝毒性
近年来,何首乌引起的肝损伤的发生率越来越高,其肝毒性引起了广泛的关注。有研究统计了450例服用何首乌原药材、炮制品或制剂等致肝毒性的患者,肝功能损害症状出现时间为1-240 d,住院治疗的平均时间为6-120d。其中221 例肝损伤类型清楚,肝细胞型132 例(132/221,59.7%),胆汁淤积型34 例(34/221,15.4%),混合型55 例(55/221,24.9%)。主要临床症状包括黄疸、疲劳、厌食、黄褐色尿、等,其中2 例接受肝移植,7 例死亡,441 例停药保守治疗恢复或肝功能改善[2]。杨倩等[3]研究剂量与不良反应的关系,发现何首乌在常规剂量和超剂量都可能导致肝毒性。何首乌引起的肝毒性具有发病时间不一、肝损伤类型多样、毒性剂量不一等特点。
2 何首乌肝毒性物质基础
何首乌肝毒性的化学成分一直存在争议,主要有“蒽醌致毒说”、“鞣质致毒说”、“二苯乙烯苷致毒说”和“外源性污染物致毒说”[4-7]。
2.1 蒽醌类
“蒽醌致毒说”认为蒽醌类成分是导致其肝毒性的“元凶”,蒽醌类中的大黄素低剂量对肝细胞有促进生长的作用,但高剂量抑制肝细胞生长;大黄酚能诱导肝细胞凋亡,高浓度的大黄酸能够损伤肝细胞[8-9]。汪祺等[10]发现大黄素能抑制人UDP 葡糖醛酸基转移酶1 家族多肽A1(UGT1A1)酶的活性,提示大黄素可能为何首乌潜在的肝毒性成分。汪美汐等[11]用肝细胞L02 考察不同浓度大黄素的细胞毒性,发现大黄素的剂量越大,其肝细胞损伤程度越大,其剂量和毒性成一定的线性关系。Bounda 等[12]研究发现大黄酸使人正常肝细胞HL-7702 凋亡,且大黄酸的剂量和毒性呈现一定的线性关系。
2.2 鞣质
“鞣质致毒学说”认为鞣质是何首乌的肝毒性化学成分。大剂量的鞣质和二苯乙烯苷配伍可致肝损伤,主要表现为大鼠血清中谷氨酸氨基转移酶和γ谷氨酰转移酶水平升高[13]。吴宇等[14]在体外实验中发现何首乌中没食子酸可能是何首乌肝损伤的化学成分。Lin 等[15]发现何首乌的肝毒性主要与没食子酰基和大黄素-O-己糖硫酸盐有关。
2.3 二苯乙烯苷
“二苯乙烯苷致毒说”认为二苯乙烯苷是何首乌肝毒性的化学成分。胡锡琴等[16]发现何首乌中二苯乙烯苷大剂量长期给药,大鼠血清中的谷丙转氨酶和谷草转氨酶含量升高,说明大剂量的二苯乙烯苷会对大鼠肝脏造成损伤。采用UPLC/TOF-MS 技术分析生/制首乌中化学成分变化,并通过高内涵筛选技术分析生/制首乌的肝毒性,其结果表明二苯乙烯苷含量减少可能是肝毒性减少的因素之一[17]。基于液滴重叠法构建类器官3D 培养模型,发现顺式二苯乙烯苷的肝毒性大于反式二苯乙烯苷的肝毒性[18]。何首乌顺式二苯乙烯苷可能通过抑制PPAR-gamm 而致特异质肝毒性[19],顺式和反式二苯乙烯苷能免疫协同产生特异质肝毒性[20]。Xu等[21]发现何首乌中二苯乙烯苷通过诱导细胞色素P450酶系的表达,从而使乙酰氨基酚肝细胞损伤加剧。
作者课题组基于粗糙集理论构建“谱毒”关系研究了何首乌特异质肝毒性物质基础,结果显示二苯乙烯苷是何首乌中毒性最大的化学成分[22]。体外特异质肝毒性实验结果也表明二苯乙烯苷是何首乌特异质肝毒性的主要物质基础。对何首乌醇提物的不同极性部位特异质肝毒性考察,发现何首乌50%乙醇洗脱部位的肝毒性最强,而50%乙醇洗脱部位含量最多的为二苯乙烯苷。在对二苯乙烯苷肝毒性的确认,其结果也表明二苯乙烯苷在免疫应激条件下可诱导肝毒性[23](图1,具体实验步骤参照文献22-23)。
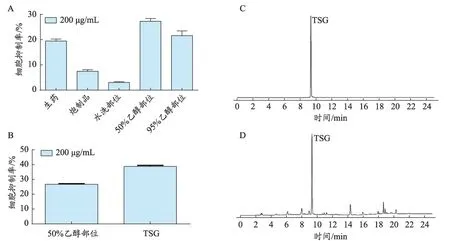
图1 何首乌中二苯乙烯苷(TSG)的特异质肝毒性
2.4 外源性污染物
李春等[24]通过测定何首乌中多种真菌毒素的含量,其中一批黄曲霉毒素超标,霉变何首乌中检查出多种真菌毒素,推测何首乌霉变产生的真菌毒素是其导致肝损伤的重要原因之一。少量何首乌在炮制过程中采用了硫熏,残留的硫可能是导致何首乌肝毒性的原因之一。
3 何首乌肝毒性机制
2014年6月美国胃肠病学会将药源性肝损伤分为固有型药源性肝毒性和特异质型药源性肝毒性,前者主要是由药物自身或其代谢产物的直接作用导致,后者主要受机体因素影响,是药物和特定机体状态综合作用的结果[25]。目前特异质型药源性肝损伤主要是与机体的免疫炎症状态相关,分为天然免疫介导的和获得性免疫介导的特异质药源性肝损伤[26]。
通过圆的引入,帮助学生创设了探究情境,学生在教师的引导之下,进行独立思考和合作探究,从而对椭圆的相关基础概念有了一定的认识.激发学生兴趣的同时提升了学生自主探究的信心.
3.1 何首乌固有型药源性肝毒性
3.1.1 影响胆汁代谢功能
何首乌致肝损伤的病例部分有黄疸和胆汁淤积的临床表现,表明何首乌肝损伤可能与机体的胆汁代谢有关。王涛等[27]研究了何首乌水提物肝损伤作用,结果表明何首乌水提物可影响大鼠肝脏胆汁酸的合成、代谢、转运和排泄的相关蛋白的表达,从而引起肝损伤。Wei 等[28]研究何首乌提取物对小鼠肝损伤的作用,其结果表明何首乌提取物能加快小鼠体内胆汁酸的肝肠循环,引起胆汁酸代谢的变化,其肝损伤作用机制可能与肠内Fxr-Fgf15 信号的激活,肝脏中的Cyp7a1酶表达的抑制有关。
3.1.2 损伤肝细胞线粒体
在正常情况下,细胞色素P450酶参与外源性药物代谢产生的亲电子基、自由基等活性代谢产物可与谷胱甘肽S 转移酶结合排出体外,不会产生毒性。但在外源性毒性成分过量蓄积时,产生过量的亲电子基、自由基等活性代谢产物会使肝内谷胱甘肽(GSH)耗竭,肝线粒体损伤从而导致肝损伤。欧莉等[29]研究何首乌灌服肾阳虚模型下大鼠的含药血清对肝细胞L02的肝毒性,结果显示何首乌可致药源性肝损伤,其机制可能与肝细胞内谷胱甘肽(GSH)含量下降所致线粒体损伤有关。白杨等[30]通过何首乌致大鼠肝损伤的机制研究,发现制首乌可对肾阳虚模型下的大鼠产生肝损伤,其机制可能与炎症因子增加,肝线粒体中Na+-K+-ATP 酶、Ca2+-Mg2+-ATP 酶的水平下降所致线粒体功能障碍有关。
3.2 何首乌特异质型药源性肝毒性
3.2.1 代谢酶缺陷致特异质肝毒性
遗传性肝脏代谢酶缺陷可能表现为Ⅰ相和Ⅱ相代谢酶的基因表达异常,其在药物性肝损伤的发生发展中发挥重要作用[31]。李娜等[32]采用药物代谢酶抑制法观察代谢因素与何首乌中主要成分反式二苯乙烯苷对小鼠肝脏的影响,结果发现何首乌对Ⅱ相代谢酶抑制小鼠有明显的肝损伤作用,说明何首乌对Ⅱ相代谢酶基因多态性差异或功能低下的患者可能有潜在的肝损伤风险。
3.2.2 基于免疫炎症的特异质肝毒性
贺兰芝等[34]基于脂多糖(LPS)特异质炎症模型,研究何首乌醇提物的肝毒性,发现何首乌醇提物致大鼠肝毒性的机制可能与大鼠体内的炎症因子过表达和PPAR-γ通路异常抑制有关。井潇等[35]基于LPS 特异质炎症模型,发现何首乌醇提物能对大鼠肝细胞造成损伤,会引起胆汁代谢紊乱、胆汁淤积。谢丽华[36]认为LPS 诱导后灌胃大鼠何首乌醇提液,发现大鼠肝细胞变性,局部慢性炎性灶的肝损伤,其毒性机制可能与CYP1A2、CYP2E1、CYP3A1 的活性和CYP1A2 蛋白表达抑制有关。樊星等[37]认为在LPS 诱导何首乌肝损伤模型中,血清microRNA-122 可作为灵敏性及稳定性好的生物标志物。李春雨等[38]从何首乌肝损伤临床样本发现IL-1、IL-6、TNF-α 等细胞因子表达显著上调,提示免疫因素参与肝损伤;进一步研究LPS 刺激后诱导的何首乌特异质肝损伤,发现二苯乙烯苷可能是何首乌致特异质肝毒性物质,其中顺式二苯乙烯苷的毒性大于反式二苯乙烯苷,反式二苯乙烯苷能增强顺式二苯乙烯苷的特异质肝毒性。
3.2.3 易感人群的特异质肝毒性
柏兆方等[39]提出了易感人群(机体的免疫炎症活性异常)、免疫增强物质(如:反式二苯乙烯苷等)、易感物质(如:顺式二苯乙烯苷等)这三个因素所诱发的免疫特异质型肝损伤,即特异质肝损伤“三因制毒”机制假说。何首乌的特异质肝毒性是基于易感人群的免疫活性异常、炎症反应产生的。
3.2.4 基于人类白细胞抗原(HLA)基因多态性的特异质肝毒性
最近,欧阳冬生课题组对何首乌所致肝毒性的临床病例进行研究,发现延迟的药物不良反应是由T 细胞的不适当激活引起的,6 号染色体MHC 区编码HLA分子是引起T 细胞不当激活关键蛋白,HLA-B*35:01等位基因是何首乌致药物性肝损伤的遗传危险因子,可作为预测何首乌致药物性肝损伤的生物标志物[40]。
3.3 何首乌肝毒性原理的困惑与二苯乙烯苷分解代谢障碍致毒原理的思考
3.3.1 直接肝毒性学说依据与困惑
直接肝毒性学说主要依据有:1)存在直接毒性成分;2)与剂量相关;3)与用药时间相关,潜伏期较长,肝功能损害的症状大多发生在服药后一个月左右,说明需要一定时间的累积;4)可用动物模型模拟。直接肝毒性符合一般药源性肝毒性的基本特征,但又不遵循一般药源性肝毒性的普遍规律,即有很大的人群差异。
3.3.2 免疫激活(“三因致毒”、或特异质肝毒性)学说的依据与困惑
前面提到的免疫炎症的特异质肝毒性、易感人群的特异质肝毒性、基因多态性的特异质肝毒性可以归纳为免疫激活肝毒性学说。该学说认为何首乌对正常人群基本无毒,只有特异质免疫异常人群才呈现毒性。反式二苯乙烯苷(trans-SG)主要激活免疫状态,顺式二苯乙烯苷(cis-SG)具有潜在毒性,二者结合加上免疫异常人群,诱发肝毒性。免疫激活学说的依据:1)有效成分与毒性成分重叠,固有毒性小。实际使用何首乌的二苯乙烯苷含量远低于药典规定的毒性剂量上限;2)病理改变呈现免疫炎症特征。损伤部位有大量淋巴细胞浸润、可见嗜酸性小体,与自身免疫性肝病难以区分,与对乙酰氨基酚等直接肝损伤不同;3)采用内毒素(LPS)免疫敏化的动物模型可重现何首乌特异质肝毒性;4)家族性聚集案例,存在再激发现象。最近发现何首乌肝毒性与人群HLA 基因多态性有关,是免疫激活学说的最新证据。但免疫激活学说不能完全解释何首乌的肝毒性临床表现,也不完全遵循特异质肝毒性的普遍规律,即与用药剂量及时间关系不大。并且,trans-SG 是何首乌中该类化合物的主要成分,也是体内主要存在形式,存在直接肝毒性。
3.3.3 转化代谢学说的依据与困惑
转化代谢学说的依据:1)二苯乙烯苷主要经II 相肝药酶代谢,生成trans-SG 的葡糖醛酸结合物,然后随胆汁经由肠道排出,部分以二苯乙烯苷重吸收。2)代谢酶抑制剂酮康唑显著增加trans-SG 的肝损伤程度。而在人重组UGT 同工酶II 相代谢孵育体系中,检测到trans-SG 的葡糖醛酸代谢物,其毒性也降低。但是,在稳定持续给药条件下,由于trans-SG 重吸收会导致其体内浓度不断增加。即意味着,只要长时间使用何首乌,所有人群都可能存在肝毒性风险,这与何首乌肝毒性的临床表现也不完全符合。
3.3.4 二苯乙烯苷分解代谢障碍致毒原理的思考
根据物质体内代谢的一般规律,二苯乙烯苷在体内还可以继续进行分解代谢。只要体内对trans-SG进行分解代谢的酶正常,trans-SG 的累积性毒性就不会发生。相反,因遗传因素或后天影响导致代谢trans-SG 的酶活性降低,必将导致trans-SG 体内蓄积,引起肝损伤。经文献研究,发现二苯乙烯苷可经两步进行分解代谢:第一步,经β-D-葡萄糖苷酶脱苷形成二苯乙烯苷苷元,第二步经过氧化物酶(如乳过氧化物酶、木质素过氧化物酶)打开双键,生成无毒的对羟基苯甲醛或2,3,5-三羟基苯甲醛(图2)。因此,我们提出二苯乙烯苷分解代谢障碍致毒原理:即体内葡萄糖苷酶或/和过氧化物酶活性低,将导致二苯乙烯苷分解代谢障碍而蓄积,最终引起肝毒性。这可能成为何首乌肝毒性的原理之一。

图2 二苯乙烯苷转化、分解代谢原理图
4 何首乌肝毒性的防控策略
4.1 建立何首乌质量评价体系
2015 年版《中国药典》中生首乌和制首乌的主要质量控制成分为游离蒽醌、结合蒽醌和二苯乙烯苷,对三者的最低含量进行了规定,不能完全有效地评价生/制何首乌的质量。建立何首乌的指纹图谱,可为何首乌的质量评价提供依据。作者课题组采用超高效液相色谱,建立不同产地生/制何首乌二苯乙烯苷的含量测定方法和指纹图谱,可为何首乌药材整体质量控制的提供参考[41];我们采用高效液相(HPLC)对20 批生/制何首乌进行检测,建立何首乌指纹图谱,对10 个共有峰中的4个进行指定,分别为没食子酸、二苯乙烯苷、大黄素和大黄素甲醚,并对二苯乙烯苷和大黄素的含量进行测定,可为何首乌质量整体信息的控制提供依据[42]。
4.2 采用合理的炮制方法
目前,炮制减毒、配伍减毒、化学减毒和生物发酵减毒为何首乌主要的炮制减毒方法。黑豆蒸/炖制、高压炮制、七蒸七晒炮制等减毒方法所需温度高且工序复杂,应规范化其炮制工艺[43]。临床上何首乌主要与茯苓配伍减毒[44],庞晶瑶等[45]考察何首乌与茯苓、甘草、三七的配伍减毒情况,发现茯苓减毒的作用效果最明显。卢銮等[46]发现何首乌与不同剂量的黑豆配伍,能够缓解何首乌所致的胆汁淤积型肝损伤。杨倩等[3]发现含何首乌处方药味数的增加并没有导致不良反应的增加,提示合理配伍可以减少何首乌毒性。这些结果都表明合理配伍、组方得当可以减少何首乌的肝毒性。中药生物发酵减毒技术已广泛应用于中药炮制领域,其中应用最广的微生物是真菌中的灵芝菌。灵芝菌是多孔菌科真菌赤芝(Ganoderma lucidum)的菌种,为首个全基因组图谱确切,药用真菌次生代谢物种[47]。作者课题组发现灵芝菌能转化何首乌中的二苯乙烯苷,且能定量转化二苯乙烯苷,且转化后其毒性降低。灵芝菌中碳水化合物酶系的β-D-葡萄糖苷酶能水解苷形成相应的苷元[48]。灵芝菌中木质素修饰酶系的木质素过氧化物酶(Lip)能羟化苯乙烯结构中的C=C 双键[47,49]。灵芝菌转化减毒的机制可能为灵芝菌通过β-D-葡萄糖苷酶和木质素过氧化物酶断裂何首乌中二苯乙烯苷的糖苷键和C=C 双键形成无毒化学成分而减毒,为中药的炮制减毒提供实验依据。
4.3 辨证论治,个体化用药
生首乌临床可用于肠燥便秘、风疹瘙痒、疮疡等,制何首乌可用于治疗脱发、白发等属肝肾阴虚或精血亏虚患者,临床使用时应辨证、对证用药[50-51]。肾阳虚证(线粒体能量代谢水平偏低)者如在临床误用何首乌,会使其线粒体能量的代谢水平进一步降低,肝毒性化学成分代谢障碍而致毒。何首乌临床使用时,应关注特殊人群(儿童、老人、肝功能不全等)用药安全;在易感人群服用何首乌时,应进行人群易感性筛查,随时对肝功能进行监测,确保其安全性。
5 小结
随着何首乌及其成方制剂在预防和治疗疾病中的广泛使用,其肝毒性引起了人们的广泛关注。何首乌肝毒性化学成分及致毒原理尚未完全阐明。本文通过分析现有文献资料及结合作者课题组的工作,认为二苯乙烯苷既是何首乌的有效成分,也是导致肝毒性的主要成分之一。何首乌导致肝毒性的机理应是多方面的,包括直接肝毒性、免疫激活肝毒性(特异质免疫损伤和基因多态性免疫应激)和代谢障碍肝毒性,其中分解代谢障碍所致肝毒性以往关注较少,应引起重视。可建立合理质量评价体系、优化炮制工艺和实施辨证论治、个体化用药等进行综合防控。
