越鞠丸对皮质酮体外模型神经元过度自噬的保护作用研究*
2019-01-18陆林玉唐娟娟
陆林玉,吴 蝶,王 凯,唐娟娟**,陈 刚
(1. 南京中医药大学医学与生命科学学院·整合医学学院 南京 210023;2. 暨南大学脑病个性化防治跨学科研究所 广州 510632;3. 神经再生协同创新中心 南通 226001)
抑郁症是一种以显著而持久的心境低落为主要临床特征的情感性精神障碍综合征,因其具有高患病率和高致死率,被称为“第一心理杀手”。目前临床首选抗抑郁药物为5-羟色胺再摄取抑制剂,如氟西汀、舍曲林和帕罗西汀等[1]。然而,这些药物作用大部分基于单胺类神经递质失调的假说,且存在副作用大、起效慢和易复发等缺点,这表明单胺类神经递质失调假说并不能完全阐明抑郁症的发病机制。因此,探讨抑郁症发病机制,寻找快速起效安全的抗抑郁药迫在眉睫。
近年来的研究证实,自噬参与抑郁症的发生发展。自噬是细胞自我降解的过程,通过去除错误折叠或聚集的蛋白以及损伤的细胞器减少细胞的坏死和凋亡,维持内环境稳态。自噬在一定限度内是有益的反应,但是在一些疾病过程中,可能出现自噬过度激活的现象。Beclin-1 与LC3 是两种具有代表性的自噬标志性蛋白,Beclin-1是调控细胞自噬的关键因子,是自噬体形成的必要条件,LC3 则参与自噬体膜的形成[2]。重度抑郁症患者血液中自噬基因表达增加,产前应激小鼠的雄性后代海马自噬水平升高[3]。抑郁症患者尸检发现,前额叶皮层(prefrontal cortex,PFC)突触蛋白合成受抑制,mTOR 磷酸化水平降低,提示自噬激活[4]。mTOR 是自噬的关键调节因子,其丝氨酸2448位点磷酸化后可被激活,继而磷酸化下游底物,调控自噬相关蛋白。mTOR 通路的异常往往伴随着自噬障碍。双相情感障碍患者AKT(Protein kinase B,PKB)和mTOR 的mRNA 表达较健康对照组显著降低,可能导致自噬的诱导[5]。快速起效原型药氯胺酮能够通过激活mTOR,抑制自噬,增强突触可塑性,从而发挥快速抗抑郁作用[6]。
越鞠丸始载于《丹溪心法》,由栀子、苍术、香附、川芎、神曲组成,是治疗郁症的经典方,对其治疗抑郁症的相关机制研究也多见报道[7-9]。本实验室前期研究结果表明,在小鼠慢性不可预知应激模型中,越鞠丸醇提物(YJ-E)具有快速持久的抗抑郁作用,其作用靶点为mTOR 信号通路[7],但是越鞠丸与mTOR 调控的自噬相关性尚不清楚。本实验旨在皮质酮离体应激模型的基础上,评价YJ-E 对PC12 细胞的神经保护作用及其机制。
1 材料与方法
1.1 药物及试剂
越鞠丸由栀子、川芎、苍术、香附、神曲组成,药材来自南京国医堂门诊部药房,皮质酮(CORT)购自
Aladdin,C104537。
胎牛血清(fetal bovine serum,FBS),胰蛋白酶(trypsin,Gibco,10270-106,25200-056);高糖培养基(Dulbecco's modification of Eagle's medium,DMEM,
Gibco,11995-065);MTT(Biofrox,298-93-1);青霉素-链 霉 素(Gibco);磷 酸 盐缓 冲 液(phosphate buffer saline,PBS,Hyclone,SH30256.01);二 甲 基 亚 砜(Dimethyl sulfoxide,DMSO,Aladdin,D103272)。
1.2 仪器
SC06AD-2 型恒温二氧化碳(CO2)培养箱;CX31型荧光倒置显微镜(Olympus);Multiskan FC 型全自动酶标比色仪(Thermo Scientific);ThermoFisher50137369低温超速离心机,EPED-E2-10TF 型超纯水器,SWCJ-2F 型双人双面超净台(苏州净化设备有限公司);TY-80S 型脱色摇床(普阳科学仪器研究所);蛋白电泳系统,Mini Trans-Blot 转印槽(Bio-Rad);5200 系列凝胶成像及分析系统(上海天能科技有限公司),Thermo Nanodrop 2000紫外分光光度计。
1.3 细胞培养
PC12 细胞复苏后培养(10%胎牛血清,1%青霉素-链霉素)于37℃、5% CO2培养箱中,24 h 后更换培养基,取对数生长期的PC12细胞,以5×104个·mL-1的密度,接种于96孔培养板,待细胞完全贴壁后,加入皮质酮浓度梯度为100,200,400 μmol·L-1,继续培养24 h。
1.4 越鞠丸醇提液(YJ-E)的制备
栀子、苍术、香附、川芎、神曲各200 g 打粉,过100目筛混匀,加入10 倍量95%乙醇室温24 h,收集浸出液,重复2 次。过滤浸出液后,55℃条件下减压浓缩,收集浓缩后浸膏48.4 g,分装于-20℃保存。将越鞠丸母液(48.4 g·L-1)用DMEM 分别稀释为0.2,0.4,0.8 mg·mL-1,预给药30 min 后,皮质酮(200 μmol·L-1)孵育24 h,更换不含血清高糖DMEM 培养液,进行后续实验。
1.5 MTT法测定细胞存活率
PC12 细胞接种于96 孔板上培养24 h 后更换无血清培养基,随机分组。YJ-E 预给药30min,皮质酮孵育24 h,每孔加入20 μL 5 g·L-1的MTT 溶液,37℃继续孵育4 h,吸弃培养基,每孔加入150 μL DMSO,摇床慢摇20 min,570 nm 波长测定各孔光吸收值,并记录结果。
1.6 Hoechst 染色法
PC12细胞接种于24孔板(2×105mL-1),培养24 h后更换无血清培养基,随机分组。YJ-E 预给药30 min后,皮质酮孵育24 h,吸弃培养基,加入终浓度10 μg·mL-1的Hoechst 33342 溶 液(四正柏,FXP138-1000)250 μL,室温放置15-60 min 后,吸弃染色液,4%多聚甲醛溶液固定20 min。PBS 溶液洗涤细胞3 次,每次10 min。荧光显微镜紫外滤光器下观察细胞核大小及形态。
1.7 Western blotting
PC12 细胞接种于6 孔板(1 × 106mL-1,2 mL/孔),24 h 更换无血清培养基,随机分组。YJ-E 孵育30 min后加入皮质酮,24 h 后收集细胞,加入50 μL RIPA(Radio-Immunoprecipitation Assay)裂解液,离心取上清,紫外分光光度计测定蛋白浓度。10% SDS-PAGE电泳分离蛋白,300 mA 转膜(Polyvinylidene fluoride,PVDF膜)60 min,5%脱脂奶粉室温封闭1 h,加入一抗p-mTOR,mTOR,LC3,Beclin-1 (Cell Signaling Technology,2972S,2971S,4108,3738),Tubulin(proteintech,10094-1-AP)4℃过夜。TBST 漂洗3 次,10 min·次-1,加入二抗羊抗兔-HRP(正能,511203)37℃孵育1 h,TBST 漂洗3 次,10 min·次-1,ECL 显影(康为世纪生物科技),全自动化学发光图像分析系统显影分析。
1.8 统计学处理
数据均用±SEM 表示,采用One-way ANOVA 结合Tukey 多重比较(GraphPad Prism 5.0)分析各组间差异。P<0.05为差异有统计学意义。
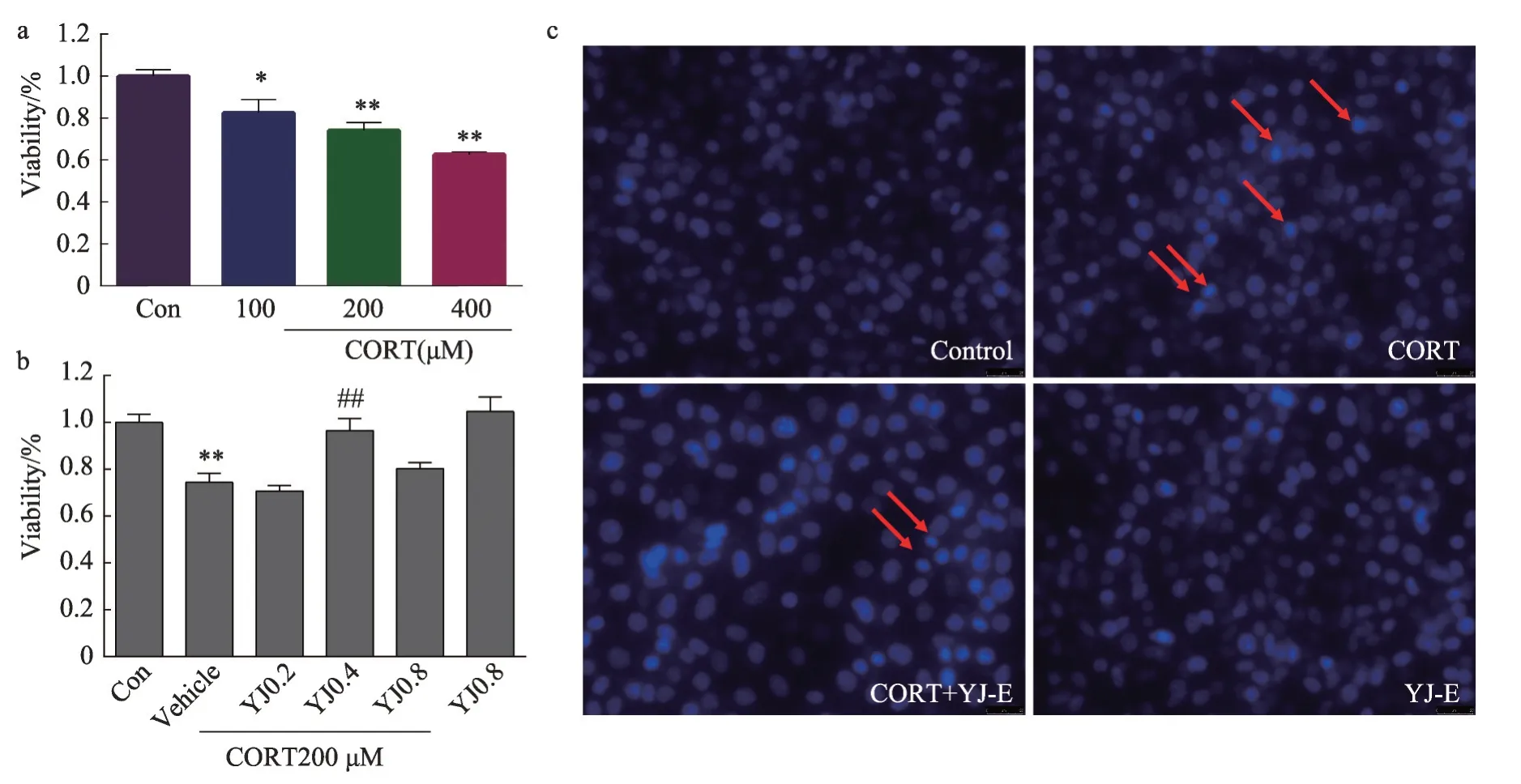
图1 0.4 mg·mL-1 YJ-E提高皮质酮模型下PC12细胞的存活率。a.3个浓度的皮质酮(100,200,400 μmol·L-1)均能显著降低PC12细胞的活性。ANOVA,F(3,33)=20.36,P<0.0001;b.预给予3个浓度YJ-E(0.2,0.4,0.8 mg·mL-1),其后给予皮质酮200 μmol·L-1,其中0.4 mg·mL-1 YJ-E显著改善皮质酮诱导的PC12细胞的凋亡,0.2,0.8 mg·mL-1YJ-E不能逆转PC12细胞的凋亡。ANOVA,F(5,37)=11.06,P<0.0001;c.Hoechst染色。*P<0.05,**P<0.01,与对照组相比,##P<0.01,与皮质酮组相比,n=5。
2 结果与分析
2.1 YJ-E改善皮质酮诱导的PC12细胞的凋亡
MTT法结果显示,给予100 μmol·L-1皮质酮,PC12细胞存活率为82.4%;给予200 μmol·L-1皮质酮,细胞存活率为74.1%;给予400 μmol·L-1皮质酮,细胞存活率为62.5%,三个浓度的皮质酮均能显著降低PC12 细胞的活力(ANOVA, F(3, 33)=20.36,P<0.0001)(P<0.05,P<0.01,P<0.01)(图1a),因此选取200 μmol·L-1进行后续实验。结果表明,皮质酮浓度依赖性的损伤PC12细胞。
预给予3 个浓度的YJ-E(0.2,0.4,0.8 mg·mL-1),其中0.4 mg·mL-1的YJ-E 能够显著改善皮质酮模型下PC12 细胞的存活(P<0.01),0.2,0.8 mg·mL-1的YJ-E均无显著改善作用。单独给予0.8 mg·mL-1的YJ-E 对PC12 细胞的存活率无显著影响(ANOVA, F(5,37)=11.06,P<0.0001)(图1b)。因此选取0.4 mg·mL-1YJE进行后续实验。
Hoechst 染色结果显示,对照组和单独给予YJ-E组PC12 细胞核形态呈圆形,淡蓝色,内有较深蓝色颗粒。皮质酮模型组大部分细胞核浓集呈亮蓝色,形态皱缩。预给予YJ-E 组大部分细胞核呈圆形淡蓝色,仅少量细胞核皱缩(图1c)。结果表明,0.4 mg·mL-1YJ-E 显著改善皮质酮诱导的PC12 细胞凋亡,而0.2,0.8 mg·mL-1的YJ-E无此神经保护作用。
2.2 YJ-E抑制皮质酮诱导的PC12细胞的过度自噬
Western blotting 结果显示,200 μmol·L-1皮质酮显著降低mTOR 的磷酸化(P<0.01),预给予0.4 mg·mL-1YJ-E 逆转了mTOR 磷酸化水平的降低(P<0.01)(ANOVA,F(3,8)=11.9,P=0.0026)。同时,皮质酮模型下LC3II/LC3I 和Beclin 的表达增加(P<0.01,P<0.01),YJ-E 抑制了LC3II/LC3I 和Beclin 的蛋白表达(P<0.01,P<0.05)(ANOVA, F(3,8)= 9.788,P=0.0047;ANOVA,F(3,8)=9.194,P=0.0057)。单独给予YJ-E 对于mTOR 的磷酸化及LC3II/LC3I,Beclin 的蛋白表达水平无影响(图2)。结果表明,YJ-E 对皮质酮离体模型下PC12 细胞的神经保护作用机制可能与促进mTOR磷酸化,抑制神经元过度自噬相关。

图2 YJ-E促进皮质酮离体模型下PC12细胞mTOR的磷酸化,抑制神经元过度自噬。a.Western blotting结果图示p-mTOR,mTOR,LC3I,LC3II,Beclin和Tubulin的表达;b-d.预给予0.4 mg·mL-1YJ-E,其后给予200 μmol·L-1皮质酮,对PC12细胞mTOR磷酸化水平及LC3,Beclin表达的影响。ANOVA,F(3,8)=11.9,P=0.0026;ANOVA,F(3,8)=9.788,P=0.0047;ANOVA,F(3,8)=9.194,P=0.0057。**P<0.01,与对照组相比,##P<0.01,与皮质酮组相比,n=3。
3 讨论
抑郁症与中医的“郁证”类似,一些解郁的经方已广泛用于治疗抑郁症,如甘麦大枣汤,栀子厚朴汤,越鞠丸等。本实验室前期对越鞠丸的研究发现,在小鼠慢性不可预知应激模型(Chronic unpredictable mild stress,CUMS)中,越鞠丸表现出与氯胺酮类似的快速抗抑郁作用,其作用靶点为NR1(N-methyl-Daspartic acid receptor 1,NMDA 受体1)和Akt/mTOR 信号通路[7];在慢性注射皮质酮的小鼠抑郁症模型中,越鞠丸可以激活PKA(protein kinase A,蛋白激酶A)-ERK(extracellular regulated protein kinases,细胞外调节蛋白激酶)-CREB(cAMP response element binding protein,cAMP反应元件结合蛋白)信号通路,增强海马神经新生,发挥抗抑郁作用[10]。越鞠丸加四君子汤能够快速增加小鼠海马中的PACAP 和BDNF 蛋白的表达而产生快速抗抑郁的作用[11]。越鞠丸还可以通过增加Balb/c 小鼠前额皮层的场电位及长时程增强,提高突触传递效能,产生抗抑郁作用[12]。本研究发现:①高浓度皮质酮显著损伤PC12 细胞,降低其活力,因此本研究在体外模型中模拟了抑郁症形成过程中皮质酮对神经细胞活力的损伤作用;②0.4 mg·mL-1YJ-E能够改善皮质酮诱导的PC12 细胞凋亡,而低、高剂量均无此神经保护作用;③YJ-E 显著增加皮质酮诱导的PC12 细胞mTOR 的磷酸化水平,与CUMS 小鼠模型YJ-E 对前额叶神经细胞的作用相一致;④YJ-E 显著抑制皮质酮诱导的PC12 细胞自噬相关蛋白LC3II/LC3I 和Beclin 的表达,显示YJ-E 能够逆转此离体模型中神经细胞的过度自噬。
慢性应激能够引起人类和小鼠糖皮质激素和皮质酮水平升高,而过高的糖皮质激素和皮质酮也是抑郁症的重要表现之一。高浓度的糖皮质激素和皮质酮能诱发神经元和胶质细胞相关的多种疾病反应,如调亡、自噬和突触可塑性的改变。因此离体实验通常采用皮质酮刺激神经元或胶质细胞,模拟抑郁症的内环境,建立抑郁症离体模型[13]。自噬是真核细胞中普遍存在的一种现象,在维持细胞、组织和生物体稳态过程中发挥重要作用。在抑郁症相关的动物模型中,研究发现自噬水平降低的现象。例如,在LPS(Lipopolysaccharides,脂多糖)以及慢性不可预知应激诱导的动物抑郁模型中,自噬标志物表达降低[14,15]。然而,临床研究发现,与健康对照组相比,患有严重抑郁症的个体血液单核细胞中的自噬基因的表达升高[16]。所以在抑郁症中,自噬的调节是正向还是负向尚存在争议[17]。近期研究发现许多抗抑郁药与自噬通路密切相关[18],经典自噬诱导剂雷帕霉素通过mTOR通路发挥抗抑郁样作用[19],另外金丝桃素[20]、罗格列酮[21]、水飞蓟宾[22]和芡实提取物[23]等均能通过增强自噬抗抑郁。因此,自噬是一把双刃剑。适度的自噬可以将一些损坏的蛋白或细胞器进行降解,并得以循环利用。过度的自噬会导致细胞内代谢紊乱,引起神经元和胶质细胞功能异常甚至凋亡,可能是离体皮质酮模型中神经细胞活力明显下降的原因之一。抗抑郁药氟西汀通过上调AKT 的磷酸化促进神经发生并改善神经元存活,而PI3K(Phosphoinositide 3-kinase,磷脂酰肌醇三激酶)-AKT-mTOR 信号通路是抑郁症中调节自噬的重要通路[15]。Warren 等[24]发现,氟西汀和派醋甲酯联用能够逆转SD 大鼠的抑郁样行为,并增加大鼠腹侧被盖区mTOR、CREB(环磷腺苷效应元件结合蛋白,cAMP-response element binding protein)、ERK(细胞外调节蛋白激酶,extracellular regulated protein kinases)的蛋白表达水平。因此,mTOR 信号通路参与抗抑郁药的作用机制,其通过促进蛋白质合成诱导神经再生,发挥神经保护作用[25]。Park 等[26]发现西酞普兰、帕罗西汀与苯环丙胺可以显著增加mTOR 及其下游分子4E-BP1(真核翻译起始因子4E 结合蛋白1,Eukaryotic translation initiation factor 4E-binding protein 1)和p70S6K 的磷酸化水平,并增加海马树突生长和突触蛋白水平,这些作用可以被雷帕霉素所抑制。本研究中越鞠丸可以促进皮质酮模型下PC12 细胞mTOR 的磷酸化,其通过mTOR 信号通路调控细胞自噬,保护细胞免受皮质酮的损伤。
微管相关蛋白轻链3(LC-3)和Beclin 是自噬相关基因编码产物,LC-3Ⅰ向LC-3Ⅱ转化是判断自噬的指标,而Beclin-1 是自噬必不可少的正向调节因子[27]。因此,本研究通过观察mTOR 的磷酸化水平以及LC3、Beclin 自噬相关指标,发现:慢性应激可以通过抑制mTOR 磷酸化诱导自噬。适度自噬对维持神经元稳态发挥重要作用,但是持续慢性应激导致脑内皮质酮大量蓄积,诱导神经元内过度自噬,自噬小体积聚,神经元凋亡增加,从而引发抑郁症。越鞠丸醇提物能够通过调控mTOR 的磷酸化阻断神经元内过度自噬,减少自噬小体的形成,在离体抑郁症模型中发挥神经保护作用(图3)。
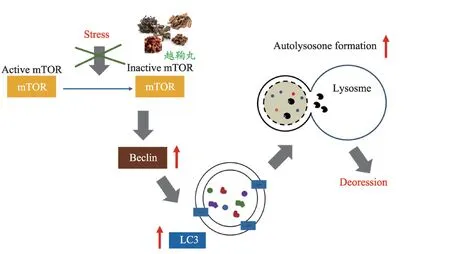
图3 假说图:越鞠丸醇提物通过调控mTOR的磷酸化阻断神经元内过度自噬,减少自噬小体的形成,在离体抑郁症模型中发挥神经保护作用。
抑郁症是一种慢性、易复发的精神障碍疾病,近年来越发引起临床关注。越鞠丸功用行气解郁,临床常用于郁证的治疗。本研究在前期研究基础上,建立抑郁症离体模型,探讨了抑郁症中神经元过度自噬的可能机制,并进一步为临床应用越鞠丸治疗抑郁症提供了有力证据,也为研发靶向自噬抗抑郁症药物提供新的策略。
