调心补肾方改善Presenilin1/2条件性双基因敲除小鼠记忆障碍的机制研究*
2019-01-18王迪霖郎韫哲陈昕昀王俐君
王迪霖,郎韫哲,袁 见,陈昕昀,李 坤,王俐君,王 健**,徐 颖**
(1. 上海中医药大学基础医学院 上海 201203;2. 上海中医药大学康复医学院 上海 201203)
阿尔茨海默症(Alzheimer's disease,AD)又称老年痴呆,是一种进行性发展的神经系统退行性疾病,多发于老年人。患者主要临床表现为记忆力逐渐减退、认知功能发生障碍、行为异常和社交障碍等[1]。近年来,我国AD 的发病率与死亡率日益上升,也得到了社会的广泛关注。
目前AD 的发生机制并不十分清楚,国际上也存在众多假说,如淀粉样蛋白假说、Tau 假说、神经炎症假说、神经元丢失等假说。其主要病理特征为大脑中Aβ 聚集形成的老年斑、过度磷酸化的tau 蛋白聚集而成的神经元纤维缠结(NFTs)、长期炎性反应以及神经元死亡等[2,3]。
而中医对AD 的治疗方法更侧重于从整体出发,并且中药具有多靶点、多系统、多环节、多途径作用在研究老年痴呆疾病方面表现出独特的优势[4]。建立在唐代孙思邈《备急千金要方》中益智健脑之代表方“开心散”基础上的“调心补肾方”方药组成包括党参、石菖蒲、远志、茯苓、丹参、肉苁蓉、枸杞子。具有安神解郁、提高记忆力、增强免疫力的作用。
我们利用Presenilin1/2 条件性双基因敲除(presenilin1/2 conditional double knockout mice, PS cDKO)小鼠作为AD 模式小鼠,从行为学与生化指标评价“调心补肾方”对PS cDKO 小鼠学习记忆能力的影响,为进一步探索功效物质基础与新药开发提供方向。
1 材料与方法
1.1 材料
1.1.1 动物
SPF 级PS cDKO 及其同窝野生型小鼠,共60 只,3-3.5月龄,体重27±5 g,雌雄各半,在上海中医药大学实验动物中心饲养,温度控制在21±2℃,湿度45%-65%,12 h︰12 h 明暗交替。实验操作均严格按照实验动物伦理学相关规则进行,经上海中医药大学动物伦理委员会批准(审批号:SZY 201707015)。
1.1.2 实验设备、药物及主要试剂
行为学记录仪(荷兰Noldus Information Technology公司,型号:EthoVision XT),电泳仪(美国BIO RAD,型号:BR90518);全自动凝胶成像系统(上海天能公司,型号:Tanon-4200SF);荧光可视显微镜(德国Carl Zeiss,型号:Axio Imager 2);RIPA 裂解液(批号:090717170930)购自碧云天生物技术公司;脱脂奶粉(批号:6A310420)购自Amresco 公司;BSA(批号:6531010160)购自Genview 公司;ECL 显影液(批号:SD246946)购自Thermo Scientific 公司;DAB(货号:D5637-5 G)购自Sigma-Aldrich 公司;Triton X-100(批号:20121211)购自国药集团化学试剂有限公司;孵辣根酶标记链霉卵白素工作液(批号:K187712C)购自中杉金桥公司。调心补肾方购自上海中医药大学附属龙华医院,为配方颗粒(党参1.2 g、石菖蒲1.2 g、远志1.2 g、茯苓1.2 g、丹参1.2 g、枸杞子1.2 g、肉苁蓉1.2 g)。
使用的抗体信息如下:

1.2 实验方法
1.2.1 动物分组与治疗方法
60 只3~3.5 月龄的SPF 级PS cDKO 小鼠及其同窝野生型小鼠按照随机分为3 组:野生型组(WT,n=20)、PS cDKO 组(cDKO,n= 20)及PS cDKO 加药组(cDKO+TXBSF,n=20);根据“人与动物体表面积换算 法”,cDKO + TXBSF 组 食 用 含 有TXBSF(17913 ppm)的饲料,其余两组食用普通饲料。60 d 后进行行为学检测,之后进行脑组织取材,通过Western blot 等方法进行检测。
1.2.2 旷场实验
长宽高分别为为38 cm×38 cm×25 cm 的旷场箱顶部开放,内面呈白色。设置宽9 cm 设置为边缘区域。顶部正上方放置摄像头。实验前用手安抚小鼠,实验时将小鼠轻轻放入旷场箱的正中间任其自由活动,由电脑和摄像头记录数据,15 min后取出小鼠。用75%的酒精棉球清除小鼠残留的粪便及尿液,待酒精挥发后进行下一只小鼠的测试。
1.2.3 高架十字迷宫实验
选取WT、PS cDKO、cDKO+TXBSF 组小鼠识别编号后从同侧放入高架十字迷宫,面向开放臂。观察小鼠是否进入封闭区,时间为5 min。记录实验结果待分析。实验结束后用75%的酒精棉球清除小鼠残留的粪便及尿液,待酒精挥发后进行下一只小鼠的测试。
1.2.4 Y迷宫实验
Y 迷宫三个臂呈120°角水平布置,三个臂长宽高分别为30 cm × 6 cm × 15 cm。选取WT、PS cDKO、cDKO + TXBSF 组小鼠识别编号后放入Y 迷宫中,一侧用挡板档起。所有小鼠从同侧放入,任其自由活动8 min。1 h 后撤去挡板,重复以上步骤记录小鼠对于原闭合区的敏感程度并记录实验结果待分析。实验结束后用75%的酒精棉球清除小鼠残留的粪便及尿液,待酒精挥发后进行下一只小鼠的测试。
1.2.5 恐惧实验
实 验 分 为:taining,contextual,cued 三 个 阶 段。Training 阶段:将小鼠置于恐惧实验箱中,另其自由活动3 min,接下来给予持续28 s和75 db的声音刺激,后给予2 s 的0.45 mA 的电刺激小鼠足底。记录30 s 中小鼠除呼吸以外无任何活动的僵直时间(freezing time)。Contextual阶段:位于training阶段的24 h后,将小鼠放入相同的恐惧实验箱中,不给予任何声刺激及电刺激,记录其在4 min 的内除呼吸以外的僵直状态时间。Cued 阶段:位于Contextual 阶段的1 h 后,将小鼠放入另外一个环境不同的恐惧箱中,不给予任何刺激,观察记录其在3 min 内的僵直时间,再给予与Training 阶段相同的声音刺激后记录3 min 中小鼠的僵直时间。实验结束后用75%的酒精棉球清除小鼠残留的粪便及尿液,待酒精挥发后进行下一只小鼠的测试。
1.2.6 Western blot 检测蛋白表达
各组小鼠用20%水合氯醛麻醉后快速断头取脑,用预冷的PBS 冲洗一遍后,快速剥离出海马组织,将其置于冻存管放于液氮中,后放入-80℃冰箱保存备用。
在使用时,取出组织标本50 mg-80 mg,加入400 ul 的裂解液,研磨60 s 后提取出总蛋白,12000 rpm 离心15 min 后,取上清液即为总蛋白。采用BCA 法进行蛋白定量,制成1 mg·mL-1蛋白标准品,在-20℃下保存。将蛋白标准品用0.01 M PBS 梯度稀释后,每个浓度取20 μl 加入到96 孔板中,并制作标准曲线。将样本也使用同样方法稀释50倍,毎孔20 μl总体积,每组做三个复孔。各孔加入200 μl BCA 工作液,37℃隔水式恒温培养箱放置30 min,使用酶标仪562 nm 测定吸光度,并根据标准曲线计算出样品蛋白浓度。将样品与5×Loading buffer 按比例混合均匀后并变性,室温冷却后进行上样,上样量为10 μl/40 μg 蛋白。将各不同组别的蛋白样品加入到电泳槽中相应泳道电泳,先后用60 V 及80 V 恒压电泳各0.5 h 后用100 V 恒压直至溴酚兰迁移至分离胶底部后停止,取出凝胶并放置在转膜缓冲液中。其后进行转膜,将凝胶切成适当大小,NC 膜、滤纸和海绵垫均浸泡在转膜缓冲液中。于110 V 恒压转膜2 h,后将蛋白转至NC 膜上。经过封闭及一抗、二抗孵育及显色后,在膜上滴加混匀的ECL 显色剂,用凝胶成像仪采集图像并读取数据。用Image J 软件分析目的蛋白光密度与内参蛋白的光密度。
1.2.7 免疫组化染色方法
小鼠用麻醉后进行4%多聚甲醛心脏灌注后取脑,用4%多聚甲醛后固定和蔗糖溶液梯度脱水后进行OCT 包埋,保存于-80℃。包埋后用冰冻切片机将脑组织切成20 μm厚的冠状面脑片。将挑选好的脑片用PBS 溶液洗10 min 后,用PBS、甲醇和3% H2O2的混合液(比例为5∶4∶1)孵育30 min。接下来用0.1%Triton X-100(溶于PBS)孵育10 min 透膜。用PBS 洗3次(每次10min)后用1% BSA 室温封闭2 h,之后孵一抗4℃过夜。PBS 洗3 次(每次10 min)后孵二抗,孵育2 h。PBS 洗3次(每次10 min)后孵辣根酶标记链霉卵白素工作液,37℃孵育15 min。PBS 洗3 次(每次10 min)后用0.05% DAB 孵育,待脑片显色后用PBS 洗3次后贴片,过夜晾干。用二甲苯透明和乙醇梯度脱水,中性树胶封片,最后用显微镜观察,在高倍镜下拍摄小胶质细胞的形态。
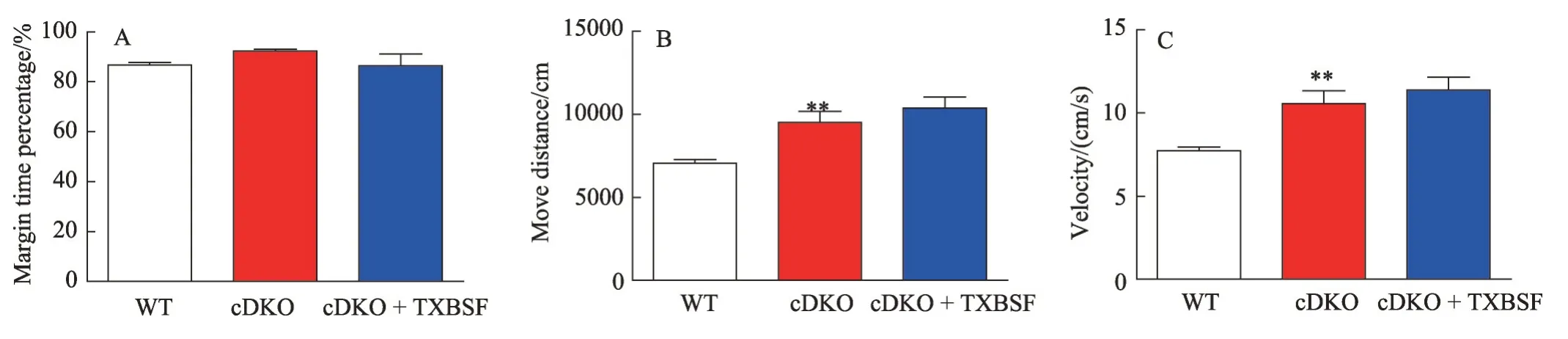
图1 TXBSF对PS cDKO小鼠运动能力的影响

图2 TXBSF 对PS cDKO小鼠焦虑样行为的影响
1.3 统计学方法
实验数据均使用平均值± 标准误(Mean ± SEM)表示,实验数据用SPSS 18.0 软件分析,多组间的比较采用了One-way ANOVA 分析方法,多项间比较用LSD检验,使用Graphpad Prism 7 制图。P<0.05 表示差异有统计学意义。
2 实验结果
2.1 TXBSF不影响PS cDKO小鼠运动能力
旷场实验主要是反应实验动物的自发运动能力和紧张焦虑状况。由图1 可知,PS cDKO 小鼠的运动距离比WT 组小鼠明显增加(P<0.05),而cDKO +TXBSF 小鼠的运动距离与PS cDKO 小鼠没有显著性差异,说明TXBSF 并不会影响PS cDKO 小鼠的自发运动能力;同时,3组小鼠在边缘区域的时间百分比并没有显著性差异。
2.2 TXBSF改善PS cDKO小鼠的焦虑样行为
高架十字迷宫实验通过测试动物进入开放臂及封闭臂的次数及时间,以及在开放臂和封闭臂探索的时间占总测试时间的百分比对小鼠的焦虑状态进行评价。由图2可知,PS cDKO组小鼠较WT小鼠在开放臂逗留的频率是降低的(P<0.01),时间相比是增高的(P<0.001),cDKO + TXBSF 组的小鼠较PS cDKO组小鼠在开放臂逗留的频率是增加的(P<0.01),时间是减少的(P<0.05),并且具有统计学意义。说明TXBSF能改善PS cDKO小鼠的焦虑样行为。
2.3 TXBSF改善PS cDKO小鼠的空间记忆障碍
Y 迷宫主要用于研究啮齿类动物空间工作记忆,其完全是利用实验动物对新异环境探索的天性,由于动物每次转换探索方向时都需要记住前一次探索过的方向,因此Y 型迷宫实验能够有效地测定动物的空间工作能力。由图3可知,PS cDKO小鼠较WT组小鼠在闭合臂逗留的频率和时间相比是降低的(P<0.01),而cDKO+TXBSF 小鼠在闭合臂逗留的时间和频率较PS cDKO 小鼠是增加的(P<0.01),并且具有统计学意义。说明TXBSF 能改善PS cDKO 小鼠空间学习记忆能力。
2.4 TXBSF改善PS cDKO小鼠联合记忆能力
恐惧实验可以检测与小鼠的联合记忆能力。实验结果显示Training 阶段3 组小鼠的僵直时间百分比均较低。Contextual 阶段及Cued 阶段,PS cDKO 小鼠的僵直时间百分明显低于WT 组(P<0.001),且cDKO+ TXBSF 小鼠的僵直时间百分比PS cDKO 小鼠高(P<0.05)(图4)。由此说明,TXBSF 可以改善PS cDKO小鼠的联合记忆能力。
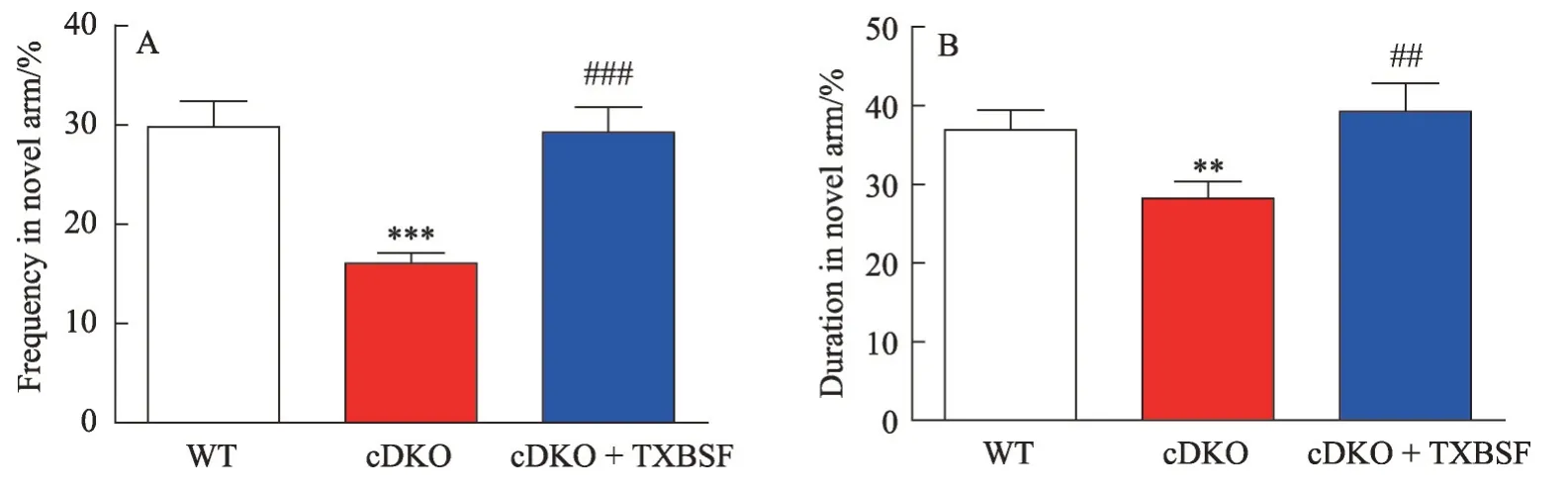
图3 TXBSF对PS cDKO小鼠空间记忆障碍的影响
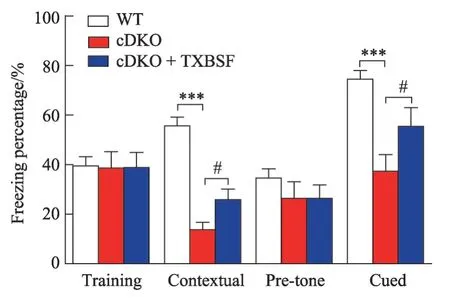
图4 TXBSF对PScDKO小鼠联合记忆能力的影响
2.5 TXBSF 降低PS cDKO 小鼠海马组织中促炎症因子iNOS和COX-2蛋白表达
Western blot 的检测结果显示,海马组织促炎症因子诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)和环氧合酶2(cycloxygenase-2, COX-2)的蛋白表达水平在PS cDKO 小鼠较WT 小鼠是升高的(P<0.001),而cDKO + TXBSF 小鼠较PS cDKO 小鼠是降低的(P<0.01,P<0.05,),TXBSF 降低了PS cDKO 小鼠海马组织中促炎症因子iNOS 和COX-2 的蛋白水平(图5)。
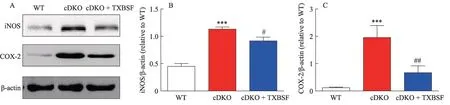
图5 TXBSF对PS cDKO小鼠海马组织中iNOS和COX-2表达的影响
2.6 TXBSF 提高PS cDKO 小鼠海马组织中突触蛋白MAP2和PSD95的表达
与神经元突触功能相关的微管相关蛋白2(microtubule-associated protein 2, MAP2)以及突触后致密蛋白95(Postsynaptic dlensity 95, PSD95)在PS cDKO 小鼠海马中的表达较WT小鼠水平下降,差异有统计学意义(P<0.01,P<0.001),而此两种蛋白表达在cDKO + TXBSF 小鼠较PS cDKO 小鼠是升高的,且有统计学意义(P<0.01,P<0.001)(图6)。表明TXBSF 改善PS cDKO 小鼠海马组织神经元和突触损伤。
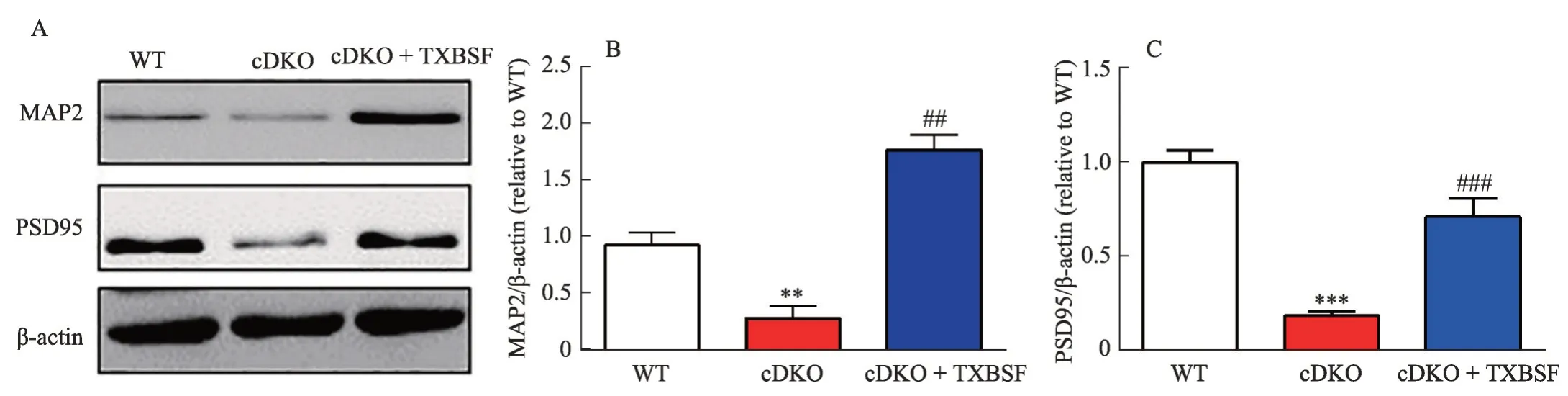
图6 TXBSF对PS cDKO小鼠海马组织中MAP2和PSD95蛋白表达的影响
2.7 TXBSF 阻止PS cDKO 小鼠海马CA3 区小胶质细胞的激活
采用Iba1 抗体进行DAB 免疫染色观察3 组小鼠海马CA3 区小胶质细胞的形态变化(图7)。结果发现,与WT 小鼠相比,PS cDKO 小鼠海马CA3 区的小胶质细胞呈现出明显的激活状态,出现胞体增大,突起回缩的阿米巴样变化;然而cDKO + TXBSF 小鼠CA3区小胶质细胞的激活现象得到明显改善。
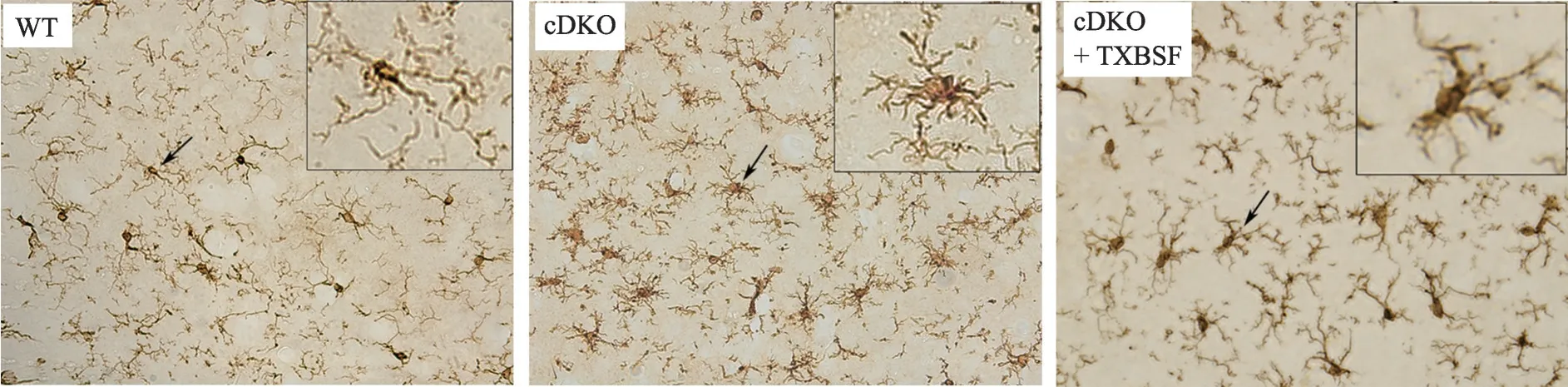
图7 TXBSF对PS cDKO小鼠海马CA3区小胶质细胞形态的影响
3 讨论
阿尔茨海默症作为如今最受关注的神经退行性疾病之一,近年来发病率与死亡率逐年上升。该症患者会出现一定的学习记忆功能障碍。我们使用PS cDKO 小鼠作为AD 模型,从行为学与生化指标评价“调心补肾方”对动物学习记忆能力的影响。旷场实验通过摄像头记录的小鼠总运动距离与平均速度来判断它们的自发运动能力,记录小鼠在边缘区域的时间百分比来评价它们焦虑状态和运动能力的一种经典行为学方法[5,6]。实验结果显示:PS cDKO小鼠较WT小鼠运动能力高,而TXBSF 不会影响小鼠的运动能力。高架十字迷宫实验通过测试小鼠进入开放臂及封闭臂的次数及时间以检测小鼠的焦虑状态及学习记忆能力[7]。实验结果显示PS cDKO 小鼠较WT 小鼠焦虑,TXBSF 能改善这一焦虑症状。同时PS cDKO 小鼠在开放臂逗留时间低于WT及cDKO+TXBSF 小鼠,说明TXBSF 能改善PS cDKO 小鼠的焦虑样行为。Y迷宫实验根据小鼠倾向于探索新异空间的天性,检测小鼠对新异臂的空间记忆能力[8]。实验结果显示PS cDKO 组小鼠在闭合臂的逗留频率及时间比均比WT小鼠低,而TXBSF 治疗之后,闭合臂逗留频率及时间比明显增加。说明TXBSF 能改善PS cDKO 小鼠空间学习记忆能力。条件性恐惧实验结果显示小鼠海马-杏仁核依赖的恐惧记忆能力。在Contextual 阶段与Cued 阶段,cDKO + TXBSF 组的僵直时间百分比PS cDKO 组明显增高且,说明TXBSF 可以改善小鼠的对恐惧性时间的记忆能力有改善作用。关于TXBSF 能改善AD 小鼠学习记忆相关的行为学能力的原因,我们推测是因为其调节了小鼠脑组织中某些反映神经元或突触功能相关蛋白的表达水平;并根据以前研究报道,PS cDKO小鼠脑内神经炎症反应明显,我们进一步推测TXBSF 可能通过抑制PS cDKO 小鼠的神经炎症反应改善神经元突触功能。相关文献显示,促炎症因子iNOS 可引起NO 自由基的合成,并形成可损伤细胞膜的过氧亚硝酸盐,导致细胞DNA 碱基损伤,细胞死亡[9]。而COX-2 在体内炎性环境下被诱导表达,广泛参与体内的炎症反应[10]。iNOS 和COX-2 引起的炎症能间接性地对海马神经元产生损伤。炎症反应激活的小胶质细胞和星形胶质细胞可能会引起信号通路的改变,导致神经元变性[11]。更有研究证实注射COX-2 抑制剂可显着减少海马中的神经炎症,提示外周炎症会触发COX-2 依赖性机制,诱导CNS 神经炎症[12]。我们对小鼠海马组织中iNOS 和COX-2 蛋白表达采用Western blot 进行检测,检测后发现,TXBSF 可以降低PS cDKO 小鼠海马组织中iNOS 和COX-2 表达,以及明显抑制海马CA3 区小胶质细胞的激活,故表明TXBSF 可起到抑制神经炎症反应的作用,以减少海马体内神经元的损伤,改善小鼠的记忆能力。此外TXBSF 提高PS cDKO 小鼠海马组织中反映突触功能的MAP2和PSD95的蛋白表达。相关研究显示,MAP2水平降低,将导致微管解聚,影响轴浆运输,造成神经元变性[13,14]。而PSD95 蛋白作为突触前后的主要标志物,在突触的形成和神经发育过程中起着基本支架蛋白的作用,其表达含量升高意味着神经元突触的功能得到改善[15-17]。故根据以上实验结果可知,TXBSF 可能通过抑制PS cDKO 小鼠神经炎症反应并改善神经元和突触损伤,从而改善PS cDKO 小鼠的学习记忆能力障碍。
4 结论
中药方剂TXBSF 能有效改善PS cDKO AD 模型小鼠的空间和联合学习记忆能力。TXBSF改善PS cDKO小鼠记忆障碍的作用可能是通过降低海马神经炎症反应并改善神经元突触功能而实现的。
