麋鹿角调控慢性压力应激小鼠神经营养因子和压力应激因子抗抑郁作用研究*
2019-01-18刘梦秋曲苏晨钱大玮段金廒
刘梦秋,曹 程,曲苏晨,钱大玮,段金廒,朱 悦,赵 明
(南京中医药大学药学院 江苏省方剂研究重点实验室/江苏省方剂高技术研究重点实验室/中药资源产业化于方剂创新药物国家地方地方联合工程研究中心/江苏省中药资源产业化过程协同创新中心 南京 210029)
麋鹿角是哺乳纲偶蹄目鹿科麋鹿属麋鹿(Elaphurus davidianusMillne-Edwards)成年的骨化角。其药用记载首见于南朝宋陶弘景《名医别录》,云“治痺,止血,益气力”。《中华本草》记载,麋鹿角功可“温肾壮阳,填精补髓,强筋骨,益血脉”主治“肾阳不足,虚劳精亏,腰膝酸软,筋骨疼痛,血虚证”[1]。但是这一珍贵的动物药材却因麋鹿在中国的灭绝而绝迹于药用。自1986年世界自然基金会赠送给中国政府39头麋鹿,放养于江苏大丰麋鹿国家级自然保护区以来。截至2018 年,中国麋鹿种群数量已逾6600 头,增长了近70倍,并已形成江苏大丰、湖北石首、洞庭湖和江苏盐城4 个野生麋鹿种群及其他零星群体,为其重新进行资源化利用提供了可能。
古籍中多有麋鹿角用于情志疾病的治疗记载。唐代孙思邈《备急千金要方》载“麋角丸”以其为君药,用以“明耳目,补心神,安脏腑”[2]。清代张璐《张氏医通》“彭祖麋角丸”也以麋角为君药,伍用他药,“培理身心”[3]。其用治病症“四肢无力,疲惫不能支持”的症状描述与抑郁症病人乏力的描述多有吻合。因此,我们拟对麋鹿角的抗抑郁效用进行评价,并对其调控神经营养因子和压力因子抗抑郁的效用和机制进行研究,为充分挖掘麋鹿角的药用价值,恢复其药用地位提供更丰富的现代科学依据。
1 材料
1.1 动物
ICR 小鼠(雄性,20-22 g),购自上海西普尔-必凯实验室动物有限公司,许可证号SCXK(沪)2013-0016。动物饲养于SPF 环境中,常规饲养,温度22-25℃,湿度40%-70%。
1.2 药物
麋鹿角(批号20160324),采集于江苏省大丰麋鹿自然保护区,经段金廒教授鉴定为合格药材。
1.3 试剂
Mouse NGF ELISA kit(CSB-E04684m)与Mouse BDNF ELISA kit(CSB-E04505m)购自武汉华美生物有限公司。小鼠促肾上腺皮质激素释放因子(CRF)ELISA 试剂盒(JEB-12972)、小鼠促肾上腺皮质激素(ACTH)ELISA 试剂盒(JEB-12678)、小鼠 皮 质醇(Cortisol)ELISA 试剂盒(JEB-12636)购自南京金益柏生物科技有限公司。TRIzol RNA 提取试剂盒(15596-026)购自美国Thermo Fisher 公司。RT-PCR 反转录试剂盒(Easyscript One-Step gDNA Removal and cDNA Synthesis SuperMix,AE311)和SYBR 荧光定量试剂盒(TransStart Top Green qPCR SuperMix,AQ132)均购自北京全式金生物科技有限公司。实验所用抗体
Phospho-p44/42 MAPK Rabbit mAb(9102S),p44/42 MAPK Rabbit mAb(9101S),Anti-rabbit IgG, HRPlinked Antibody(7074S)购自CST公司。
DMEM 培养基(4.5g·L-1D-Glucose,06-1055-57-1ACS)、胎牛血清(04-001-1A)、胰酶(0.25%,03-050-1A)、PBS(02-024-1ACS)和青霉素/链霉素(03-031-1B)购自以色列BI公司。细胞培养耗材均购自Corning公司。
其余所有试剂除了特别标明外,均购自美国Sigma-Aldrich公司。
1.4 仪器
动物行为测试系统(上海吉量软件公司);qPCR仪(ABI7500,Life);凝胶成像系统(Bio-Rad);细胞恒温培养箱(1300 series A2, Thermo Fisher Scientific 公司);多功能酶标仪(Enspire,Perkin-Elmer公司)。
2 方法
2.1 麋鹿角提取物的制备
麋鹿角切断、打粉,称取100 g药材,采用8倍量的溶剂回流提取3次,每次8 h,过滤,合并3次提取液,减压浓缩,冷冻干燥,得到麋鹿角提取物冻干粉。使用前,按需复溶。
2.2 CUMS模型建立
CUMS 模型建立采用禁食禁水、冰水游泳、束缚、湿笼、昼夜颠倒等方法综合进行[4]。在本次实验中,采取综合体重、旷场和糖水基础测试评分,选取评分相近的80 只小鼠,随机选取10 只作为正常组,每笼5 只饲养,其余70只小鼠均单笼孤养。
2.3 动物给药
待8 周抑郁表型出现后,将70 只刺激后的孤养小鼠随机分为7 组,即模型组、阳性药组、麋鹿角水提物低、高剂量组、麋鹿角醇提物低、高剂量组。正常组和模型组小鼠每天灌胃0.9%的生理盐水,阳性组给予氟西汀(7.2 mg/kg/d),各给药组按照如下剂量灌胃给药,药物剂量均按照生药量折算。麋鹿角水提物(MS)低剂量组:3 g/kg/d;麋鹿角水提物(MS)高剂量组:10 g/kg/d;麋鹿角醇提物(MC)低剂量组:3 g/kg/d;麋鹿角醇提物(MC)高剂量组:10 g/kg/d。灌胃给药10 d。
2.4 行为学检测
采用糖水偏嗜实验、悬尾实验和强迫游泳实验对小鼠抑郁样行为进行测评。具体方法均照课题组已经发表的结果进行[4]。
2.5 ELISA法测定神经营养因子和压力因子的表达
行为学测试结束后,处死小鼠,解剖获得组织,液氮迅速冷冻,粉碎。称取相应重量组织,加入10 倍体积的PBS 并加入蛋白酶抑制剂,利用NGF、BDNF、ACTH、Cort、CRF ELISA 试剂盒,测定相应因子的含量。离心取得小鼠血清后,按照ACTH、Cort、CRF ELISA 试剂盒的实验步骤,测定相应压力因子含量。试剂盒检测范围为10-500 pg·mL-1。
2.6 细胞培养
大鼠胶质瘤细胞系(C6):培养基为DMEM(0.45%葡萄糖)+10%胎牛血清+1%青霉素/链霉素,每48h 换液1 次,复苏后待细胞密度为70%即可进行传代,传3代稳定后的细胞用于种板和药物实验
小鼠海马永生化细胞系(HT22):培养基为DMEM(0.45%葡萄糖)+10%胎牛血清+1%青霉素/链霉素(P/S),每48h 换液1 次,复苏后待细胞密度为70%即可传代,传3代稳定后的细胞用于种板和药物药物实验。
2.7 实时定量荧光PCR 法测定神经营养因子转录水平表达
取解剖所得小鼠海马组织或细胞样品,实验步骤按照RNA 提取,cDNA 制备以及qPCR 实验进行。按TRIzol 总RNA 提取试剂盒所述步骤进行总RNA 的提取,提取的总RNA 可保存于-80°C 中。取1 μg RNA,按照Transgen 逆转录试剂盒所述步骤,将mRNA 逆转录成cDNA。然后依照Transgen qTOP MIX 荧光实时定量试剂盒所述步骤,利用荧光实时定量PCR 仪测定神经营养因子的基因转录水平表达。所用引物序列见表1。基因的表达量用2-△△Ct计算,设置GAPDH 为内参基因。以正常组对照组样本为对照样本,设为100%,计算其余各组的基因表达差异。
2.8 免疫蛋白印迹法
细胞末次给药24 h 后,采用RIPA 蛋白裂解液提取细胞总蛋白,按照BCA 试剂盒的方法测定总蛋白浓度,98℃,5 min 高温变性。按照Western Blotting 法的实验步骤,制备7.5%的聚丙烯酰胺凝胶,上样后90 V电泳2 h,300 mA 转膜2 h,5% BSA 封闭,孵育一抗(Phospho-p44/42 MAPK Rabbit mAb(9102S),p44/42 MAPK Rabbit mAb(9101S),购自CST 公司,抗体比例1∶3000)。4 ℃过夜,孵育二抗(Anti-rabbit IgG,HRPlinked Antibody,购自CST 公司,抗体比例1∶5000),显色。
2.9 MTT法检测HT22细胞的存活率
细胞末次给药后,加入MTT 溶液(终浓度为500 ug·mL-1),37 ℃避光孵育3 h,弃去MTT溶液,每孔中加入150 μL DMSO 后,37 ℃避光孵育30 min。采用多功能酶标仪检测570 nm的吸光度。

表1 实验所用引物序列
2.10 统计学处理与数据表示
采用SPSS 19. 0 统计软件进行统计分析,组间比较采用单因素方差分析(One-way ANOVA),数据以P<0.05为有差异,以P<0.01有极显著差异。
3 结果
3.1 麋鹿角提取物抗抑郁效用评价
小鼠给以麋鹿角水提物与醇提物10 d 后,进行糖水偏嗜实验、强迫游泳实验和悬尾实验。统计行为学的测试结果发现,模型组与空白组相比,其糖水偏嗜率显著降低(P<0.01),强迫游泳不动时间与悬尾不动时间显著增加(P<0.01);给药组与模型组相比,麋鹿角各提取物具有上调模型动物糖水偏嗜率和下调其强迫游泳、悬尾不动时间的作用。在麋鹿角提取物各给药组中,以麋鹿角水提物的效用最强,其作用趋势与阳性药氟西汀相当(图1)。
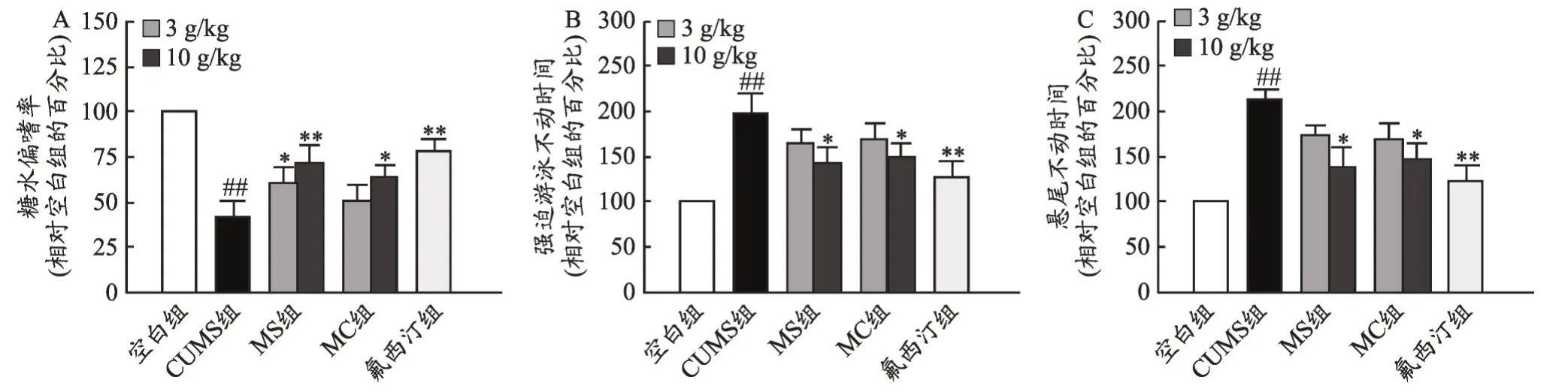
图1 麋鹿角提取物抗抑郁行为学评价
3.2 麋鹿角提取物对小鼠海马组织中神经营养因子表达的影响
行为学测试结束后,分离受试小鼠的海马组织,采用ELISA法检测海马中NGF和BDNF的含量。实验结果表明,模型动物海马区NGF 和BDNF 的水平较空白组显著下调(P<0.05),麋鹿角水提物显著上调了模型动物海马区中NGF 和BDNF 的表达(与模型组相比,P<0.05),以麋鹿角水提物高剂量组的作用趋势最强(图2)。
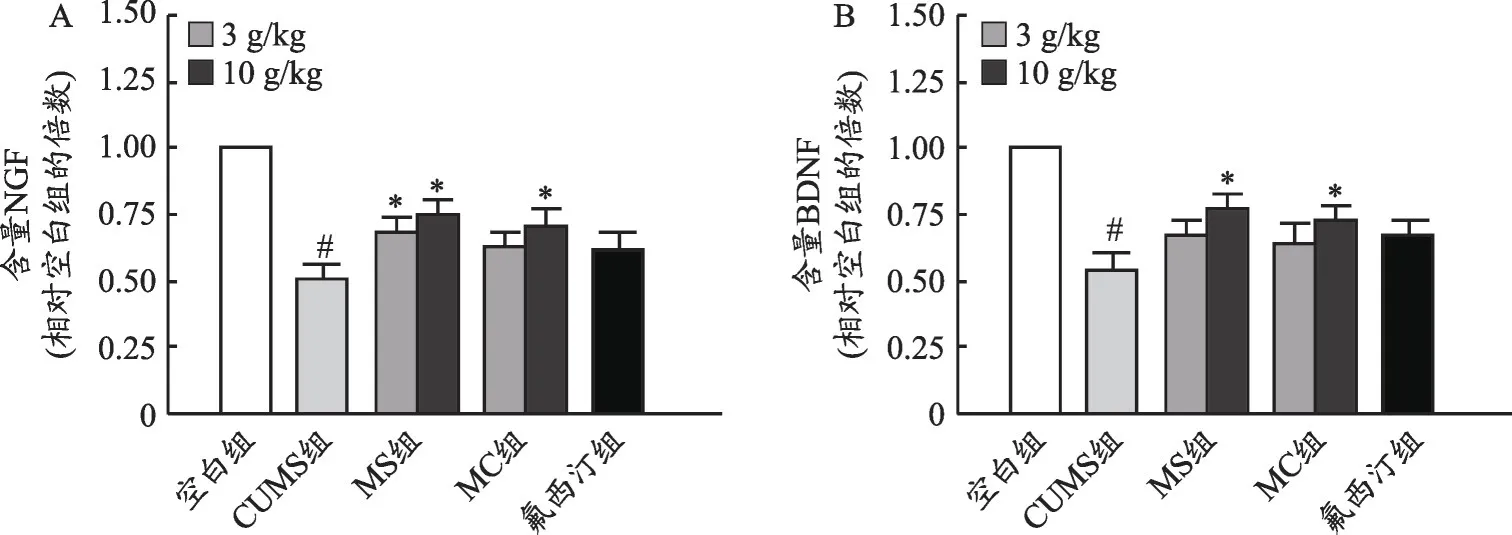
图2 麋鹿角提取物对CUMS小鼠海马区神经营养因子表达的影响
3.3 麋鹿角提取物对大鼠胶质瘤C6 细胞中NGF 和BDNF表达的影响
为了进一步探索麋鹿角提取物促进神经营养因子表达的作用机制,我们采用大鼠星形胶质细胞瘤C6细胞系建立体外神经营养因子表达模型。各提取物冻干粉按照低、中、高3个浓度(1-10 μg·mL-1)加至C6细胞系作用48 h 后,采用qPCR 法检测NGF 和BDNF的mRNA 表达情况。结果表明,与空白组相比,麋鹿角水提物和醇提物均显著上调了神经营养因子NGF和BDNF 的mRNA 表达(与空白组相比,P<0.05),其作用趋势与阳性药TPA 相当。各组中,以麋鹿角水提物高浓度组(10 μg·mL-1)促NGF 和BDNF mRNA 表达作用趋势最强(图3)。
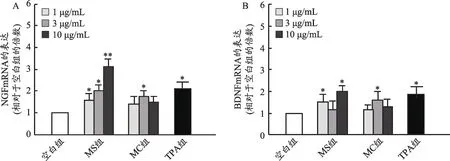
图3 麋鹿角提取物对C6细胞中神经营养因子表达的影响
依据上述实验结果,我们选取麋鹿角水提物高浓度(10 μg·mL-1)给药组,加以Erk 信号通路的阻断剂U0126,测定NGF 和BDNF 的表达,考察麋鹿角水提物促进神经营养因子表达作用信号通路。结果显示,麋鹿角水提物上调NGF和BDNF的作用趋势被U0126减弱(图4),推测麋鹿角水提物上调NGF 和BDNF 的表达的作用可能是通过激活Erk信号通路实现的。
我们进一步在C6 细胞模型中验证了麋鹿角水提物作用下的Erk 蛋白的磷酸化水平。结果表明,麋鹿角提取物上调Erk蛋白的磷酸化水平的作用可被U0126显著减弱,实验结果表明Erk 信号通路是麋鹿角水提物促进星形胶质细胞表达神经营养因子的重要通路。(图5)。
3.4 麋鹿角提取物对动物血清和组织中压力因子表达的影响
行为学测试结束后,收集受试小鼠的血清与海马组织,采用ELISA 法检测血清中压力因子CRF、ACTH、皮质醇的含量;实验结果表明,模型动物血清中压力因子的表达较空白组显著上调(P<0.05),麋鹿角提取物能够下调模型血清中压力因子的表达(P<0.05),以麋鹿角水提物的作用趋势最强(图6)。
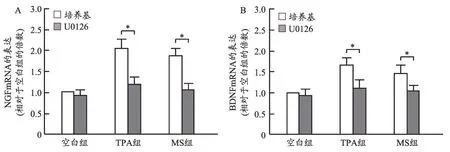
图4 麋鹿角水提物促C6细胞中神经营养因子表达的信号通路研究
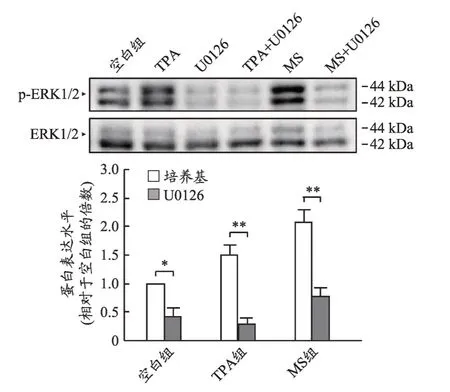
图5 麋鹿角水提物对C6细胞中Erk蛋白磷酸化水平的影响
3.5 麋鹿角提取物对Cortisol 损伤HT22 模型细胞存活率的影响
为了充分说明麋鹿角提取物基于压力应激系统的抗抑郁的效用,我们建立了Cortisol 损伤HT22 细胞模型。首先将不同浓度的Cortisol(18、37、75、150、300、600 μM)作用HT22细胞48 h后,采用MTT检测细胞存活率以选择实验条件Cortisol 的作用浓度。进而确定Cortisol 300 mM 与麋鹿角提取物同时作用HT22细胞48 h,采用MTT 法检测细胞的存活率。实验结果发现,麋鹿角水提物能上调HT22 细胞的存活率,对抗Cortisol 对于HT22 细胞的损伤(与Cortisol 组相比,P<0.05),各组中,以麋鹿角水提物高浓度(10 μg·mL-1)的细胞保护作用趋势最强(图7)。
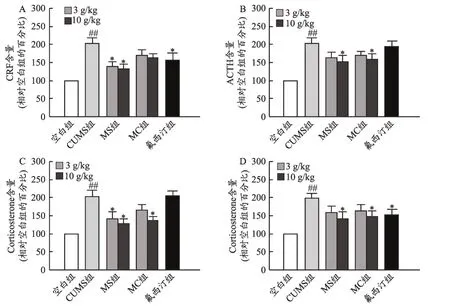
图6 麋鹿角提取物对CUMS小鼠组织和血清中压力因子表达的影响

图7 麋鹿角提取物对HT22细胞压力损伤保护作用的研究
4 讨论
抑郁症是一种以长期的心情压抑,忧愁悲伤为特征的情志疾病,其发病机理复杂,涉及神经递质、神经营养因子与下丘脑-垂体-肾上腺压力轴等多个系统的失调。而目前临床抗抑郁药物如氟西汀、文拉法辛等,其作用靶点均为单胺类神经递质,意在抑制突触前膜对神经递质的重摄取与单胺氧化酶对神经递质的降解,以提高神经递质在突触间隙的浓度,维持神经传导。但这些抗抑郁药物,至少有30%的病人无效,提示单一作用靶点的抗抑郁药物可能难以满足抑郁症这一多环节失调导致的复杂情志疾病的治疗需要[5]。中药材与中药复方因为具有多成分、多靶点、多环节起效的特征,逐渐成为抗抑郁治疗手段开发的热点[6]。
神经营养因子[7,8]与下丘脑-垂体-肾上腺轴(HPA轴)调控在抑郁症发病机理中的作用日渐得到研究者的重视。临床研究表明,抑郁症患者的血清中神经营养因子NGF 和BDNF 的表达较正常患者显著下降,BDNF 已经公认为抑郁症诊断的生物标志物。体外实验也表明,神经营养因子的缺乏将会直接导致神经元的死亡。同时持续压力应激激活HPA 轴,最终导致大量的糖皮质激素大量产生,导致神经元坏死,已被认为是抑郁症重要的发病机理[9,10]。并且研究还发现,HPA 轴激活,CRF 的大量增加还会诱导肠道菌群释放炎症因子,进入中枢,诱发中枢和外周炎症,加剧神经元坏死加剧抑郁环节。因此,神经营养因子缺乏与HPA 轴激活,严重影响了抑郁症患者神经元的正常生长与功能发挥[11]。
中医虽无抑郁症之病名,但抑郁症的核心症状如快感缺失、哭笑无常、忧思多虑等,常见于“郁证”、“癫证”、“脏躁”、“百合”等中医病证的症状描述。抑郁一证,多因七情损伤,气机失和,渐致脏腑气血阴阳失调而形成。“肾通髓海”,肾精不足导致的脑髓失养,髓海空虚导致神亏气弱,进而影响肝、脾、肺、心等诸脏腑的功能以及水液代谢和气血运行,是抑郁症发病的重要病机。因此补肾填髓是中医用治抑郁症的重要治疗手段。熟地黄、何首乌、黄精等补益肾精药也成为抑郁症的高频治疗中药。值得注意的是,下丘脑-垂体-肾上腺轴(HPA 轴)压力应激系统中,肾上腺是重要的调节脏器,更与中医“肾通髓海”的传统认识不谋而合。
本草记载麋鹿角具有显著的温补肾阳、益精填髓的作用。据报道,在氢化可的松阳虚大鼠模型上,麋鹿角可纠正下丘脑-垂体-靶腺轴(肾上腺皮质轴、甲状腺轴、性腺轴)的功能紊乱状态,在雄性小鼠房劳肾阳虚模型上,麋鹿角可显著提高精子密度、精子活率、精子存活率,降低精子畸形率均可改善相应指标[12,13]。这些现代研究均佐证了麋鹿角“温补肾阳、益精填髓”传统功效的本草记载。同时,亦有报道,在D-半乳糖致亚急性衰老模型小鼠衰老模型上,麋鹿角能显著提高模型小鼠肝脏、肾脏以及脑组织内的抗氧化酶活性,抑制脑组织内MAO 活性,显示出较好的抗亚急性衰老作用,并能增强衰老小鼠学习与记忆的能力[14,15]。在本研究中,我们亦发现,麋鹿角具有显著的减轻动物抑郁样行为的作用,且对神经营养因子与HPA 压力应激轴具有较好的调控作用。
为了初步探索其抗抑郁的物质基础,我们分别制备了麋鹿角的水提物与醇提物。在整体动物水平上,两者均具有减轻动物抑郁样行为,调控神经营养因子与HPA 压力应激轴的作用,效用并无显著性差异。而在神经营养因子的主要供体胶质细胞上,水提物促神经营养因子表达的作用显著优于醇提物。在压力因子致神经元细胞损伤模型上,水提物的神经保护作用也显著优于醇提物。提示水提物与醇提物的作用机理有所不同。尤其值得注意的是,前期研究发现,麋鹿角水提物中含有大量水溶性肽类,具有显著生物活性,可能是麋鹿角重要的活性物质基础[16]。因此,我们将深入研究麋鹿角抗抑郁效用的大分子物质,以期为这一宝贵动物药材的资源化利用提供更多的现代科学依据。
