基于高效液相色谱法指纹图谱技术的不同产地、不同生长方式喜马拉雅紫茉莉品质分析*
2019-01-18邵远洋俞越童曹光昭邹慧琴闫永红
邵远洋,彭 莲,俞越童,曹光昭,邹慧琴**,闫永红**
(1. 北京中医药大学中药学院 北京 100102;2. 中山大学附属第三医院 广州 510630)
喜马拉雅紫茉莉(Mirabilis himalaica(Edgew.)Heim.)始载于藏医药学《月王药诊》,分布于我国西藏、甘肃和青海等地区;《中国植物志》描述喜马拉雅紫茉莉属于山紫茉莉,为1年或多年生草本;其入药部位是干燥的根,有温胃、暖肾、生肌、排石、利尿等功效,可用于治疗腰、下腹、关节痛及下半身寒等症[1];藏医记载,喜马拉雅紫茉莉是藏药五根药的上品[2,3],其在藏医药的应用中历史悠久。
高效液相色谱技术具有灵敏度高、效率高等优点,主要应用于大多数的非挥发、热不稳定的化合物的研究,在民族药的研究中是应用最广泛的技术之一[4,5]。中药指纹图谱:中药材经适当处理后,采用一定的分析手段,得到的能够标示该中药材特性的共有峰的图谱[6]。HPLC 指纹图谱可以实现中药材的定性、定量评价,协助完成药材的产地、物种的判别[7,8]。胡春月等运用HPLC 指纹图谱技术对禹州漏芦正丁醇部位进行研究,为禹州漏芦保肝活性的研究及临床应用提供一定的参考[9];李娴等对熟地黄制炭前后的化学成分进行HPLC 指纹图谱的研究[10];郑孟凯等运用HPLC 指纹图谱技术客观、有效的评价了不同产区的市售麻黄的质量[11];杨秀娟等运用HPLC 指纹图谱技术研究甘肃不同产区的红芪[12],为甘肃产区红芪的质量评价及产地鉴别提供了有价值的参考;宁德生等[13]运用HPLC 指纹图谱对地枫皮进行相关研究,完善了地枫皮真伪的鉴别及质量的控制标准;闫伟伟等[14]运用HPLC 指纹图谱技术对不同产地的杏花进行质量评价,发现不同产地的杏花质量存在差异。HPLC 指纹图谱技术在研究中药化学成分中具有整体性和唯一性的特征,在中药种类、产地以及真伪的鉴别过程中广泛应用,随着现代分析手段的不断发展,HPLC 指纹图谱技术将在中药品质评价以及质量标准完善方面发挥重要作用。
喜马拉雅紫茉莉主要分布于我国西藏、甘肃和青海等地区,随着人们对喜马拉雅紫茉莉的不断采挖,其野生资源日趋枯竭。2006 年,旦智草等[15]首次完成了对喜马拉雅紫茉莉人工驯化栽培试验。近年来,关于喜马拉雅紫茉莉的栽培技术逐步成熟,但是关于不同产区及不同生长方式的喜马拉雅紫茉莉的质量的研究少见报道,评价其质量的实践工作中更是无标准可依。中药指纹图谱在阐释中药复杂成分与其质量关系的过程中扮演着重要的角色,在阐释过程中,相似度评价发挥着关键性的作用。本研究运用HPLC 指纹图谱技术并结合相似度评价、主成分分析等手段,对不同产区、不同生长方式喜马拉雅紫茉莉的质量进行研究,为全面系统的分析喜马拉雅紫茉莉的品质提供科学依据。
1 材料
1.1 仪器
岛津液相LC-20A(岛津企业管理(中国)有限公司),四元泵,DAD 检测器,自动进样器;ZORBAX Extend-C18 色谱柱(4.6 × 250 mm,5 μm);0.45 μm 针筒式微孔滤膜过滤器;BP 211D 型电子天平(十万分之一,德国赛多利斯);KQ-500DE 型数控超声波清洗器(500 W,40 KHz,昆山市超声仪器有限公司)。
1.2 试药
收集甘肃、西藏、拉萨不同产区的喜马拉雅紫茉莉,经北京中医药大学闫永红教授鉴定为喜马拉雅紫茉莉(Mirabilis himalaica(Edgew.) Heim.)干燥根(表1)。色谱纯乙腈、分析纯甲醇、Mirabijalone A、Boeravinone C、 Mirabijalone I、 Mirabijalone H、Abronione 和Boeravinone F均为实验室自制。
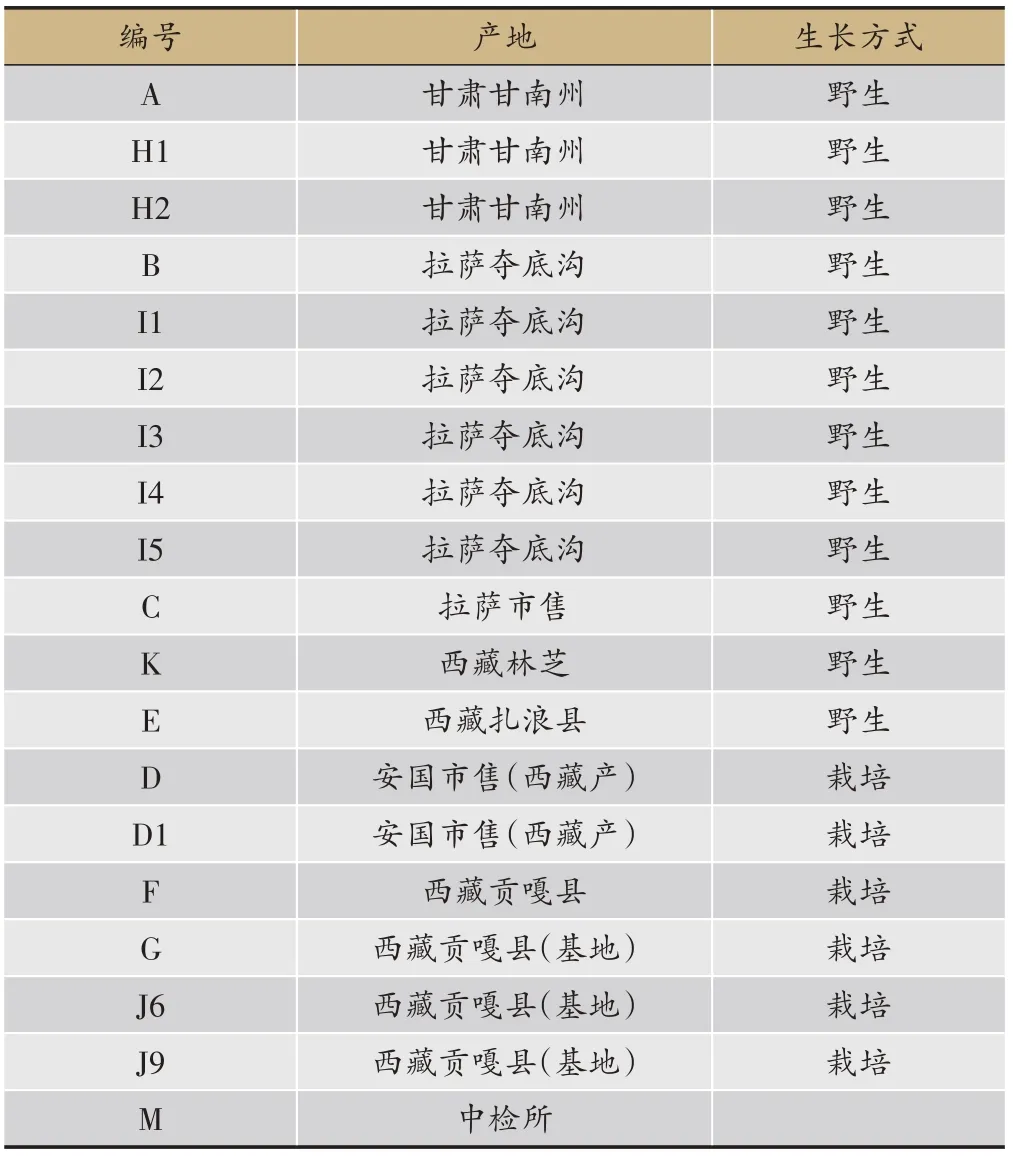
表1 不同产区、不同生长方式的喜马拉雅紫茉莉样品信息表
2 方法与结果
2.1 供试液提取溶剂的选择
提取溶剂在一定程度上影响着有效成分峰的数目、峰形的好坏以及基线是否平稳。同一条件下,平行精密称取同一批次喜马拉雅紫茉莉根干燥粉末0.500 g 置于50 mL三角瓶中,依次加入10 mL甲醇、乙醇和乙酸乙酯,同样条件下,超声提取40 min,静置至室温,过滤并补足溶剂至10 mL,混匀后,0.45 μm 有机滤膜过滤1 mL 至液相小瓶,获取续滤液,进行HPLC检测。结果表明,选择甲醇作为提取溶剂时,有效成分峰数目多、峰形好且基线平稳,因此本研究选择甲醇作为提取溶剂(图1a)。
2.2 洗脱条件的选择
洗脱条件在成分峰分离、拖尾、重叠及基线平稳方面发挥着重要的作用。本研究选取乙腈(B),水(A)为流动相,其余条件均保持一致,在系统1、2、3、4条件下进行梯度洗脱。系统1:(0-20 min,5%-30%B;20-40 min,30%-80%B;40-50 min,80-95%B)系统2:(0-5 min,5%-5%B;5-15 min,5%-20%B;15-40 min,20%-95%B)系统3:(0-10 min,5%-30%B;10-40 min,30%-80%B;40-42 min,80%-95%B)系 统4:(0-10 min,5%-20%B;10-40 min,20%-80%B;40-42 min,80%-95%B)。结果显示,系统4 条件下,喜马拉雅紫茉莉有效成分间分离良好,没有出现拖尾及重叠现象,并且基线平稳。故选择系统4 作为洗脱条件(图1b)。
2.3 检测波长的选择
检测波长在一定程度上影响有效成分峰数目的多少、分离效果的好坏及基线是否平稳。保持其他条件相同,选择在200-400 nm范围内对喜马拉雅紫茉莉特征化学成分进行扫描。波长为280 nm 时,化学成分出峰数目多,分离效果明显,基线平稳,因此选择280 nm作为喜马拉雅紫茉莉HPLC 指纹图谱的检测波长(图1c)。

图1 HPLC指纹图谱
2.4 进样量的选择
进样量的多少往往会对精密度、准确度、有效成分峰数目、基线波动情况、拖尾及重叠产生影响。保持其余因素不变,控制进样量15 μL、20 μL、25 μL,筛选最佳进样量。进样量为20 μL 时,精确度、准确度高、有效成分峰数目多、基线较平稳、拖尾及重叠少(图1d)。因此选择20 μL 作为喜马拉雅紫茉莉HPLC指纹图谱的进样量。
2.5 柱温的选择
峰形的好坏、基线是否平稳在一定程度上取决柱温的高低,本研究选取20℃、25℃、30℃的柱温,其余条件保持一致,筛选最适柱温。结果显示,柱温为25℃时,各个成分峰形最好,基线最平稳(图1e)。因此选择25℃作为喜马拉雅紫茉莉HPLC指纹图谱的柱温。
2.6 方法组学考察
2.6.1 精密度试验
精确称取B 样品0.500 g,按照筛选的最适条件制备供试品溶液,在同一色谱条件下,进样20 μL,连续平行进样6 次,记录各个色谱峰的保留时间和峰面积以及各个峰形之间的相对标准偏差(RSD)。结果显示,共有峰相对保留时间的RSD为0.0713%-0.2225%,相对峰面积的RSD为0.289%-1.124%,该条件下精密度良好。
2.6.2 重复性考察
精密称取喜马拉雅紫茉莉B 样品,每份0.500 g,按照6.1 方法制备供试品溶液,对成分峰的峰面积及保留时间的一致性进行考察。结果表明,共有峰相对保留时间的RSD为0.199 4%-0.260 3%,相对峰面积的RSD为0.095 8%-1.3720%,该条件下重复性良好。
2.6.3 稳定性考察
精密称取喜马拉雅紫茉莉B 样品0.500 g,按照同样的方法制备样品,在0 h,4 h,8 h,16 h,24 h,36 h 依次检测供试品溶液。结果显示,共有峰相对保留时间的RSD为0.074 2%-0.1350%,相对峰面积的RSD为0.0709%-1.8970%,表明样品在36 h内稳定。
2.7 指纹图谱建立及技术参数
2.7.1 喜马拉雅紫茉莉指纹图谱的建立
按照上述最适条件分析所搜集的19 批喜马拉雅紫茉莉药材,获得19 批喜马拉雅紫茉莉药材的HPLC指纹图谱(图2)。将19 批喜马拉雅紫茉莉药材的HPLC 数据导入“中药色谱指纹图谱相似度评价系统(2004)A 版”进行药材对照指纹图谱及共有模式的生成,共确定9个共有成分。
2.7.2 特征指纹峰的标定
分析19 批喜马拉雅紫茉莉HPLC 检测结果,依据保留时间对特征峰进行标定,结果显示在19批喜马拉雅紫茉莉HPLC 色谱结果中存在9 个共有峰(图3)。核对对照品,确定4 号峰是Boeravinone C,5 号峰是Boeravinone F,6 号峰是Mirabijalone A,7 号峰是Mirabijalone I,8 号峰是 Abronione,9 号峰是Mirabijalone H,其中,9 个化合物的保留时间及峰面积(表2,表3)。
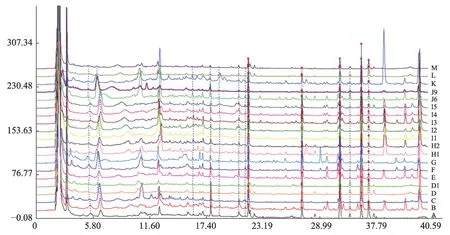
图2 19 批喜马拉雅紫茉莉HPLC指纹图谱
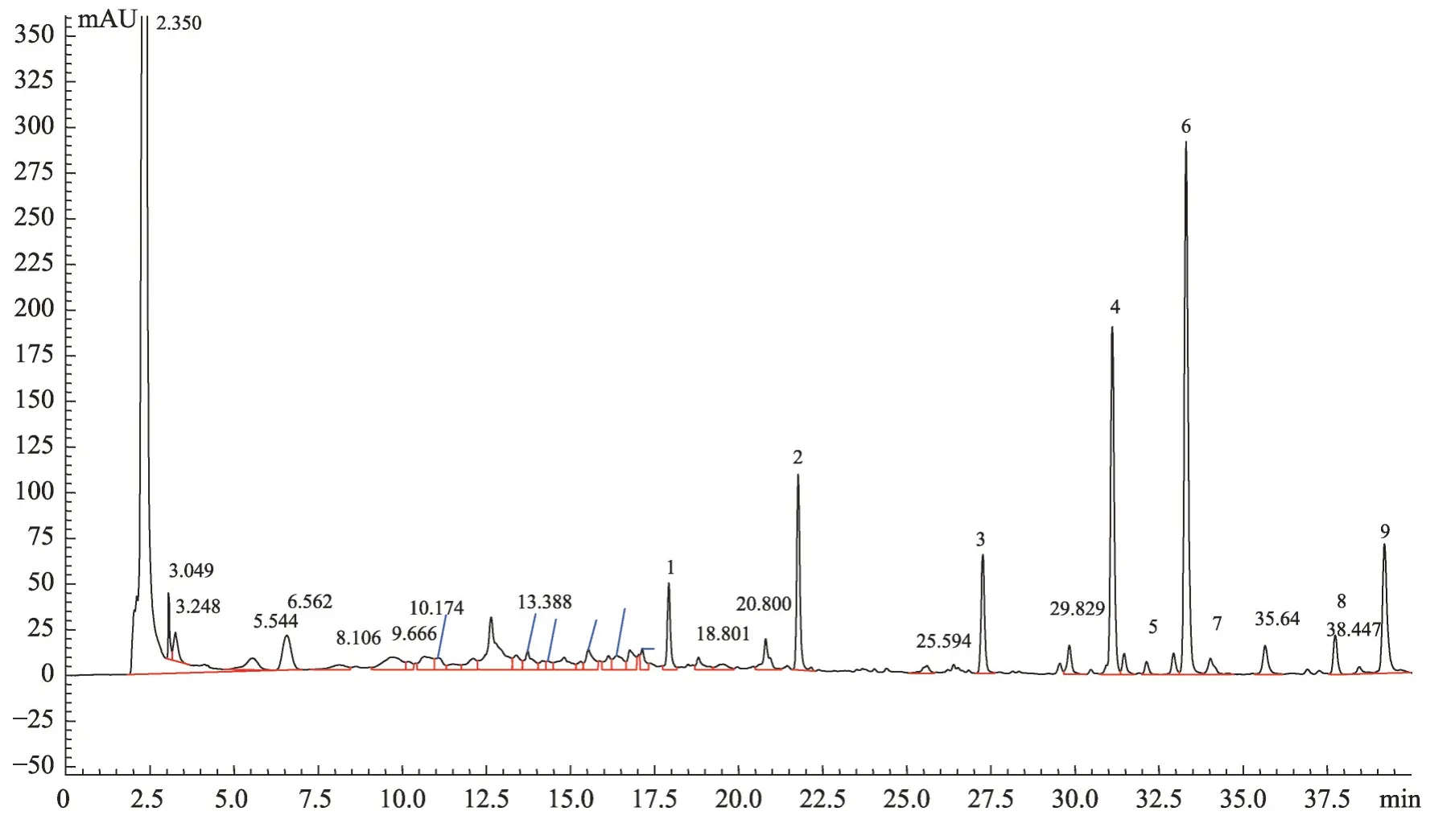
图3 喜马拉雅紫茉莉对照指纹图谱
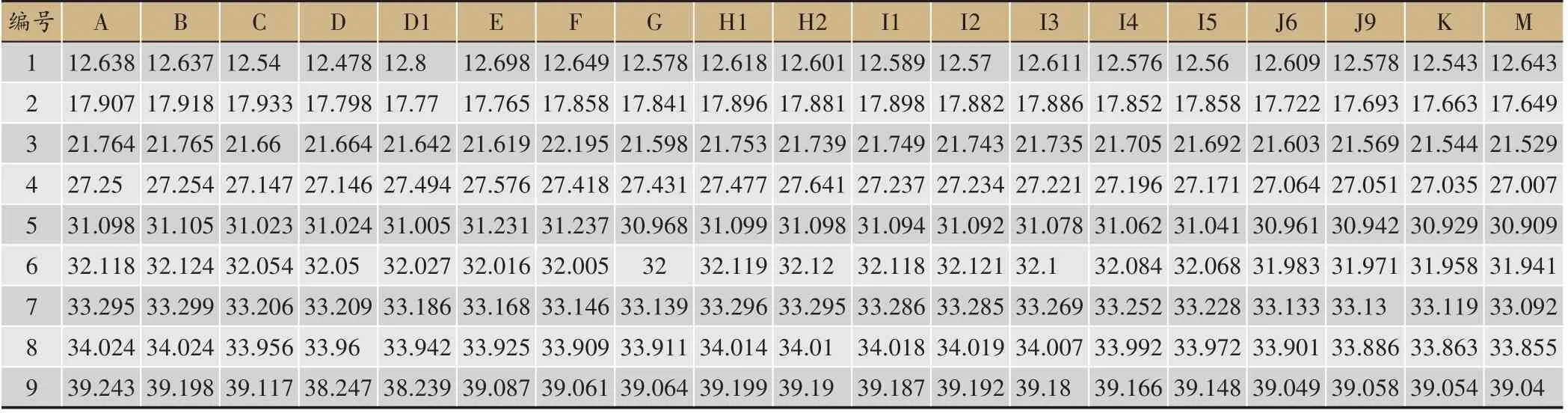
表2 19批喜马拉雅紫茉莉样品共有峰保留时间
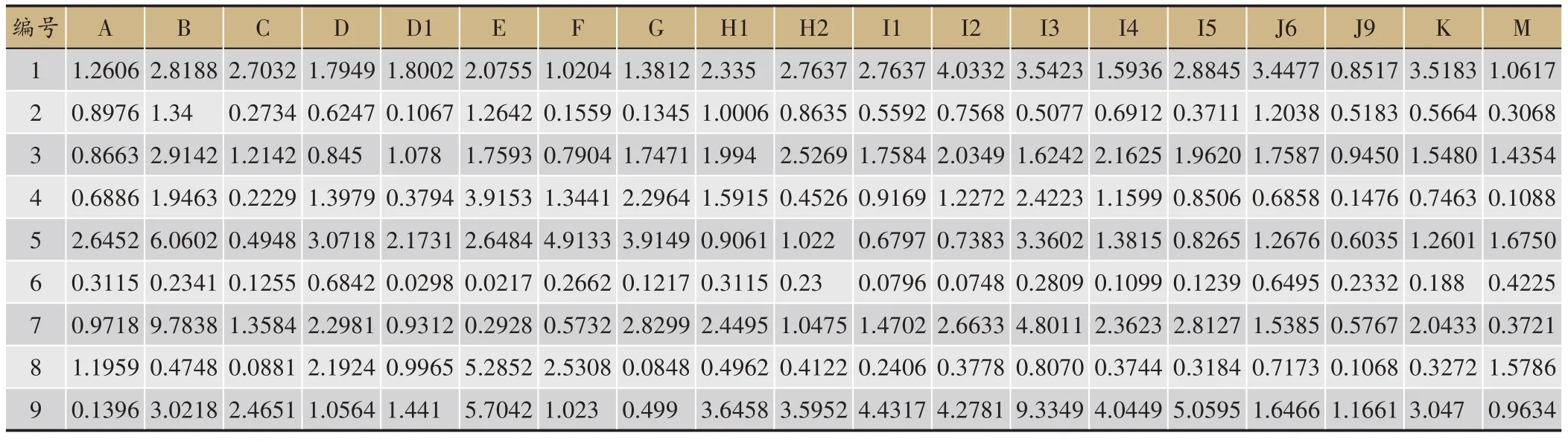
表3 19批喜马拉雅紫茉莉样品共有峰保留面积
2.7.3 喜马拉雅紫茉莉指纹图谱相似度评价
通过HPLC 指纹图谱可获取样品的整体信息,分析对比图谱,得到不同样品间的相似度[16,17]。借助于该技术可完成对指纹图谱全面、客观的评价。运用国家药典委员会2004年颁布的“中药色谱指纹图谱相似度评价系统A 版”,对19 批喜马拉雅紫茉莉指纹图谱相似度进行评价。结果显示,有17个样本的相似度在0.90 以上,该结果表明,不同产地、不同生长方式的指纹图谱也具有非常高的相似度(表4)。
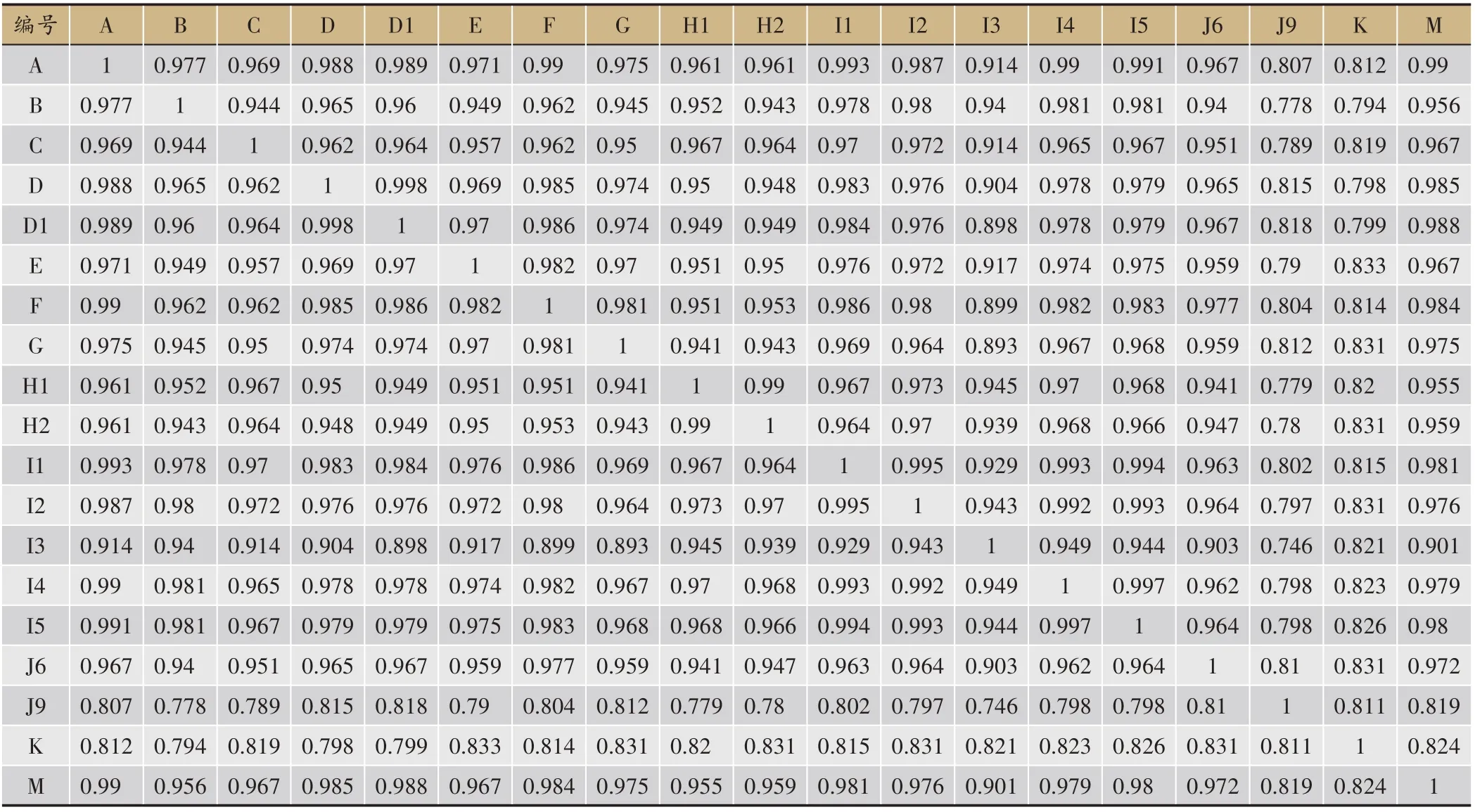
表4 19 批喜马拉雅紫茉莉相似度计算表
2.8 喜马拉雅紫茉莉指纹图谱的主成分分析(PCA)
为了进一步分析不同产区、不同生长方式的喜马拉雅紫茉莉品质差异,本研究对19批喜马拉雅紫茉莉HPLC 指纹图谱共有成分的相对含量进行PCA 分析(图4)。结果显示,在PCA图中,19批喜马拉雅紫茉莉的野生品和栽培品分布于图的左右两侧。该结果表明,喜马拉雅紫茉莉的特征性成分的差异与其生长方式存在一定的相关性。
3 讨论
本研究在喜马拉雅紫茉莉HPLC 指纹图谱建立的过程中,对提取溶剂、洗脱条件、检测波长、进样量、柱温均做了筛选,综合特征峰的数目、形状、特征峰之间的分离效果、基线的平稳性、准确度、精密度以及拖尾、重叠等因素,最终筛选得到提取溶剂甲醇,系统4,检测波长280 nm,进样量20 μL,柱温25℃。该条件下喜马拉雅紫茉莉中特征性成分,分离好,稳定性和重现性强。
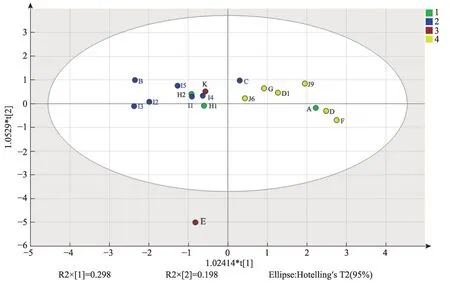
图4 19批喜马拉雅紫茉莉特征性成分的PCA分析
本研究基于HPLC 指纹图谱并结合相似度分析软件和主成分分析方法,明确了喜马拉雅紫茉莉指纹图谱的特征,归属了HPLC 指纹图谱中的主要指纹峰。分析表明,不同产区、不同生长方式的喜马拉雅紫茉莉共有峰相似度较高,不同生长方式的喜马拉雅紫茉莉特征性成分含量差异明显。
应用HPLC 指纹图谱能够实现中药较为全面、综合的质量控制和质量评价,本研究建立了不同产地、不同生长方式的喜马拉雅紫茉莉特征HPLC 指纹图谱,在一定程度上弥补了喜马拉雅紫茉莉品质评价的不足,完善了该药的质量评价标准,为该药的更全面、综合的质量控制和品质评价提供重要参考。
