FOXM1在SAP/ALI小鼠肺组织修复过程中的变化及其意义*
2018-12-21凌洪张晶晶卿国忠涂书玎钟警
凌洪,张晶晶,卿国忠,涂书玎,钟警
(南华大学附属第一医院 急诊外科,湖南 衡阳 421001)
急性肺损伤(acute lung injury, ALI)是重症急性胰腺炎(severe acute pancreatitis, SAP)最常见的并发症[1],且肺气血屏障通透性增加在SAP/ALI病理机制中扮演了关键角色[2]。有研究表明,叉头框蛋白M1(forkhead box M1, FOXM1)在肺损伤时可被激活,促进肺微血管内皮细胞增殖,降低屏障通透性[3]。然而也有研究提示,FOXM1的异常上调,可使DNA复制失控,出现恶变[4]。那么,SAP/ALI发生后,FOXM1的表达情况如何?目前尚不清楚。本研究旨在探讨SAP/ALI小鼠肺损伤修复过程中FOXM1的表达变化及其意义。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康无特定病原体级BALB/c小鼠,雄性,月龄2~3个月,体重(26.0±2.0)g,由南华大学动物实验中心提供并饲养,动物合格证号:SYXK(湘)2016-0009。饲养环境温度(25.0±0.5)℃,相对湿度为50%,自由饮食进水,昼夜光照节律。适应性饲养1周后开始实验,实验前12 h禁食,自由饮水。所有实验过程严格遵循中华人民共和国科学技术部《“关于善待实验动物的指导性意见”》中有关伦理学的规定。
1.1.2 主要试剂 雨蛙肽(美国Sigma公司),HE染色试剂盒、0.5%伊文斯蓝(evans blue, EB)、去离子甲酰胺溶液购自北京索莱宝生物科技有限公司,增强型RIPA裂解液、BCA蛋白定量试剂盒、凝胶制备试剂盒购自武汉博士德生物工程有限公司,兔抗FOXM1多克隆抗体、兔抗GAPDH多克隆抗体购自美国Abcam公司,HRP-conjugated Affinipure Goat Anti-Rabbit IgG(H+L)(美国Proteintech公司),Trizol Reagent(美国Life Technologies公司),Thermo Scientific Revert Aid First Strand cDNA Synthesis Kit(美国 Thermo Scientific公司),SYBR® Premix Ex TaqTM(Tli RNaseH Plius)(日本TaKaRa公司)。各引物由上海生工生物工程股份有限公司合成。
1.1.3 主要仪器 全自动生化分析仪(美国Rayto公司),生物组织自动脱水机(孝感亚光医用电子技术公司),石蜡包埋机、石蜡切片机购自德国Leica公司,荧光显微镜(日本Olympus公司),台式高速冷冻离心机(德国Hermle公司),多功能酶标仪(美国Thermo Scientific公司),实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction, qRTPCR)仪(德国艾本德公司),电泳仪、转膜仪、PCR扩增仪、化学发光凝胶成像系统购自美国Bio-Rad公司,核酸蛋白浓度测定仪(英国Bio-Drop公司),恒温干燥箱(上海福码实验设备有限公司),精密电子天平(日本岛津公司)。
1.2 方法
1.2.1 动物模型的复制与分组 将BALB/c小鼠按照随机数字表随机分为假手术组(10只)和模型组(50只),模型组小鼠又随机分为模型组1、3、7、10和14 d 5个亚组,每组10只。参照GERARD等[5]的方法,采用10 mg/kg雨蛙肽腹腔注射小鼠,1次/h,连续注射8次,复制SAP/ALI小鼠模型。假手术组用等体积的0.9%生理盐水腹腔注射。模型复制后死亡的动物予以随机替补。
1.2.2 标本采集 模型组分别在复制后1、3、7、10和14 d,假手术组在复制后14 d,动物处死前3 h,随机取5只小鼠,参照MUHS等[6]的方法尾静脉注射0.5% EB溶液(10 ml/kg),30 min后用10%水合氯醛(3.5 ml/kg)腹腔注射麻醉小鼠,开胸后用4℃、0.9%生理盐水将肺内血液灌洗干净。将注射EB小鼠的左肺组织用于EB含量的测定,右肺组织用于肺含水量的测定。其余5只小鼠抽取左心室动脉血,将左肺上叶和左肺下叶分离,迅速放入液氮中,分别用于qRTPCR和Western blotting检测;右肺组织放入4%多聚甲醛中固定,用于HE染色。
1.2.3 HE染色与病理学评分 将固定好的肺组织送至南华大学附属第一医院病理科,进行脱水、透明、浸蜡、包埋,4μm厚连续冠状切片,烤片后常规脱蜡至水化,行HE染色,脱水至透明,中性树胶封片后在光学显微镜下观察。肺组织的病理学评分标准参照HOFBAUER等[7]的方法,根据水肿、炎症细胞浸润和出血情况对肺组织损伤进行评分,总分9分。采用盲法由本院2位病理科医师单独评分,每只动物随机取5张切片,每张切片随机观察5个200倍视野,取其平均分作为肺组织病理学评分结果,代表相应组小鼠肺组织损伤程度。
1.2.4 血清淀粉酶、肺微血管通透性及肺组织含水量检测 将小鼠血液在4℃条件下3 000 r/min离心10min,分离血清,用全自动生化分析仪测定血清淀粉酶浓度。用滤纸吸干含有EB的肺组织表面的水分,称取肺湿重,匀浆后浸泡于去离子甲酰胺溶液中(2 ml/100 mg肺湿重),60℃孵育24 h,4℃、3 000 r/min离心10 min,取上清,用酶标仪于620 nm波长处测定上清液吸光度,根据标准曲线换算出肺组织中EB含量,结果以mg/L表示,用来代表肺微血管通透性。使用干/湿重法测定肺组织含水量。将相应肺组织称取湿重后,置于60℃恒温干燥箱中烘干,称取干重。按以下公式计算肺组织含水量:肺组织含水量(%)=(湿重-干重)/湿重×100%。
1.2.5 qRT-PCR 取液氮中的相应肺组织50~100 mg,用Trizol法提取组织总RNA,以Oligo(dT)18为引物,采用两步法将总RNA逆转录为cDNA。引物采用Primer 6.0软件设计,FOXM1正向 引 物 :5’-ACCAGAAAGGGCTTTCCTCC-3’, 反向 引 物:5’-GTTGGGCCCCACTCTACCTT-3’, 退火温度60℃,产物长度155 bp;β-actin正向引物:5’-GCAGATGTGGATCAGCAAGC-3’,反 向 引物:5’-AGGGTGTAAAACGCAGCTCAG-3’, 退 火温度62℃,产物长度102 bp。qRT-PCR反应体系为20μl:2×SYBR Green Mix 10μl,cDNA 2μl,引物对1μl,Rox 0.4μl,RNase-free water 6.6μl。采用 qRTPCR仪进行扩增,反应条件:95℃预变性2 min,95℃变性15 s,58~62℃退火1 min,共循环40次。熔解曲线反应条件:95℃15 s,60℃15 s,温度缓慢上升(20 min),95℃15 s。内参基因选用β-actin,采用2-△△Ct法计算FOXM1 mRNA相对表达量。△Ct=CtFOXM1-Ctβ-actin,△△ Ct=Ct模型组-Ct假手术组。
1.2.6 Western blotting检测 取液氮中的相应肺组织50~100 mg,用蛋白抽提试剂盒提取组织总蛋白,BCA法测定蛋白浓度,SDS-PAGE凝胶电泳90 min,浓缩胶30 V恒压30 min,分离胶60 V恒压60 min,4℃环境下300 mA恒流转膜,FOXM1转膜时间为104 min、GAPDH为56 min,5%脱脂牛奶室温封闭1h,加入相应一抗,4℃摇床孵育过夜,复温1 h,TBST快速洗涤3次,10 min/次。加入HRP标记的二抗室温孵育1 h,TBST快速洗涤3次,10 min/次。用ECL显色,化学发光系统成像观察。内参蛋白选用GAPDH。用Image J软件进行平均灰度值分析。采用2-△△Ct法计算FOXM1蛋白相对表达量。
1.3 统计学方法
数据分析采用SPSS 17.0统计软件和Graph Pad Prism 5作图软件。计量资料以均数±标准差(±s)表示,多组比较用方差分析,两两比较用SNK-q检验,相关性分析用Spearman法,P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠死亡情况
模型复制后,假手术组BALB/c小鼠未见死亡;模型组1 d死亡2只;模型组3、7、10和14 d各死亡3只。
2.2 各组小鼠肺组织病理形态学变化
假手术组小鼠肺组织结构基本正常。模型组1、3、7、10和14 d各时间点肺间质和肺泡壁均有不同程度水肿、充血及炎症细胞浸润,肺泡壁增厚,肺泡腔出现渗出液,部分肺泡结构破坏,肺组织不同程度出血,其中复制后1 d时损害最严重,然后逐渐恢复。假手术组,以及模型组1、3、7、10和14 d肺组织病理学评分分别为(0.11±0.08)、(7.22±0.34)、(5.83±0.18)、(4.18±0.24)、(3.79±0.12) 和(2.80±0.09) 分,经单因素方差分析,差异有统计学意义(F=8.675,P=0.000)。进一步两两比较经SNK-q检验,模型组各时间点肺组织病理学评分高于假手术组(P<0.05)。见图1、2。
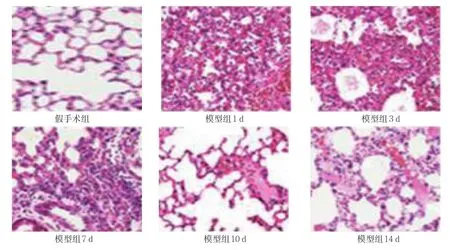
图1 各组小鼠肺组织病理切片 (HE×200)

图2 各组小鼠肺组织病理学评分比较 (±s)
2.3 各组小鼠血清淀粉酶、肺组织EB含量和含水量变化
假手术组小鼠血清中含有一定量淀粉酶,肺组织含有极少量的EB渗出和一定量的水分;各组小鼠血清淀粉酶、肺组织EB含量和含水量比较,经单因素方差分析,差异有统计学意义(P<0.05)。进一步两两比较经SNK-q检验,与假手术组比较,模型组1、3、7、10和14 d血清淀粉酶、肺组织EB含量和含水量不同程度升高(P<0.05),其中复制后1 d时血清淀粉酶、肺组织EB含量和含水量最高(P<0.05),随后不断降低(P<0.05),但复制后14 d仍未完全恢复正常(P<0.05)。见附表。
附表 各组小鼠血清淀粉酶、肺组织EB含量和含水量变化 (n =5,±s)

附表 各组小鼠血清淀粉酶、肺组织EB含量和含水量变化 (n =5,±s)
注:†与假手术组比较,P <0.05
组别 血清淀粉酶/(u/L) 肺组织E B含量/(m g/L) 肺组织含水量/%假手术组 1 3 1 4.3 8±1 8 6.5 1 0.0 9±0.0 1 6 0.5 2±2.1 1模型组1 d 1 9 8 9 4.2 1±3 2 5 4.1 3† 4.2 1±0.4 6† 8 1.3 6±1.5 3†模型组3 d 1 2 3 1 6.2 1±1 1 9 6.6 7† 3.6 5±0.2 1† 7 5.4 9±1.3 7†模型组7 d 7 8 7 9.9 8±6 8 3.5 3† 2.8 7±0.1 3† 6 8.2 8±1.4 6†模型组1 0 d 5 9 3 2.2 5±3 1 6.3 9† 1.5 4±0.0 9† 6 5.7 7±0.8 6†模型组1 4 d 4 5 1 6.1 3±2 1 1.6 8† 1.2 1±0.0 7† 6 3.0 5±0.6 1†F值 1 1.4 3 2 3.2 3 7 2.2 2 1 P值 0.0 0 0 0.0 0 1 0.0 0 3
2.4 各组小鼠FOXM1 mRNA表达水平
假手术组FOXM1 mRNA具有一定量的表达(1.00±0.09), 模 型 组 1、3、7、10和 14 d FOXM1 mRNA相对表达量分别为(0.60±0.082)、(1.24±0.11)、(2.70±0.18)、(2.01±0.19) 和(1.13±0.13),经单因素方差分析,差异有统计学意义(F=10.173,P=0.001)。进一步两两比较经SNK-q检验,与假手术组比较,模型组1 d的FOXM1 mRNA表达下调(P<0.05);与假手术组比较,模型组3 d开始FOXM1 mRNA相对表达逐渐上调(P<0.05),第7天达高峰(P<0.05),10 d时开始恢复(P<0.05),14 d时基本回到基础水平(P>0.05)。见图3。

图3 各组小鼠FOXM1 mRNA表达水平比较(n =5,±s)
2.5 各组小鼠FOXM1蛋白表达水平
假手术组FOXM1蛋白具有一定量的表达(0.30±0.02),模型组1、3、7、10和 14 d FOXM1蛋白相对表达量分别为(0.18±0.01)、(0.42±0.05)、(0.89±0.03)、(0.61±0.07) 和(0.31±0.04), 经单因素方差分析,差异有统计学意义(F=8.542,P=0.003)。进一步两两比较经SNK-q检验,与假手术组比较,模型组第1天FOXM1蛋白表达下调(P<0.05);与假手术组比较,3 d时FOXM1蛋白表达开始逐渐上调(P<0.05),7 d时达高峰(P<0.05),10 d时开始恢复(P<0.05),14 d时基本回到基础水平(P>0.05),表达规律与FOXM1 mRNA相似。见图4。
2.6 各组小鼠FOXM1蛋白与肺微血管通透性的相关性
采用Spearman等级相关性分析的方法分析SAP/ALI小鼠模型复制后不同时间点FOXM1蛋白表达与肺微血管通透性(肺组织EB含量)的相互关系。结果显示,复制后1 d,两者呈负相关(rs=-0.859,P=0.008);复制后3和7 d,两者呈负相关(rs=-0.984和-0.924,P=0.001和0.003);复制后10和14 d,两者呈正相关(rs=0.871和0.862,P=0.002和 0.006)。
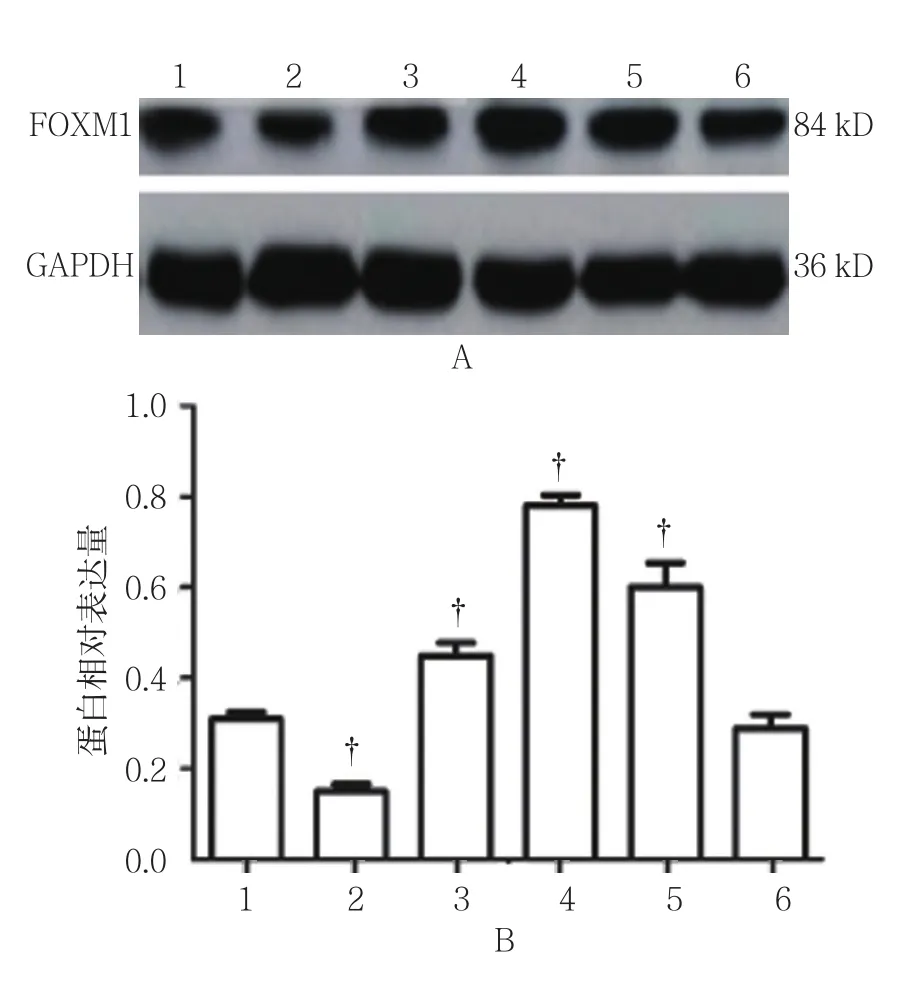
图4 各组小鼠FOXM1蛋白表达的变化
3 讨论
本研究采用雨蛙肽诱导SAP/ALI小鼠模型,发现复制后各时间点血清淀粉酶升高,肺组织病理形态发生改变,在第1天达高峰,然后随着时间的推移而不断减轻,肺微血管通透性和肺组织含水量变化规律与肺组织损伤后病理形态改变相似,提示SAP并发ALI后肺组织自身存在一定的自我损伤修复能力,肺气血屏障的破坏与修复可能在其中扮演关键角色。同时,在损伤修复过程中发现肺组织FOXM1 mRNA表达具有明显的动态演变规律,复制后第1天表达下调,随后逐渐上调,第7天达高峰,随后逐渐恢复,第14天时基本回到基础水平;Western blotting检测FOXM1蛋白水平也有相似的表达规律。另外,通过对FOXM1蛋白表达与肺微血管通透性进行相关性分析,结果显示在肺组织损伤修复过程中,复制后1 d时,两者呈负相关;术后3和7 d,两者呈负相关;复制后10和14 d,两者呈正相关,表明FOXM1可能参与SAP/ALI过程中肺气血屏障的损伤与修复。
肺气血屏障通透性增加是ALI发生并进展到急性呼吸窘迫综合征的必然过程,SAP/ALI典型的病理改变是肺微血管内皮损伤,导致其通透性增加,造成肺间质水肿,甚至肺泡水肿。研究表明,肺微血管屏障功能紊乱在SAP/ALI发生中起重要作用,当微血管渗透性急剧增加时,大量液体渗入肺组织间隙,造成严重肺水肿,进一步出现肺泡结构的破坏[2]。因此,寻求有效的纠正肺气血屏障功能紊乱的药物作用分子靶点,对于降低SAP/ALI患者临床病死率具有重要的意义。
FOXM1是Fox家族转录因子之一,与细胞增殖密切相关,能特异性的表达于增殖期细胞中,而在细胞终末分化时消失[8]。近年来大量文献报道,在肺癌、乳腺癌等多种恶性肿瘤中,FOXM1均高表达[9-10]。同时有研究表明,使用siRNA干扰的方法抑制FOXM1激活后,能够阻止损伤后的肺微血管内皮细胞增殖[11]。但有趣的是,WANG等[12]研究发现,在Rosa26-FOXM1转基因小鼠模型中,即使观察到FOXM1蛋白定位于细胞核中,细胞增殖并未见增加。综合以上研究结果,笔者推断,在正常情况下,FOXM1既可促进细胞增殖,但又在一定程度上存在某种机制来调控自身,以防止FOXM1的异常上调,使细胞异常增殖,最终出现恶变,FOXM1可能是SAP/ALI后微血管内皮细胞增殖和功能维持的关键分子。为证明该假设,本研究通过qRT-PCR和Western blotting检测SAP/ALI小鼠肺损伤修复过程中FOXM1 mRNA和蛋白的表达及其演变规律,发现在肺损伤修复过程中,FOXM1表达总体被激活,在一定范围内上调,且与肺微血管通透性具有相关性,达一定水平后逐渐下调恢复,进一步说明FOXM1在SAP/ALI肺损伤修复过程中发挥重要作用,可能通过有限度地促进肺微血管内皮细胞增殖来修复损伤的血屏障损,又不至于导致肺组织恶变。
而关于在损伤后第1天内,FOXM1表达水平与肺气血屏障通透性不一致的原因尚不清楚,可能是在急性胰腺炎相关的肺损伤发生过程中,肺内炎症因子、凋亡因子等大量表达,肺内损伤因素占主导,此时气血屏障被破坏,FOXM1表达被这些损害因素所抑制,内皮细胞发生坏死或凋亡为主,但具体的分子机制有待进一步研究。
本研究也存在一些不足,损伤后的肺组织内存在多种细胞,如肺泡上皮细胞、内皮细胞、成纤维细胞,以及各种炎症细胞等,课题组没有进一步区分FOXM1在肺微血管内皮细胞中的表达情况,而通过免疫荧光双标的方法或体外培养肺微血管内皮细胞模拟SAP/ALI微环境来检测其表达变化规律会更有说服力。总之,本研究初步探讨SAP/ALI修复过程中FOXM1的表达变化,结果发现,FOXM1可能在促进SAP/ALI肺气血屏障的修复过程中发挥重要作用,是新的潜在靶点,但其具体是通过何种分子机制实现对自身的调控,还需要更深入的研究来阐明。
