旋毛虫5′-nucleotidase基因特征与克隆表达
2018-12-13廖成水王晓利杜付玉余祖华张春杰李银聚吴庭才刘明远程相朝
廖成水,王晓利,杜付玉,郁 川,余祖华,张春杰,李银聚,吴庭才,刘明远,程相朝
旋毛虫是一种重要的人兽共患胞内寄生虫,寄生于宿主骨骼肌细胞,目前旋毛虫具有9个种和3个基因型12个物种[1]。一旦摄入含有旋毛虫幼虫的动物肉后,肌肉幼虫通过消化酶从包囊释放到胃中,进入肠道后发育为感染性幼虫[2]。1835年Page和Owen在实验中首次分离旋毛虫[3],随后大量研究发现旋毛虫幼虫入侵机体不是简单的机械性渗透的结果[4-5],并且认为排泄/分泌产物在旋毛虫发育、侵袭和寄生过程中起着重要作用[6]。
核酸酶广泛存在于微生物,主要参与营养代谢、遗传物质的复制、重组和修复机制以及与微生物感染、免疫有关[7]。旋毛虫基因组中拥有125种庞大的DNase II家族蛋白,并且一半以上属于编码排泄/分泌产物[8],但DNase II家族蛋白在旋毛虫的识别和侵入过程中起的关键作用仍未得到很好阐述。Wang等研究发现旋毛虫体外感染肠上皮细胞时可产生5′-nucleotidase蛋白[9]。5′-nucleotidase是一个核苷酸代谢酶,催化核苷5′-二磷酸酯的水解中生成5′-单磷酸核苷[10]。许多寄生虫可分泌5′-nucleotidase,但目前有关旋毛虫5′-nucleotidase基因及蛋白的研究报道较少。为此,本研究对旋毛虫5′-nucleotidase基因进行克隆,并进行了原核表达,为进一步5′-nucleotidase在旋毛虫感染过程中的作用研究奠定基础。
1 材料与方法
1.1动物、质粒、菌株和虫种 Wistar大鼠(200.0±20.0 g)购自吉林大学白求恩医学院动物实验中心;中国河南猪旋毛虫分离株Trichinellaspiralis(genotype T1),国际标准虫种编号为ISS534,由本室大鼠传代保种;pUC18和pET-32a购自宝生物工程(大连)有限公司,由本实验常规保存;大肠杆菌DH5α和大肠杆菌Rosetta购自德国Novagen公司,由本实验常规冻存。
1.2主要试剂 胰蛋白胨和酵母浸出物购自英国OXOID公司;TaqPCR Master Mix(2x,blue dye)DNA Marker、BamHI、HindIII、RNA PCR Kit (AMV) Ver.3.0、T4连接酶和His标签镍柱亲和层析蛋白纯化试剂盒均购自宝生物工程(大连)有限公司;质粒小量提取试剂盒购于北京康为世纪生物科技有限公司。异丙基-β-D-硫代半乳糖苷(IPTG)购自Sigma公司。AxyPrep DNA凝胶回收试剂盒购自康宁生命科学(吴江)有限公司;其它化学试剂均为国产分析纯。
1.3引物设计与合成 根据GenBank旋毛虫5′-nucleotidase基因序列(登录号AY127571.1),设计PCR引物:F:5′-GGATCCTTACAGTTAACACTAATTCATAC-3′(下划线处为BamH I酶切位点);R:5′-AAGCTTTCAAACGAAGGTGATGCGAT-3′(下划线处为Hind III酶切位点)[11]。引物由生工生物工程(上海)股份有限公司合成。
1.4旋毛虫5′-nucleotidase基因的克隆与鉴定 常规方法收集旋毛虫肌幼虫虫体,根据Trizol试剂盒的方法得到旋毛虫总RNA。根据RNA PCR Kit (AMV) Ver.3.0试剂盒的方法得到cDNA。以旋毛虫cDNA为模板,常规PCR扩增获得plancitoxin-1基因,反应程序如下:95 ℃ 4 min;95 ℃ 1 min,55 ℃ 45 s,72 ℃ 100 s,30个循环;72 ℃延伸10 min,目的基因连接至克隆载体pUC18,然后转化于感受态细胞DH5α中,PCR和酶切鉴定后进行序列测定。
1.5同源性分析 收集20余种不同物种的5′-nucleotidase类似物氨基酸序列,搜集90余种不同血清型的5′-nucleotidase及其类似物氨基酸序列。MEGA7.0用于分析旋毛虫5′-nucleotidase蛋白与其他90多个不同血清型的5′-nucleotidase家族蛋白的相似性。
1.6在线网站分析5′-nucleotidase蛋白理化性质http://web.expasy.org/protparam/分析蛋白分子量大小、理论等电点和氨基酸组成。http://people.mbi.ucla.edu/sumchan/caltor.html和http://biotech.ou.edu/分别用于分析稀有密码子和重组蛋白的可溶性。http://web.expasy.org/protscale/分析蛋白的亲水性与疏水性。
1.7在线网站预测5′-nucleotidase蛋白结构 https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi预测保守区域。在线软件TMHMM program、NetNGlyc、SignalP、NetOGlyc和NetPho分别预测跨膜区、N-糖基化位点、信号肽、O-糖基化位点和磷酸化位点。https://www.predictprotein.org/#分析二硫键数量。http://tools.immuneepitope.org/bcell/和http://www.cbs.dtu.dk/services/NetCTL/预测线性B细胞抗原表位和T细胞结合位点。https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.plpage= /NPSA/npsa_server.html和https://swissmodel.expasy.org/分析预测二级结构和三级结构。
1.8原核表达载体的构建与鉴定 将正确的重组质粒pUC18-5′-nucleotidase经BamH I和Hind III双酶切后连接至表达载体pET-32a构建原核表达载体pET-32a-5′-nucleotidase,然后转化至大肠杆菌Rosetta。
1.9重组菌的蛋白表达与纯化 终浓度为1 mmol/L的IPTG对大肠杆菌Rosetta(pET-32a-5′-nucleotidase)进行诱导表达,采用镍柱亲和层析蛋白纯化试剂盒纯化重组蛋白,然后进行SDS-PAGE分析。
2 结 果
2.1旋毛虫5′-nucleotidase基因的克隆与鉴定 PCR结果显示扩增到了约1 653 bp的条带(图1A),与预期的5′-nucleotidase大小一致。限制性内切酶BamHⅠ和Hind Ⅲ对重组质粒(pUC18-5′-nucleotidase)双酶切鉴定,结果显示出现约2 686 bp的载体条带和约1 653 bp的目的条带(图1B)。测序结果与GenBank中AY127571.1的5′-nucleotidase基因的同源性为100%。
2.25′-nucleotidase蛋白的同源性分析 5′-nucleotidase的氨基酸序列与其他物种的5′-nucleotidase蛋白及其类似物的同源性比较低,与已报道的斑马拟丽鱼、根瘤菌、刺尾蝎属、柱头虫、赤拟谷盗等5′-nucleotidase蛋白类似物的同源性集中于29.76%~34.44%,与纯绿蜱属具有39.36%的同源性,遗传进化关系上被分在一个进化支(图2)。整体上看,旋毛虫5′-nucleotidase与纯绿蜱属亲缘关系较近。但是5′-nucleotidase基因与GenBank中已报道的斑马拟丽鱼、水螅、刺尾蝎属、柱头虫、赤拟谷盗等的核苷酸同源性集中在65%~72%,与果蝇属的核苷酸同源性为79%。

图2 旋毛虫5′-nucleotidase与其他物种5′-nucleotidase蛋白的遗传进化树分析 Fig.2 Phylogenetic analysis of 5′-nucleotidase from T.spiralis and other previously reported
旋毛虫5′-nucleotidase的氨基酸序列与旋毛虫的其他血清型XP-003380309.1和AAM97494.1的同源性分别达到100%和96%。旋毛虫5′-nucleotidase基因的核苷酸序列与旋毛虫的其他血清型XP-003380309.1和AAM97494.1的核苷酸序列的同源性也分别达到100%和95%。5′-nucleotidase与KRY37020.1、XP-003380308.1、KRY26807.1、KRY26803.1等分在一个进化树大分支上。
2.35′-nucleotidase蛋白理化性质的分析 在线软件分析显示5′-nucleotidase的氨基酸数为550,分子式为C2800H4358N742O803S23,理论分子质量和等电点(pI)为62 kD和6.13,119个氨基酸残基,带负电荷残基总数(Asp+Glu)为63个;正电荷残基总数(Arg+Lys)为56个。非极性氨基酸占44.4%,极性不带电荷氨基酸占31.3%,极性带负电荷氨基酸占11.4%,极性带正电荷氨基酸占12.9%。其消光系数(M-1cm-1=280 nm)为77 280,不稳定指数(Ⅱ)为33.45(<40),属于稳定类蛋白质,在体外哺乳动物网织红细胞的半衰期是30 h。疏水指数为93.80。该序列含有56个稀有密码子,其中有5处连续出现稀有密码子,在大肠杆菌中呈可溶性表达。该蛋白在11位氨基酸分值最高(2.467),有最强的疏水性;在72位氨基酸分值最低(-2.833),有最强的亲水性。
2.45′-nucleotidase蛋白结构的分析 保守结构域分析显示,5′-nucleotidase蛋白的保守结构域在24-304和332-512位氨基酸之间。5′-nucleotidase在N404VT、N461LS和N522FT共有3个N-糖基化位点。在G47和G535共有2个O-糖基化位点。5′-nucleotidase共存在20个磷酸化位点,分别为9个Ser、6个Thr和5个Tyr,潜力值均大于0.5。另外,该蛋白前21个氨基酸为信号肽,有跨膜区域,是跨膜蛋白。而且该蛋白质含有28个B细胞线性结合位点和13个T细胞结合位点。二级结构预测结果显示,该蛋白的二级结构主要由α-螺旋和无规则卷曲构成,其中α-螺旋占43.27%(238个),伸展链占22.73%(125个),β-折叠占7.82%(43个),无规则卷曲占26.18%(144个)。5′-nucleotidase没有二硫键(图3)。三级结构预测发现,5′-nucleotidase蛋白序列与PDB数据库中5eqv.1.A模板序列相似性为31.19%(图4)。

图3 5′-nucleotidase蛋白二级结构分析Fig.3 Predicted secondary structure of 5′-nucleotidase protein
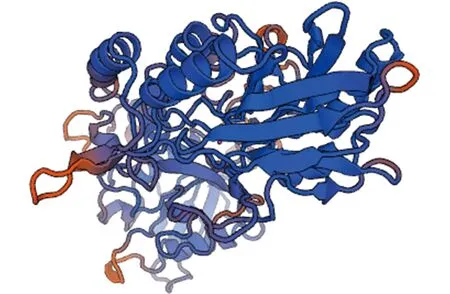
图4 5′-nucleotidase三维结构同源模型Fig.4 Three-dimensinal model of 5′-nucleotidase
2.5pET-32a-5′-nucleotidase重组质粒的构建与鉴定 用限制性内切酶BamHⅠ和HindⅢ对重组质粒pET-32a-5′-nucleotidase进行双酶切鉴定,结果显示出现约6 000 bp的载体条带和约1 653 bp的目的条带,与预期结果相符,说明原核表达载体构建成功(图5)。
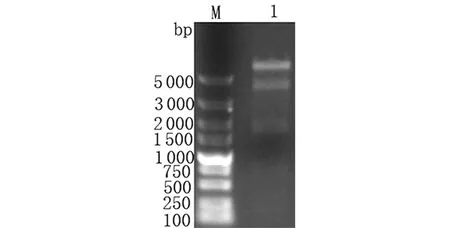
M: DL5000 DNA Marker; 1: Products from pET-32a-5′-nucleotidase digested with BamHⅠ+HindⅢ图5 pET-32a-5′-nucleotidase的酶切鉴定Fig.5 Identification of double enzyme for pET-32a-5′-nucleotidase
2.6pET-32a-5′-nucleotidase的诱导表达分析 SDS-PAGE分析结果显示,在约74 kD处出现目的条带,而且发现该蛋白主要存在于菌体超声后的上清中,说明该蛋白是可溶性蛋白,将超声后的蛋白经镍柱亲和层析纯化后获得纯化的蛋白,经SDS-PAGE结果显示可见较纯的目的条带(图6)。
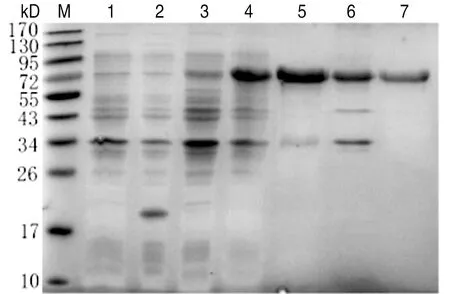
M: Protein Marker; 1: Rosetta (pET-32a) without IPTG induction; 2: Rosetta (pET-32a) with IPTG induction; 3: Rosetta (pET-32a-5′-nucleotidase) without IPTG induction; 4: Rosetta (pET-32a-5′-nucleotidase) with IPTG induction; 5: Rosetta (pET-32a-5′-nucleotidase) precipitate of bacteria with IPTG induction; 6: Rosetta (pET-32a-5′-nucleotidase) supernatant of bacteria with IPTG induction; 7: Purified protein图6 蛋白原核表达产物的SDS-PAGE分析Fig.6 SDS-PAGE analysis of prokaryotic expression products
3 讨 论
旋毛虫病临床诊断方面最大的困扰是其临床表现无特异性,患者患病期间发热、腹泻等症状时有发生,重症患者可引发心肌炎、肺炎及脑炎等[12]。目前,动物屠宰前旋毛虫的检测也被认为是阻断人类旋毛虫感染的有效方法之一,世界动物卫生组织(OIE)严格规定对进出口屠宰动物必须进行旋毛虫病检验[13]。旋毛虫引发机体感染后,肠道区域嗜酸性粒细胞等大量增加,在病灶区聚集并表现出浸润现象,但肠黏膜并未出现炎性反应[14]。5′-nucleotidase是一种作用于腺苷(次黄苷)-5′-磷酸的核酸酶,首次在心脏和骨骼的肌肉中发现,它能催化核糖与脱氧核糖部分的核苷酸分子5′-C端的磷酸盐酯化水解[15]。Cuttell等对侵入机体的旋毛虫的分泌蛋白进行了PCR定量检测,发现5′-nucleotidase参与分解核苷酸[16],但是目前对于旋毛虫5′-nucleotidase基因特征及功能的相关研究尚未见报道。
本研究利用多种生物信息学在线软件对旋毛虫5′-nucleotidase蛋白结构及其理化性质进行了预测和分析。旋毛虫5′-nucleotidase基因在同一物种属内差异较小,在不同物种之间的差异性比较大。该蛋白含有28个B细胞线性结合位点和13个T细胞结合位点。糖基化位点预测结果显示,旋毛虫5′-nucleotidase蛋白含有3个N-糖基化位点和2个O-糖基化位点,这些糖基化位点的存在对蛋白质的功能的调节起着重要的作用。信号肽预测结果显示,旋毛虫5′-nucleotidase蛋白含有信号肽,属于分泌性蛋白。二级结构分析结果显示,旋毛虫5′-nucleotidase蛋白的二级结构存在大量的α-螺旋和无规则卷曲,这表明此蛋白质属于稳定类蛋白质。对旋毛虫5′-nucleotidase蛋白质序列模序进行在线预测,发现旋毛虫5′-nucleotidase蛋白含20个潜在磷酸化修饰位点。旋毛虫5′-nucleotidase蛋白磷酸化位点的存在与细胞内信号传导和蛋白定位等过程关系密切,但旋毛虫5′-nucleotidase蛋白的磷酸化位点是否与细胞内信号传导及蛋白定位等过程有关目前尚未确切研究。
本研究成功克隆了旋毛虫5′-nucleotidase基因,并对其序列特征进行了分析,同时构建了旋毛虫5′-nucleotidase的原核表达质粒,在大肠杆菌Rosetta中呈可溶性表达。为深入探究旋毛虫5′-nucleotidase蛋白的功能及在旋毛虫感染宿主中的作用机制奠定基础。
