狂犬病两株不同毒力克隆株病毒的神经毒力和全长基因序列比较
2018-12-13,,
,,
狂犬病在世界范围内广泛分布,除南极洲以外的所有大洲都有报告。进入21世纪后,狂犬病仍然是一个重要的公共健康威胁,每年大约有60 000人死于狂犬病,它是最致命的动物传播传染病[1]。目前,99%的人类狂犬病发生在发展中国家,主要在亚洲、非洲、拉丁美洲和加勒比海地区。亚洲狂犬病病例居世界首位,每年约有30 000人死亡(95% CI,8 100-61 400)[2]。印度是狂犬病疫情最严重的国家,其次是中国,2007年报告病例数达到3 300例[3]。2004-2014年,狂犬病死亡人数居我国法定感染性疾病前3位,中国狂犬病疫情形势十分严峻。
在控制和消除人类狂犬病的基本措施中,除了对人类进行有效接种外,还必须对狗进行大规模免疫。在西欧、中欧、加拿大和美国大部分地区,用诱饵对野生动物进行口服免疫已成功地消除了当地的狐狸狂犬病并减少和控制了人类狂犬病[4]。同时,世界卫生组织(WHO)大力鼓励研究和开发安全有效的犬饵口服疫苗,并为犬饵口服疫苗的研究和现场应用制定了指南[5],一些高度减毒的疫苗株,如SAG2和VRG,已被WHO推荐用于流浪狗的口腔免疫[6],并在许多国家得到广泛应用[7]。
本实验室对狂犬病减毒活疫苗的研究从20世纪80年代就开始了,已成功筛选出1株减毒株CTN-181。CTN-181减毒株对4周龄小鼠不致病,但对4周龄以下的小鼠而言仍会致病[8],且该病毒具有异质性和遗传稳定性差。为培育出具有更高同质性,减毒更稳定和更好免疫原性的减毒株,我们将CTN-181通过豚鼠颌下腺内连续传3代,后空斑纯化,发现不同的空斑病毒毒力变化很大。 毒力高的可达3.16 lgLD50,低的则不致病[9]。
本文就筛选到的一株对小鼠脑内无致病性的CTN181-3株和另一株毒力较强的CTN181-12克隆株进行毒力和全基因序列对比研究。
1 材料与方法
1.1毒种和细胞 狂犬病毒减毒株CTN181[10]、CTN181-3和CTN181-12为本室筛选并保存;BHK-21细胞由美国泛特里军事医学研究所赠送,用含10%牛血清的MEM 37 ℃培养。
1.2实验动物 昆明鼠,SPF级,10日龄/14日龄/21日龄,由本院动物所提供,实验动物饲养许可证编号为SCXK(京)009-0017,操作遵守《实验动物管理条例》动物福利要求。
1.3小鼠脑内毒力测定 将CTN181-3和CTN181-12病毒分别接种于10、14和21日龄的小鼠脑内,观察14 d,记录小鼠的发病情况,利用Reed-Muench法计算LD50。
1.4病毒空斑实验[8]在六孔板中制备单层BHK21细胞,将病毒稀释至10-1~10-7系列,每孔接种0.2 mL,每个稀释度做复孔,并加两孔稀释液作空白对照,轻轻摇晃,置于37 ℃,5%CO2培养箱中培养1 h,每孔加入4 mL含有1%甲基纤维素和2%HEPES的覆盖物,置于35 ℃,在5%CO2培养箱中培养。7 d后,弃覆盖物。在每孔加入2 mL结晶紫染料溶液。染色15 min后弃掉染料,计算空斑形成单位(PFU/mL)。
1.5菌株、质粒及主要试剂 感受态DH5α购自天根生化科技北京有限公司;克隆载体pGEM-T Easy Vector system购自Promega公司;QIAamp Viral RNA试剂盒,购自QIAGEN公司;逆转录试剂GoScript Reverse Transcription System,购自Promega公司;Phusion超保真DNA聚合酶Kit,购自New England Biolabs;QIA quick Gel Extraction Kit试剂盒,购自QIAGEN公司。
1.6引物设计及合成 根据GenBank中登录号为FJ959397的CTN-1株设计8对引物,用于CTN181-3株和CTN181-12株的全基因组分段扩增和序列测定,见表1。

表1 狂犬病病毒CTN-1克隆株全基因组分段扩增用引物Tab.1 Primers for whole genome amplification of rabies virus CTN-1 clone
注:引物名称中的“F”表示正向引物,引物名称中的“R”表示反向引物。
1.7病毒RNA的提取及病毒基因组的分段PCR扩增 用QIAamp Viral RNA分别提取狂犬病毒克隆株CTN181-3和CTN181-12的基因组RNA。采用GoScript Reverse Transcription System将RNA反转录成cDNA,以其为模板,用表1中引物进行分段PCR扩增。反应体系:5×Phusion HF缓冲液10 μL,10 mmol/L dNTP 1 μL,10 μmol/L上、下游引物各2.5 μL,DMSO 1.5 μL,DNA聚合酶0.5,cDNA 2 μL,去离子水补足50 μL。反应条件:初始变性98 ℃ 30 s; 98 ℃ 10 s,53 ℃ 30 s,72 ℃ 90 s,共30个循环;72 ℃再延伸5 min。PCR产物经1%琼脂糖凝胶电泳鉴定,采用QIA quick Gel Extraction Kit纯化回收。
1.8PCR扩增产物的克隆、序列测定及序列拼接与分析 将PCR纯化产物分别与pGEM-T Easy Vector system连接,转化感受态DH5α,挑选阳性克隆并通过菌落PCR鉴定,由上海立菲生物技术有限公司(北京)测序,每个片段发送至少3个阳性克隆用于双向测序。使用DNAstar MegAlign软件剪接测序结果并进行分析。
2 结 果
2.1CTN181-3株和CTN181-12株的空斑形成情况 CTN181-3株和CTN181-12株在BHK21细胞上可形成空斑,形成的空斑均为针尖大小,大小均匀(见图1)。

图1 狂犬病毒CTN181-3株(a)和CTN181-12株(b)在BHK21细胞上形成空斑Fig.1 Plaque in BHK21 of CTN181-3 and CTN181-12
2.2CTN181-3株和CTN181-12株毒力比较 当测定减毒株的毒力LD50时,同时测定病毒滴度(PFU)。毒力高低以二者对比lgPFU/lgLD50表示,即引起动物死亡的LD50的病毒量(PFU)越大,毒力越低,反之毒力越高。结果显示,在病毒感染量相差不多(6.6~7.3 lgPFU/mL)的情况下,CTN181-3对21日龄小鼠的脑内接种未致死,而CTN181-12的LD50高达6.26 lgLD50/mL。对14 d和10 d龄小鼠的LD50,CTN181-3亦较CTN181-12低。若以PFU和LD50的差值比较,则CTN181-3和CTN181-12二株对10、14和21 d 日龄小鼠的lgPFU/lgLD50差值分别为0.07、3.40,>5.1和<-0.9、<-0.6,1.04。前者明显大于后者,表明CTN181-3株的毒力明显低于CTN181-12株(见表2)。
2.3CTN181-3株和CTN181-12株的全基因组序列比较 狂犬病病毒CTN181-3株和CTN181-12株全基因组序列全长均为11 924nt,其中CTN181-3株已被GenBank收录,登录号为KU946961。
CTN181-3株和CTN181-12株相比,P基因和M基因各存在1个核苷酸位点不同,G基因存在4个位点不同,L基因有2个位点不同。这8个核苷酸位点导致2株病毒共6个氨基酸位点的不同,即P蛋白和M蛋白各1个位点、G蛋白2个位点、L蛋白2个位点,如表3所示。
以上P、M、G和L区内的6个氨基酸突变应该是CTN181-3株毒力较CTN181-12株低的分子基础。
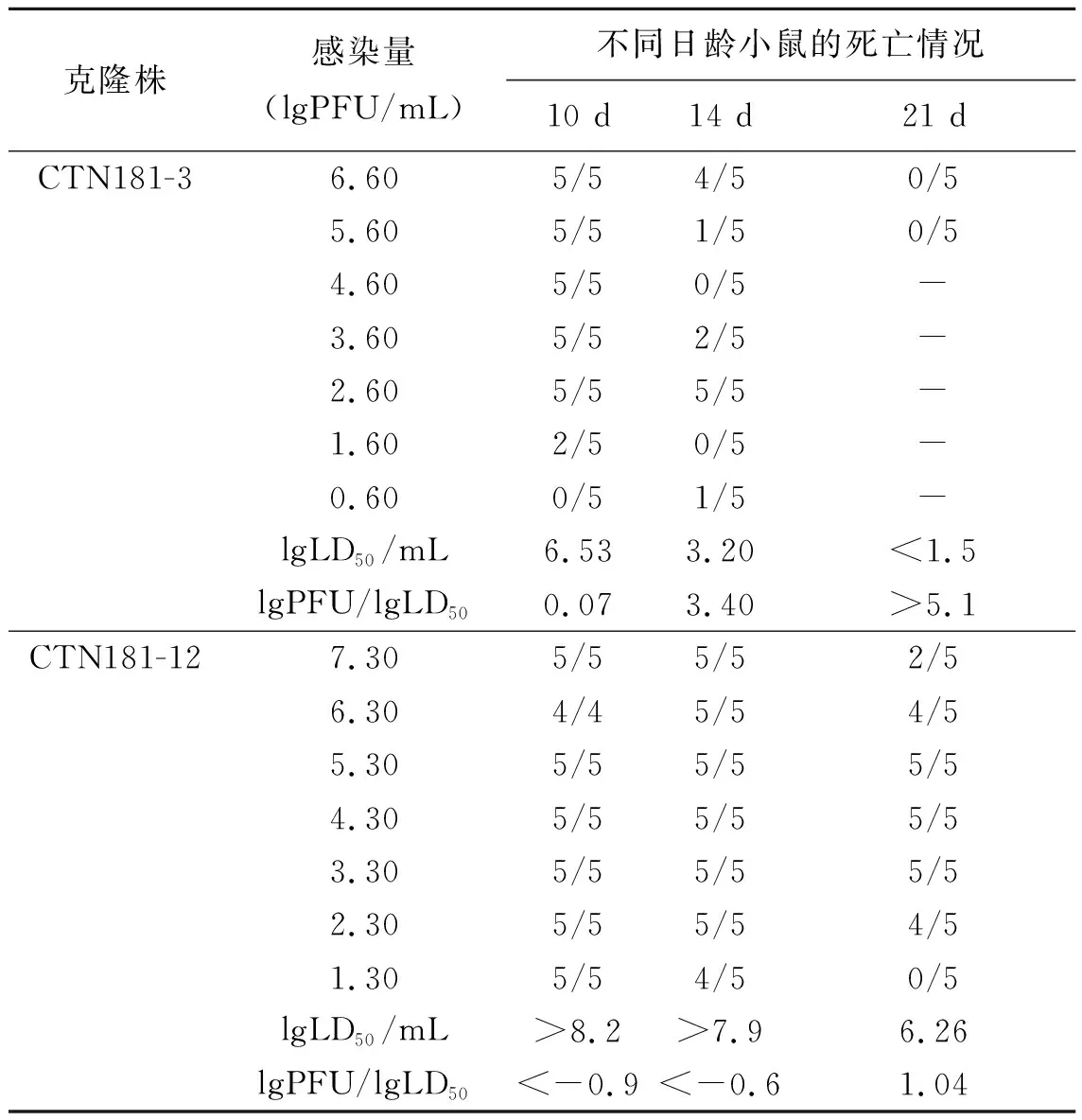
表2 2株狂犬病毒克隆株对不同日龄小鼠的毒力比较Tab.2 Virulence comparison of CTN181-3 and CTN181-12 in different age mice
注:“-”未测
3 讨 论
狂犬病病毒属于Rhabdovirus家族的弹状病毒属。它是一条单链负链RNA。病毒RNA中每个基因的顺序是:3′UTR-NPMGL-5′UTR,每个基因组由3个部分组成:3′非编码区、编码区和5′非编码区。3′非编码区以UUGU序列开始,5′非编码区以U7结束。病毒基因组大小约12 kb,其中约91%的核苷酸参与编码5种已知蛋白,即核蛋白N、磷蛋白P、基质蛋白M、糖蛋白G和RNA依赖性RNA聚合酶L。N、P、L蛋白和基因组RNA形成核糖核蛋白复合物(RNP),M和G蛋白被包裹在RNP的外部并与RNP相互作用。
糖蛋白G是一种跨膜蛋白,在病毒表面构成1个突出物,它是狂犬病病毒与细胞受体结合的配体,介导病毒与靶细胞的结合及其在神经系统中的分布,以及病毒的毒性,这与疾病是密切相关的。糖蛋白的总长度为524个氨基酸,N-末端19个氨基酸构成疏水信号肽,诱导新生蛋白通过粗面内质网膜。成熟糖蛋白含有505个氨基酸残基,分为膜外区、跨膜区和膜内区。
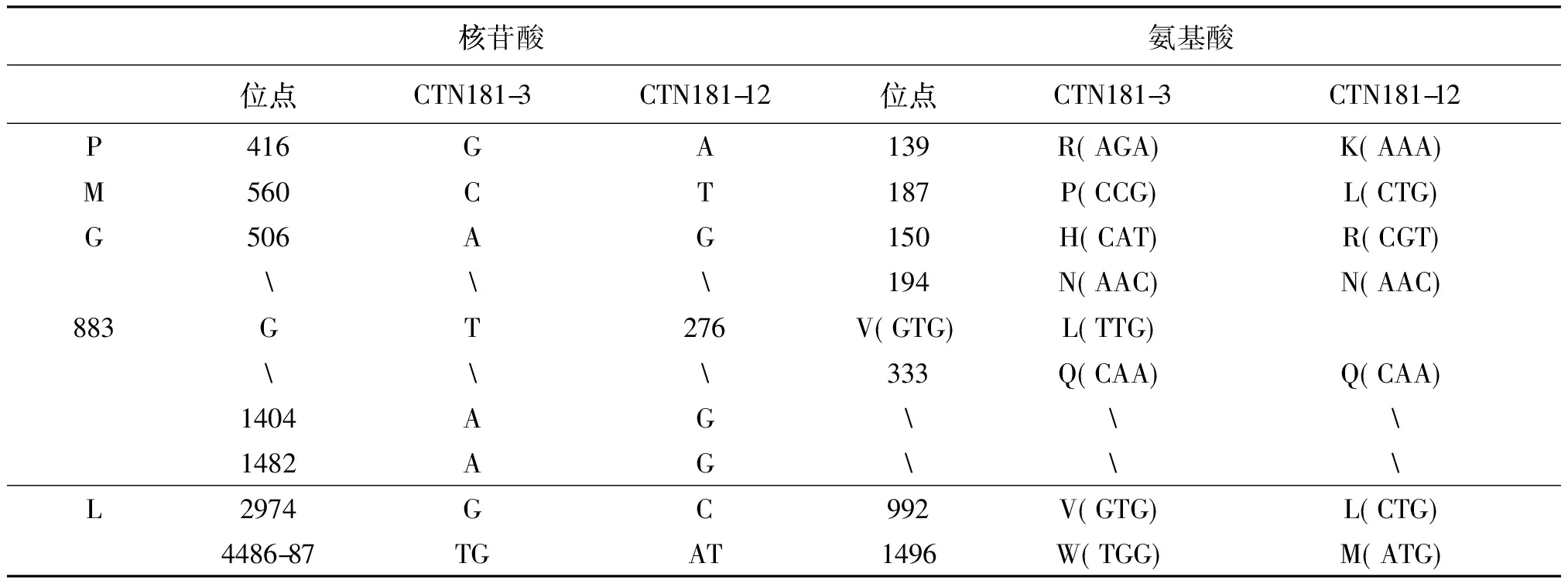
表3 CTN181-3、CTN181-12株核苷酸和氨基酸位点差异Tab.3 Site differences of nucleotide and amino acid between CTN181-3 and CTN181-12
注:括号内为三联体遗传密码,括号外为一位氨基酸编码
G蛋白中333的精氨酸或赖氨酸是狂犬病病毒致病的决定因素[11-12],当G333精氨酸或赖氨酸突变为谷氨酰胺、丝氨酸等其他氨基酸时,病毒的神经毒性显著降低。许多现有的狂犬病弱毒株,如SAG2,Flury HEP、ERA等,这个位点都突变为其他氨基酸[13-15]。另有研究表明,G194位点由天冬酰胺突变为赖氨酸[16]会引起毒力的回升。本文中虽然CTN181-3株和CTN181-12株G333位点均为谷氨酰胺,G194位点也均为天冬酰胺,但CTN181-3株的毒力完全减弱,而CTN181-12株虽较其他狂犬病野毒株的毒力弱,但仍保留一定的毒力。如该二株的原始株CTN-1和攻击毒CVS株对3周龄小鼠的lgPFU/lgLD50值分别为-1.0和-1.1[17],而CTN181-12株为1.04。
狂犬病病毒G蛋白存在3个中和抗原位点,其中抗原位点Ⅱ位于34~200位氨基酸区段,是一个典型的空间构象位点。根据T细胞的线性表位分析,糖蛋白上的18-44、244-291、292-323和336-452的氨基酸片段是必不可少的[10]。本文中CTN181-3株和CTN181-12株的G150位点存在不同,该位点位于抗原位点Ⅱ;另一关键位点G276也存在差异,该位点位于T细胞线性表位。两个关键位点的差异应是二者毒力不同的关键因素。
本研究通过CTN181-3株和CTN181-12株的全基因组分析,结果发现,P、M、G、L蛋白发生了8个核苷酸突变,导致6个位点的氨基酸变化,其中G150和G276氨基酸的不同,是毒力减弱的2个关键位点,认为这6个氨基酸位点的不同是2株病毒毒力不同的分子基础。
