胶原蛋白肽含药血清促进成骨细胞增殖和分化
2018-08-02刘俊丽宋淑军司少艳卢伟鹏郭燕川
刘俊丽 宋淑军 司少艳 卢伟鹏 郭燕川*
1. 中国科学院理化技术研究所,光化学转换与功能材料重点实验室,北京 100190 2. 解放军第306医院特种医学实验研究中心,北京 100101
骨质疏松症是一种代谢性疾病,其特征是骨形成不足、骨吸收过度而导致骨量减少及骨微结构的恶化,其后果增加了骨脆性和骨折易感性[1]。全世界骨质疏松的发病率在慢性疾病中已升至第5位,随着全世界老龄人口的比例增加,骨质疏松患者也将大幅增加。由于骨质疏松性骨折而导致的慢性疼痛、关节变形、抑郁、残疾甚至死亡,其后果严重影响患者的生活质量,给患者及家庭和社会带来了沉重的负担[2]。
胶原蛋白肽是胶原或明胶经蛋白酶降解处理后而形成的多肽混合物,富含人体需要的甘氨酸、脯氨酸、羟脯氨酸等,具有较高的消化吸收性及安全性[3]。本研究前期的实验结果表明,去卵巢大鼠每日灌胃补充不同剂量的骨胶原蛋白肽或骨胶原蛋白肽与柠檬酸钙混合物,3个月后双能X线检测结果表明股骨骨密度与卵巢切除(ovariectomy,OVX)对照相比显著增加。Micro-CT检测结果表明,骨胶原蛋白肽可以显著改善股骨的微结构,并能够增加胶原合成[4]。但胶原蛋白肽通过肠胃消化吸收入血后促骨活性的作用机理仍未阐明,目前尚未有相关的文献报道。因此,本实验将研究牛骨胶原蛋白肽(collagen peptides,CP)含药血清对小鼠前成骨细胞增殖与分化的影响,初步探究牛骨CP的促骨活性机理,为骨质疏松的预防和治疗提供理论依据。
1 材料和方法
1.1 试剂与仪器
小鼠前成骨细胞系MC3T3为美国ATCC公司产品,本室保存。DMEM培养基和优质胎牛血清购自Gibco公司;茜素红染料(Alizarin red)、地塞米松、β-甘油磷酸钠、抗坏血酸磷酸盐、二甲基亚砜(Dimethylsulphoxide,DMSO)、胰蛋白酶购自美国Sigma公司;MTT购自美国Genview公司;青霉素、链霉素购自华北制药公司;其他试剂均为市售分析纯;牛骨胶原蛋白肽由包头东宝生物技术股份有限公司提供。
本实验所用仪器为HERAcell150型CO2细胞培养箱(贺力氏公司,德国),IMT-2型倒置显微镜(奥林巴斯公司,日本),550型酶联免疫检测仪(BIO-RAD公司,美国);耗材为培养皿,96孔培养板(Constar公司,美国)。
1.2 方法
1.2.1牛骨胶原蛋白肽含药血清的制备:12只3月龄雌性SD大鼠(北京大学医学院实验动物中心)随机分为两组,实验组按每千克大鼠体重给予900 mg牛骨CP(相当于10 g/70 kg 牛骨CP化合物口服成人每日量)灌胃给药,对照组(control,CN)大鼠灌胃给予相同体积的无菌水。一天两次,连续7 d,间隔6 h(血清牛骨CP化合物浓度达到稳定状态)。在标准条件下,每笼饲养4只大鼠。最后一次灌胃给药2 h后,皮下注射水合氯醛麻醉。大鼠腹主动脉取血并分离血清,2 000 r/min离心5 min,分装保存在-20℃中。
1.2.2细胞的常规培养:取冻存的MC3T3进行复苏,用含100 mL/L胎牛血清和100 U/mL青霉素、100 U/mL链霉素的DMEM在37 ℃、5%CO2及饱和湿度条件的恒温培养箱内培养,根据生长情况定期传代,采用第3~5次传代后24 h的细胞进行实验。
1.2.3MTT法检测胶原蛋白肽含药血清对MC3T3成骨细胞增殖:为了明确牛骨CP含药血清对成骨细胞增殖的适宜效应浓度,分别将实验组牛骨CP含药血清与CN组血清加到无血清的DMEM中配成3%、6%、10%浓度,将MC3T3成骨细胞放在上述大鼠血清中培养5 d。同时,将MC3T3成骨细胞培养在3%大鼠血清培养4 d或5 d。具体步骤如下:将第3次传代的MC3T3成骨细胞按每孔4 000个/100 μL分别接种于3个96孔细胞培养板中,按上述分组方案分组,每组设6个复孔。24 h细胞贴壁后换液,分别加入上述相应药物置于37 ℃、5%CO2及饱和湿度条件恒温培养箱内培养。培养结束后,分别在所需检测的培养孔内每孔加入20 μL浓度为5 mg/mL的 MTT溶液,37 ℃继续孵育4 h,终止培养,小心吸取孔内培养上清液,每孔加入150 μL DMSO,振荡 10 min。选择 490 nm波长,在酶联免疫检测仪上测定各孔吸光度值。
1.2.4流式细胞术测定胶原蛋白肽含药血清对MC3T3成骨细胞周期的影响:为了明确牛骨CP含药血清对MC3T3成骨细胞周期的影响,将MC3T3成骨细胞传代以3.0×104个/孔细胞密度接种于6孔板,将3%牛骨CP含药血清与CN血清分别作用于MC3T3成骨细胞,并置于37 ℃,5% CO2细胞培养箱培养3 d。培养结束后,细胞用0.25%胰酶消化制成单细胞悬液,70%乙醇固定于-20 ℃ 24 h,PBS清洗后,1 000 r/min离心5 min,加入1 mg/mL RNaseA于37 ℃处理30 min后离心,加入10 mg/mL碘化丙啶0.15 mL染色30 min,流式细胞仪检测细胞周期。
1.2.5茜素红染色鉴定成骨细胞的矿化:为测量细胞外基质钙沉积形成骨结节,细胞基质用能够结合Ca2+的茜素红染料染色,茜素红染色形成的红色是矿化的指示。成骨细胞在6孔板中接种密度为8×104/孔,细胞用成骨诱导剂(50 μg/mL抗坏血酸磷酸盐,10 mmol/L β-甘油磷酸钠,10 nmol/L地塞米松)诱导,每3 d换液1次,21 d天后吸去培养液,PBS洗两次,然后用4%多聚甲醛4 ℃固定30 min,用去离子水冲洗。细胞用40 mmol/L茜素红溶液(pH=4.4)染色40 min,在室温下用去离子水冲洗两次,染色细胞的图像被数码相机(IM50,Leica,Germany)捕获,用Pro Plus 6图像软件定量分析茜素红染色的含量。
1.3 统计分析处理
2 结果
2.1 CP血清对MC3T3-E1细胞增殖的影响
3%、6%、10%的牛骨CP血清及相应的CN血清处理MC3T3成骨细胞,5 d后MTT结果表明,3%,6%及10%的CP化合物含药血清与相应的CN血清比较,能够显著促进MC3T3-E1细胞增殖(P<0.05,图1 A)。同时,将3%的CP血清与3%的CN血清分别处理MC3T3成骨细胞4 d或5 d,MTT结果表明,CP血清与对照相比有很好的增殖潜能(P<0.01,图1B),进一步提示CP血清对成骨细胞的增殖起重要作用。
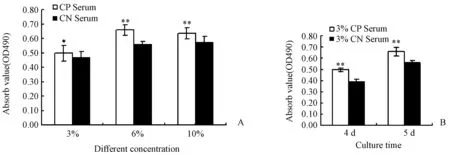
图1 CP血清对MC3T3成骨细胞增殖的影响(*P<0.05,**P<0.01)。A:不同浓度;B:不同培养时间Fig.1 The effect of CP serum on the proliferation of MC3T3 cells(*P<0.05,**P<0.01). A: Different concentration; B: Different culture time
2.2 流式细胞术检测CP化合物含药血清对MC3T3成骨细胞细胞周期的效应
MTT结果表明,不同浓度的CP血清对MC3T3成骨细胞的增殖具有显著促进作用。因此,在检测细胞周期时,将3% CP血清、CN血清分别作用于MC3T3成骨细胞,然后培养 3 d,流式细胞术测定细胞周期。统计分析结果表明,与CN血清相比,3%的CP血清组G1期比例显著减少,G2/S期比例显著增加(P<0.01,图2),进一步说明3%的CP血清对MC3T3成骨细胞具有显著促进作用,表明牛骨CP血清通过促进G2/S期的百分含量而促进细胞的增殖。
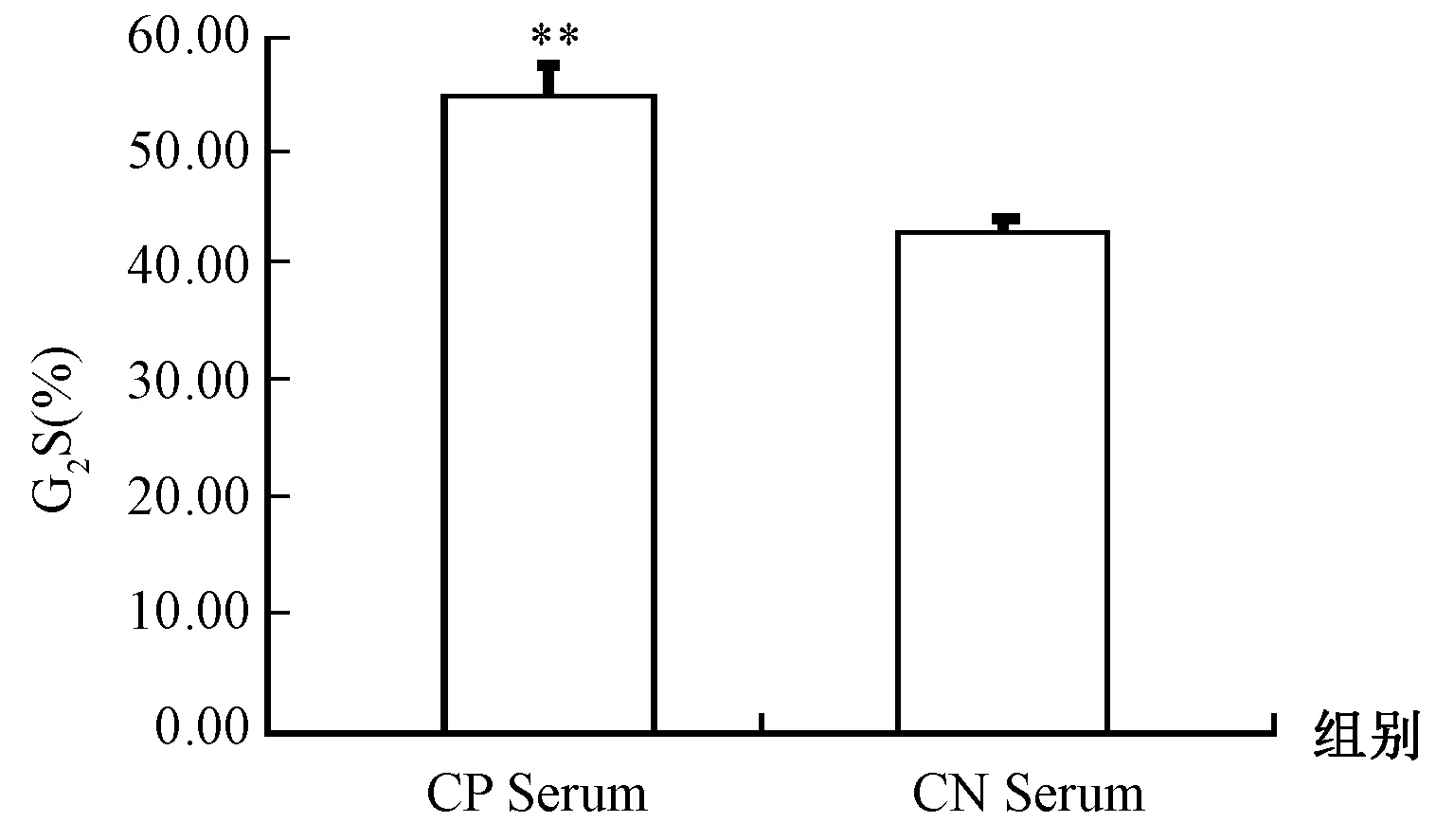
图2 CP血清改变MC3T3成骨细胞细胞周期时相分布(**P<0.01)Fig.2 Alteration of cell cycle distribution of MC3T3 cells by collagen peptides in serum treatment(**P<0.01)
2.3 CP血清促进成骨细胞的矿化
矿化对骨的形成非常重要。将成骨细胞分别用3%的CP血清及3%的CN血清处理后,培养21 d,3%的CP血清处理组的茜素红染色显著高于3%的CN血清,3%的CP血清处理组约为0.65±0.03,而CN血清组约为0.61±0.01(P<0.05,图3),表明CP血清能促进成骨细胞的矿化。
3 讨论
目前骨质疏松症主要依靠西医化学合成药物的治疗,但均存在一定的副作用[5]。如双膦酸盐增加上下消化道出血、下颌骨溃烂等风险,同时由于通过抑制吸收过程缺乏替代老旧的,损伤的骨组织而削弱了骨的质量[6]。重组人甲状旁腺激素特立帕肽属于激素类药物,其副作用具有增加高钙血的风险[7]。由于目前可用药物治疗疗效有限性,鼓励对疾病进行广泛深入研究,以寻找预防和治疗骨质疏松症新的药物靶点。

图3 CP血清促进成骨细胞的矿化(*P<0.05)Fig.3 CP Serum promotes mineralization in osteoblasts(*P<0.05)
Nomura等[8]的研究表明,每天服用150 mg/kg及500 mg/kg CP的去卵巢大鼠长达3个月后,与对照组相比,CP阻止去卵巢引起的骨损失,改善去卵巢大鼠椎骨组成特点和生物力学强度,显著增加腰椎的骨小梁数目及骨体积比,显示骨保护效果。水解猪皮胶原蛋白(<3 kDa)可以阻止大鼠因去卵巢导致的骨质流失,能够改善腰椎的微观结构[9]。
由于CP是由胶原或明胶经蛋白酶降解处理后制成的相对分子质量不同的肽混合物,成分复杂,经过胃肠消化吸收后,肽混合物有可能会被分解,直接用于体外药理实验时,它的杂质成分以及本身的酸碱度都影响体外细胞的生存环境,造成一些假阴性或假阳性结果出现。本实验所用的口服圆素牌胶原肽是中科院理化研究所研发,包头东宝生物技术公司生产的相对分子质量为600~2500 D的不同混合物, 平均相对分子质量为1000道尔顿优质胶原蛋白肽,这个分子量范围的胶原蛋白活性最强,使用后吸收效果也是最好,单独服用CP能显著抑制治疗组OVX大鼠股骨BMD的降低[10]。在本实验中,将胶原肽灌胃给大鼠取其血清进行体外实验,比较接近药物体内环境中产生药理效应的真实过程,其原有成分或在体内转化为活性成分或代谢后失活,或本身无作用但经代谢后产生作用,或通过第二信使而间接起作用都可通过血清药理学反映出来,理论上更具备科学性、真实性,比较接近大鼠灌胃CP化合物作用在体内产生药理环境的实际过程。因此,本研究进行实验阐明CP化合物含药血清对成骨细胞增殖的影响。
成骨细胞和破骨细胞是骨代谢的两种主要细胞,其中成骨细胞在骨代谢过程中起着非常重要的作用,成骨细胞不仅负责骨的形成,而且负责调节破骨细胞的生成和活性。人体口服试验表明,每天摄入10 g药物级别的水解胶原减少膝关节或髋关节等骨关节炎患者的疼痛,血液中的羟脯氨酸含量增加[11]。对于骨质疏松症患者而言,降钙素加药物级别的水解胶原比单独使用降钙素更能抑制骨胶原蛋白的分解,尿吡啶交联的下降,表明水解胶原蛋白在治疗骨关节炎和骨质疏松症的潜在效用[12]。因此本实验以此剂量为基础制备了CP血清,本研究选择了一系列不同的牛骨CP血清浓度,发现随着培养时间的延长,CP血清对MC3T3成骨细胞的增殖具有显著地促进作用。本研究进一步用流式细胞术检测CP血清对MC3T3成骨细胞细胞周期的效应,表明CP血清通过促进G2/S期的百分含量而促进细胞的增殖。因为MC3T3具有成骨能力,茜素红矿化染色后能够形成红色。研究数据表明,牛骨CP血清不仅增加成骨细胞的增殖,而且能够促进成骨细胞的分化和矿化基质的形成。这些研究结果表明胶原蛋白肽阻止去卵巢引起的骨损失至少部分是由于其促成骨细胞或前成骨细胞的增殖与分化功能所致。在后续的研究中,将进一步从蛋白水平及RNA水平明确牛骨胶原蛋白肽促进MC3T3成骨细胞增殖的分子机理,这为牛骨CP作为骨健康基本补充剂,用于骨质疏松的预防和治疗提供了理论依据。
综上所述,不同浓度的牛骨CP血清不仅能显著促进细胞的增殖,增加G2S期的百分含量,而且能够促进成骨细胞的矿化基质的形成,从而为骨质疏松的预防和治疗提供了理论依据。
