小麦和榛子过敏原成分检测的实时荧光PCR方法
2018-05-13尚柯张彪段庆梓张玉王巍梁恒兴
尚柯,张彪,段庆梓,张玉,王巍,梁恒兴
(成都食品药品检验研究院,四川 成都,610045)
过敏原(allergen),又称为变应原、过敏物、致敏原、致敏物。GB/T 23779—2009规定,能够诱发机体发生过敏反应的抗原物质,被称过敏原。食品过敏源是指普通食品中正常存在的天然或人工添加物质,被过敏体质人群消耗后能够诱发过敏反应。食物过敏原一般为相对分子质量10~70kDa的蛋白质或糖蛋白,可分为主要过敏原与次要过敏原,大多数过敏患者对主要过敏原敏感[1]。目前大约有160多种食品含有可以导致过敏反应的食品过敏原[2],常见的食品有:奶类(牛奶、羊奶等),坚果(杏仁、巴旦木、山核桃、榛子等),菜籽(葵花籽、芝麻等),豆类(花生、大豆、豌豆、蚕豆等),蛋类,巧克力,水果,海产品(虾、蟹类)等。
据统计,2%的成人和5%~8%的儿童存在不同程度的食品过敏。仅仅在美国,每年就有3 000人因食物过敏紧急住院,150~200人死亡[3]。据世界卫生组织的数据表明, 目前全球有 22%~25%的人患有过敏性疾病, 并以每10年23倍的速度增加,在我国就有两亿多人患有过敏性疾病,由食品过敏引发的过敏疾病已占过敏总数的 90%左右。
过敏原已成为重要的食品安全问题,因此评价和检测食品过敏原生物活性日益受到重视。同时,由于发达国家已对进出口食品过敏原标识进行了严格要求,食物过敏原甚至成为进出口贸易的壁垒。因此,如何快速准确地检测出食物中的过敏原成为当前亟需解决的问题。
目前常用的过敏原检测方法有免疫学检测、DNA检测、质谱及SPR等技术。张世伟等[4]通过运用双抗夹心ELISA法检测食品中的鸡蛋过敏原,得出 IC50为 260 ng/mL,检出限为10 ng/mL,样品的添加回收率为84.2%~89.8%,可以快速检测鸡蛋过敏原。BATISTA等[5]利用对大豆过敏病人血清,通过双向电泳技术结合 Western blotting检测方法,从非转基因大豆中检测出了43种致敏蛋白。PUERTA等[6]采用免疫层析技术在痕量水平上定位β-乳球蛋白,得出实际检测限为20.7 pmol/L,灵敏度为1.05×109AUmol-1L。
LU等[7]通过SPR技术对沙丁鱼肌肉中的过敏原蛋白小清蛋白进行检测,结果显示灵敏度高达 0.11 mg/kg。CHASSAIGNE等[8]就采用四极杆―飞行时间质谱仪检测出了花生中的主要过敏原蛋白Ara h1、Ara h2、Ara h3/4。VANDEKERCKHOVE等[9]利用LC-MS技术检测辣椒中的痕量花生过敏原成分,检出限可达24 mg/kg。
聚合酶链式反应(PCR)技术起始于20世纪90年代中期,目前在过敏原检测中已有应用。关潇等[10]通过PCR方法检测10种不同食品的牛奶过敏原,利用牛奶过敏原蛋白α-乳白蛋白基因序列设计引物的检测灵敏度可达0.04 ng DNA,这一结果表明该法对牛奶过敏原的检测具有较高的准确性和可靠性。CRUZ等[11]通过实时荧光 PCR 方法检测巴西坚果中的过敏原成分,利用其中的2S白蛋白基因作为引物,得到检测限为2.5 mg/kg。周新虹[12]采用Trizol法反转录RNA,克隆Ara h7 cDNA序列,并分析了表达蛋白的特征。SANTACLARA等[13]利用实时荧光PCR方法,检测食品中的虾、蟹等甲壳动物的过敏原成分,可在40 min内完成检测工作。ESPIEIRA等[14]通过建立一种食品中检测大豆过敏原成分的PCR方法,为保护消费者提供了一种思路。GARCA等[15]利用Taqman探针法检测食品中的坚果过敏原成分,检出限达到0.1 mg/kg。WU等[16]采用多重实时荧光PCR技术,分析柑橘的过敏原,并促进育种“allergy-friendly”水果。LINACERO等[17]采用实时荧光PCR技术检测核桃的主要过敏原Jugr1、Jugr3、Jugr4,检出限可达0.01%。
PCR法在复杂食品中过敏原的定量分析及物种鉴定方面,具有快速、高效、准确、适用性广、成本低廉、操作简便等优点,这使PCR方法在食物过敏原检测方面,存在极大的优势,适合国际法规所要求的食品中过敏原成分的检测原则。
目前,过敏原成分的PCR方法检测已有较多方法及标准,但这些方法和标准均存在一定的问题,如SN/T 1961.13—2013检测小麦时,发现有些品系的小麦无法检测,检测部分产地的小麦粉无法获得阳性结果;SN/T 1961.8—2013针对榛子的结构基因进行设计,并非过敏原基因,这可能导致某些脱敏食品仍然被检测为含过敏原成分。同时,标准的检出限可达0.01%,考虑到食品行业生产的特殊性,同一条生产线常常用来生产多类产品,很多无意添加将会被检出,这将导致假阳性现象频发,给实验检测带来较高的风险。本课题通过在国际免疫学会官方查询易过敏食品的主要过敏原成分,确定小麦、榛子的主要过敏原基因,建立一套完整的、标准化的、准确率高的、系统的过敏原检测技术,以解决现有方法及标准所存在的问题。
1 材料与方法
1.1 试剂与耗材
荧光定量扩增试剂盒(Bio-rad、Transgen公司),引物及荧光探针(Invitrogen公司),自动化仪器96深孔板磁力架AUTO-96-1(Borhee公司),NUNC 96孔U型深孔板(Borhee公司),磁珠法植物DNA提取试剂盒(Magen公司)。
1.2 仪器与设备
Bio-rad Cfx 96 Touch实时荧光PCR仪,Eppendorf Mini Spin 离心机,Eppendorf Centrifuge 5427 R高速冷冻离心机,IKA涡悬振荡器,Implen P330核酸蛋白定量仪,Retsch MM400行星球磨仪,Thermo-Shaker BG-100干式恒温器,Milli-Q Academic实验室超纯水仪,苏州净化SW-CJ-FD型单人单面净化工作台。
1.3 样品信息
本实验建立了小麦、榛子过敏原检测的的实时荧光PCR方法,建立方法所用样品见表1,检出限验证所用样品见表2,适用性验证样品见表3。

表1 方法建立所用样品Table 1 Samples used in method establishment

表2 检出限验证所用样品Table 2 Samples used in LOD
注:均为质量分数。
表3 适用性验证所用样品Table 3 Samples used in applicability verification

续表3
注:无小麦麸质样品包括荞麦类、玉米、燕麦等预包装食品;无榛子油质蛋白样品包括花生、瓜子、腰果等预包装食品。
1.4 PCR引物
具体引物探针序列见表4。荧光基团为FAM荧光,猝灭基团为BHQ。

表4 过敏原实验所用引物探针序列Table 4 Primer & probe sequence used in allergen experiment
1.5 方法
1.5.1 样品基因组的提取
对小麦、榛子样品及60批预包装产品进行样品前处理,用球磨仪研磨成粉,取约30 mg样品,按照Magen的磁珠法植物DNA提取试剂盒说明书提取及基因组,放于-20 ℃保存。
1.5.2 实时荧光PCR试验
首先用核酸蛋白定量仪确定DNA提取的效率与纯度,进行OD260/OD280值测定,测得值均在1.7~1.9之间,表明可用于PCR实验;然后将提取成功的基因组样品进行PCR扩增,其反应体系见表5。

表5 实时荧光PCR反应体系Table 5 Reaction system of Real-time fluorescent PCR
配制完毕后充分混匀进行PCR反应,其反应条件见表6。

表6 实时荧光PCR反应条件Table 6 Reaction conditions of real-time fluorescence PCR
2 结果与分析
2.1 方法设计与质控体系建立
根据国际免疫学会官方提交的物种主要过敏原信息,确定所选取的过敏原基因,参照GenBank中已提交的2个物种的主要过敏原序列,确定小麦(triticum aestivum)的过敏原特异性基因CM16、榛子(corylus avellana)的过敏原特异性基因Cora1,并与常见伪品序列进行比对分析,保证引物探针的特异性。运用DNA序列分析网站http://sg.idtdna.com/calc/analyzer对检测各物种的荧光定量PCR引物和TaqMan探针进行序列高级结构分析比对,以确保其高度的特异性,防止出现二聚体、茎环及发卡等影响检测效率的结构。
依据此引物探针进行PCR反应,对每个品种各5种正品、8~10种伪品进行实时荧光PCR鉴定,保证能够特异性区分正品与伪品。根据实时荧光PCR反应原理及相关食品检测标准,考虑到食品行业检测样本的复杂性,根据检出限设定本方法的判定原则为:
(1)阴性对照、空白对照不得有CT值;
(2)当样品CT值≤35,有典型扩增曲线时,判定为检出;
(3)当样品CT值>35,无典型扩增曲线时,判定为未检出;
(4)当样品无CT值,判定为未检出。
2.2 内参实验验证
DNA提取成功后检测DNA浓度及纯度,显示浓度均在10 ng/μL以上,A260/280均在1.7~1.9之间,证明DNA提取效果良好,可用于实时荧光PCR实验。
为了进一步确认DNA的提取效率,我们建立了内参验证实验,进行18Sr RNA验证,以保证DNA可用于实时荧光PCR检测,验证结果见图1。
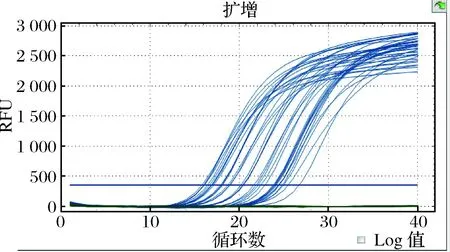
图1 内参实时荧光PCR结果
Fig.1 Reference real-time PCR results of internal-reference
内参实验验证成功,CT值均在15~30之间,证明DNA提取效果理想,可用于过敏原特异性检测。
2.3 实时荧光PCR方法特异性验证
引物与探针的特异性需要验证其种内适用性与种间特异性,以确定该引物与是否能满足检测的需要。
进行小麦正品与伪品的实时荧光PCR反应,实时荧光反应体系见表5、表6,实时荧光反应结果见结果见图2。

图2 小麦CM16过敏原实时荧光PCR结果
Fig.2 Real-time PCR results of wheat CM16 allergen
结果显示,XM1-XM5五个含目标基因的正品有扩增曲线,XM6-XM13不含目标基因的伪品无扩增曲线,表明引物探针特异性满足检测要求。
进行榛子正品与伪品的实时荧光PCR反应,实时荧光反应体系见表5、6,实时荧光反应结果见结果见图3。

图3 榛子Cor a 1过敏原实时荧光PCR结果
Fig.3 Real-time PCR results of hazelnut Cor a 1 allergen
结果显示,ZZ1-ZZ5五个含目标基因的正品有扩增曲线,ZZ6-ZZ14九个不含目标基因的伪品无扩增曲线,表明引物探针特异性满足检测要求。
2.4 方法重复性验证
通过换用Transgen的实时荧光PCR预混液,在相同的实验条件下,对方法进行重复性验证,结果见图4、图5。

图4 小麦CM16过敏原重复性验证
Fig.4 Repeatability verification of wheat CM16 allergen

图5 榛子Cor a 1过敏原重复性验证
Fig.5 Repeatability verification of of hazelnut Cor a 1 allergen
重复性验证结果表明,在使用不同试剂盒时,同样的实验条件下均可获得一致的检测结果,证明本方法的重复性可满足检测要求。
2.5 方法检出限验证
为了确定方法的检出限,我们将小麦、榛子烘干后,用球磨仪研成粉末状,并与其他样品粉末混匀,进行DNA提取,具体混样信息见表2,以确定本实验建立的方法检测灵敏度。具体检测结果见图6、图7、表7。

图6 小麦过敏原检出限实时荧光PCR结果
Fig.6 RT-PCR results of wheat allergens LOD

图7 榛子过敏原检出限实时荧光PCR结果
Fig.7 RT-PCR results of hazelnut allergens LOD

表7 检出限实时荧光PCR结果及判定Table 7 RT-PCR results and determine of LOD
结果显示,10%浓度、1%浓度的小麦和榛子样品检测CT值在35以下,判定为含有小麦(或榛子)过敏原成分;而0.1%浓度的小麦和榛子样品检测CT值在35以上,判定为不含小麦(或榛子)过敏原成分。表明本实验建立的方法可以准确检测过敏原成分含量在1%以上的样品,即方法的检出限为1%。
2.6 方法适用性验证
为了验证方法的可靠性与适用性,我们选择了60批预包装样品(具体信息见表3),进行方法的验证实验,结果见表8和表9。
对样品进行DNA提取,经检测DNA浓度均在10~100 ng/μL之间,A260/280均在1.7~1.9之间。我们建立了内参验证实验,进行18Sr RNA验证,以保证60批样品的DNA均可用于实时荧光PCR检测,验证结果见图8。

图8 样品18S rRNA内参实验
Fig.8 18S rRNA reference experiment
根据实验荧光PCR结果可以看出,60批预包装样品的DNA结果理想,内参实验全部成功,CT值均在13~20之间,空白对照无CT值,表明所提取的DNA可用于实时荧光PCR检测。
对30批XQ编号样品进行小麦过敏原CM16实时荧光检测法的适用性验证,验证结果见图9、表8。

图9 小麦CM 16实时荧光结果
Fig.9 RT-PCR results of wheat CM16

表8 小麦CM 16实时荧光结果Table 8 RT-PCR results of wheat CM16
结果显示,实时荧光判定结果与样品实际情况一致,含有小麦麸质样品均检出CT值,判定为含有过敏原成分;不含小麦麸质的样品CT值均>35或无CT值,判定为不含小麦过敏原成分,适用性验证结果符合预期,表明本实验建立的方法可用于小麦过敏原成分检测的常规应用。
对30批ZZ编号样品进行榛子过敏原Cora1实时荧光检测法的适用性验证,验证结果见图10、表9。

图10 榛子Cor a 1实时荧光PCR结果
Fig.10 RT-PCR results of hazelnut Cor a 1

表9 榛子Cor a 1基因实时荧光结果Table 9 RT-PCR results of hazelnut Cor a 1
结果显示,实时荧光判定结果与样品实际情况一致,含有榛子油质蛋白过敏原成分的样品均检出CT值,判定为含有榛子过敏原成分;不含榛子油质蛋白过敏原成分的样品CT值均>35或无CT值,判定为不含榛子过敏原成分,适用性验证结果符合预期,未出现假阳性或假阴性现象,表明本实验建立的方法可用于榛子过敏原成分检测的常规检测。
3 结论
通过对本研究所建立的方法进行讨论分析,我们发现,实验室建立的实时荧光PCR检测方法可以准确、高效地检测样品中的小麦、榛子过敏原成分,其特异性好,操作简便,适用性广,对市售常见预包装食品均可准确检测过敏原成分,可以作为过敏原检测的常规检测方法。
由于免疫学检测方法的准确性和特异性主要依赖于抗体识别食物过敏原,但某些食品工业常利用热加工、超高压和酶解等深加工技术使过敏原蛋白发生变性和降解,而蛋白质结构的改变又可干扰蛋白提取物或抗体结合部位,同时会导致假阴性结果的出现[18];此外,由于某些过敏原缺少特异性的单克隆抗体,无法利用ELISA法进行检测。而新兴的质谱、SPR等技术所需的设备相对昂贵,并且对样品要求较高,不适合作为普通实验室及快检实验室的常规检测手段,因此在过敏原检测方面限制了其应用。
实时荧光PCR法作为一种新型检测技术,在过敏原检测中发挥了越来越重要的作用。它有效地解决了免疫学方法存在的无法检测加工食品、假阴性率高等问题,并且仪器较为廉价,对人员经验及操作要求较低,且检测成本极低,准确率高,重复性好,适用性强,遍于普及应用。因此,实时荧光PCR法将是过敏原检测的重要发展方向,我们初步建立了小麦、榛子的过敏原检测方法,并适当调整了方法的检出限,以降低检测误判所带来的风险。同时,我们建立了过敏原基因的数据库,为将来的实时荧光PCR检测方法开发提供了理论基础与数据支持。
