溶氧对耶氏解脂酵母油脂积累和柠檬酸分泌的影响
2018-04-12亢新鑫杨俊换张怀渊宋元达
亢新鑫,杨俊换,张怀渊,宋元达
(山东理工大学农业工程与食品科学学院,山东淄博 255000)
产油微生物是指在特定条件下能将碳水化合物转化为油脂并以脂滴的形式储存在细胞内的一些微生物,主要用来生产特殊用途的油脂或者是附加值较高的功能性油脂[13]。微生物油脂与传统的动植物油脂相比较具有众多优势[46]:微生物细胞生长迅速,发酵周期短;生长所需原料来源广泛,不占用耕地;有利于保护环境等。产油微生物中研究最多的物种是耶氏解脂酵母(Yarrowialipolytica),在一定的培养条件下可以利用碳源发酵生产脂肪酸和有机酸等[78]。耶氏解脂酵母的产油量可以达到细胞干重的36%以上,其脂肪酸组成与一般的植物油相类似,以C16和C18为主[910],同时耶氏解脂酵母发酵过程中会产生大量的有机酸,以柠檬酸为主[1112]。目前大量的研究集中于耶氏解脂酵母的油脂积累和柠檬酸分泌的代谢调控,耶氏解脂酵母发酵过程中的碳源经糖酵解途径和三羧酸循环产生柠檬酸,产生的柠檬酸一部分参与油脂的合成,另一部分转运出细胞外(图1)。Tai等[13]同时过表达了二酰基甘油酰基转移酶(DGA1)和乙酰辅酶A羧化酶(ACC1),使得耶氏解脂酵母细胞内的油脂含量达到细胞干重的61.7%,油脂含量增加了5倍,而产生的柠檬酸减少到5 g/L。Liu等[14]以玉米浆代替酵母提取物作为唯一的有机氮源时,耶氏解脂酵母SWJ1b丙酮酸脱羧酶的活性增加,使得柠檬酸的产量增加了1.24倍。
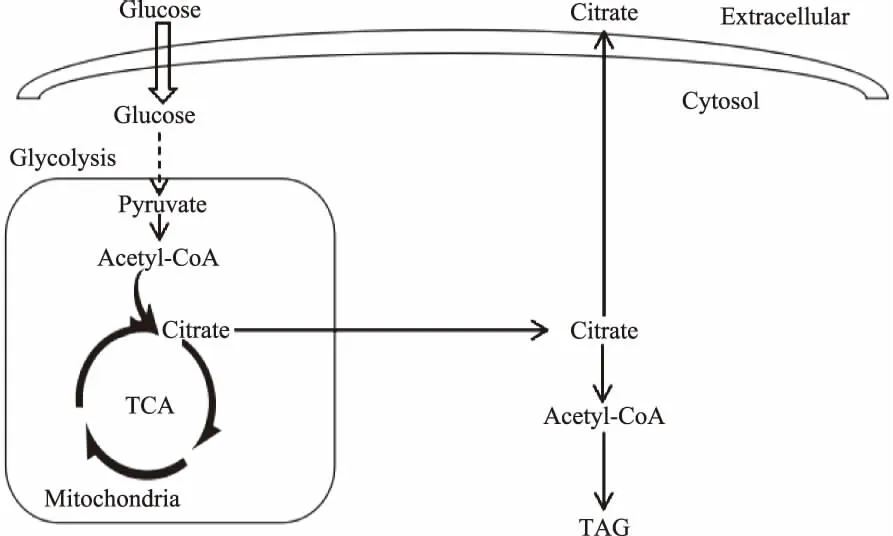
图1 耶氏解脂酵母油脂积累和柠檬酸分泌的代谢途径Fig.1 Metabolic pathway of lipid accumulation and citrate secretion in Yarrowia lipolytica
好氧性微生物在发酵过程中溶氧对菌体生长和代谢产物的产量影响极大[15],李佳伟[16]等将黑曲霉发酵前期搅拌转速控制为600 r/min,发酵中后期搅拌转速控制为500 r/min,柠檬酸产量达到141 g/L,比恒定转速500 r/min提高了8.5%;李小鑫等[17]将地衣芽孢杆菌发酵培养基中溶氧含量控制在30%时,γ聚谷氨酸的产量达到了39.9 g/L。耶氏解脂酵母在生长和油脂积累过程中是需要氧气的参与,溶氧是油脂积累和柠檬酸分泌发酵过程中的一个重要参数。
本文将耶氏解脂酵母在5 L发酵罐中培养,并通过搅拌转速和通气量关联来控制发酵过程中培养基的溶氧含量,分别研究溶氧含量为5%、10%、20%、30%和不控制时对耶氏解脂酵母的生长、油脂含量和柠檬酸产量的影响,以期为耶氏解脂酵母发酵过程的溶氧含量的优化提供一定的实验基础。
1 材料与方法
1.1 材料与仪器
耶氏解脂酵母CICC 1778(=ATCC 20460) 购于中国工业微生物菌株保藏中心;正己烷(色谱纯) 国药集团化学试剂有限公司;脂肪酸标准品、柠檬酸标准品 Sigma公司;葡萄糖测定试剂盒 型号:361510,上海荣盛生物药业有限公司;柠檬酸含量测定试剂盒 型号:QS2101,上海索桥生物科技有限公司;试剂A(苯酚10 g/L,硝普钠50 mg/L)、试剂B(氢氧化钠5 g/L,次氯酸钠420 mg/L)、葡萄糖、硫酸铵、甲醇等 均为分析纯。
Bioflo310 5 L全自动发酵罐 德国Eppendorf公司;6890N气相色谱仪 美国Agilent Technologies公司;5424R台式冷冻离心机 德国Eppendorf公司;SX500高压蒸汽灭菌锅 日本TOMY公司;真空冷冻干燥机 美国Labconco公司;UV2450紫外分光光度计 日本岛津公司。
1.2 实验方法
1.2.1 培养基的配制 种子培养基YNBD(g/L):葡萄糖10.0,无氨基酸和硫酸铵的酵母氮源1.7,硫酸铵5.0,121 ℃灭菌20 min;发酵培养基(g/L):葡萄糖90.0,硫酸铵2.0,酵母提取物1.0,无氨基酸和硫酸铵的酵母氮源1.5,121 ℃灭菌20 min[13]。
1.2.2 耶氏解脂酵母发酵培养 耶氏解脂酵母的发酵培养参考Mitchell的培养方法[13],从冻存管中(80 ℃)吸取100 μL菌液接种至含有5 mL YNBD液体培养基的试管中,于200 r/min,28 ℃振荡培养48 h。以体积比为10%的接种量接入含有300 mL YNBD培养基的1 L锥形瓶中,200 r/min,28 ℃恒温于摇床中培养48 h,制得种子液。
整个发酵过程在常压下进行,将种子液以10%的接种量接入装有3 L发酵培养基的发酵罐(5 L)中,初始发酵条件:转速为300 r/min,通气量6.0 vvm,恒温28 ℃,恒定pH(6.8±0.05)(0.1 mol/L HCl和0.2 mol/L NaOH调控),发酵时间120 h。发酵初始阶段标定溶氧为100%,发酵14 h后通过溶氧含量与搅拌转速、通气量的关联,调整发酵罐溶氧含量(DO)分别为5%,10%,20%,30%和不控制(DOC)。不控制溶氧是发酵过程中转速恒为300 r/min,通气量恒为6.0 vvm。
1.2.3 生物量的测定 准确吸取4 mL菌液于准确称量的离心管(m1)中,4000 r/min离心10 min,收集菌体,蒸馏水洗涤2次,冷冻干燥后准确称量(m2),二者重量的差别(m2m1)的250倍即生物量(单位,g/L)。
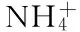
1.2.5 柠檬酸产量的测定 发酵过程中柠檬酸的测定按照柠檬酸含量测定试剂盒操作,具体如下:试剂一置于30 ℃水浴中预热30 min。取EP管,依次加入100 μL不同浓度的柠檬酸标准液、700 μL试剂一、100 μL试剂四、100 μL试剂五,混匀后室温静置30 min,于545 nm测定吸光度,制备标准曲线(y=0.0009x0.0007,R2=0.9995)。样品的测定根据需要进行稀释,充分混匀,11000 r/min,4 ℃离心10 min,取上清液按上述方法进行测定,重复3次。糖酸转化率(%)=发酵上清液中柠檬酸产量/葡萄糖总消耗量×100。
1.2.6 油脂的提取与含量的测定 油脂的提取参考Folch等的提取方法[19],准确吸取1 mL菌液放于提脂瓶中,4000 r/min离心10 min,收集菌体,用蒸馏水洗涤2次,尽量去掉上清。加入6 mol/L的盐酸2 mL,充分混匀,80 ℃水浴3 h,加入2 mL氯仿、1 mL甲醇,同时加入100 μL脂肪酸标准品C15∶0作为内参,充分混匀后离心,吸取下层液体至新的提脂瓶中,氮气吹干,加入1 mL 10%的盐酸甲醇(w/w),充分混匀,60 ℃水浴3 h,加入2 mL正己烷和1 mL饱和NaCl溶液,充分混匀后离心,吸取1 mL上层液体至气相瓶中,通过气相色谱法测定油脂含量及其脂肪酸组成,重复3次。通过比较各个脂肪酸和脂肪酸标准品C15∶0的峰面积,计算油脂总量及各脂肪酸组成。计算糖油转化率(%)=油脂产量/葡萄糖总消耗量×100。
气相色谱条件:不分流进样,色谱柱是DM-FFAP(30 m×0.32 mm,0.22 μm),氢离子火焰检测器,载气为氮气,气化室温度和检测器温度均为250 ℃,进样量1 μL。升温程序:初温80 ℃,先以8 ℃/min的升温速率升至200 ℃,再以1 ℃/min升温速率升至205 ℃,最后以4 ℃/min的升温速率升至240 ℃,保持5 min。
1.3 数据处理
实验中每个数据测定均重复3次,采用SPSS 13.0进行统计学分析,应用GraphPad Prism 5软件作图。
2 结果与分析
2.1 溶氧含量对耶氏解脂酵母生物量的影响
由图2可知,耶氏解脂酵母在不同溶氧含量的发酵培养基中生长,酵母菌的生长趋势基本一致,种子液接入发酵培养基后快速进入对数期,并在24 h左右进入稳定期。整个发酵过程溶氧含量对生物量的影响不明显。由图2可看出,溶氧含量控制在10%以上时,耶氏解脂酵母的生物量随着溶氧含量的增加而增加,且不控制溶氧含量时,生物量达到最大,基本稳定在16 g/L左右。而发酵后期(96~120 h)生物量均有下降,可能是因为培养基中的碳源耗尽后,酵母消耗了自身储存的物质来维持细胞正常的代谢活动。
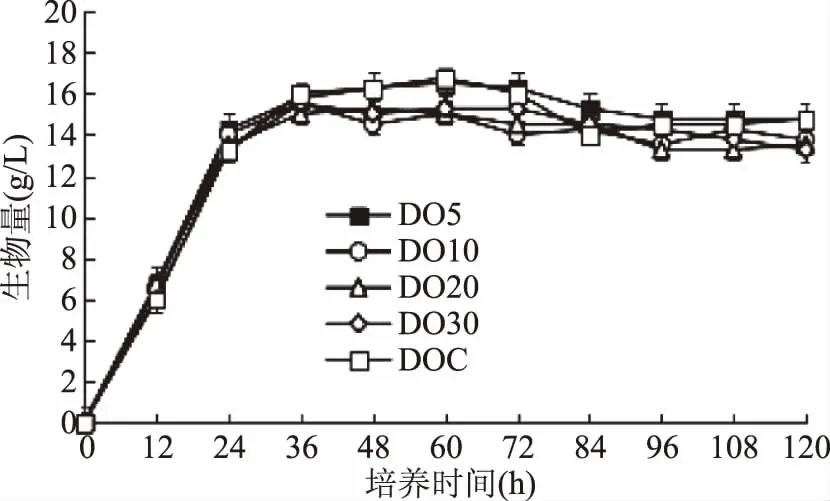
图2 不同溶氧含量下耶氏解脂酵母生物量的变化Fig.2 Biomass of Y. lipolytica cultivated under different DO levels
2.2 溶氧含量对葡萄糖浓度和浓度的影响
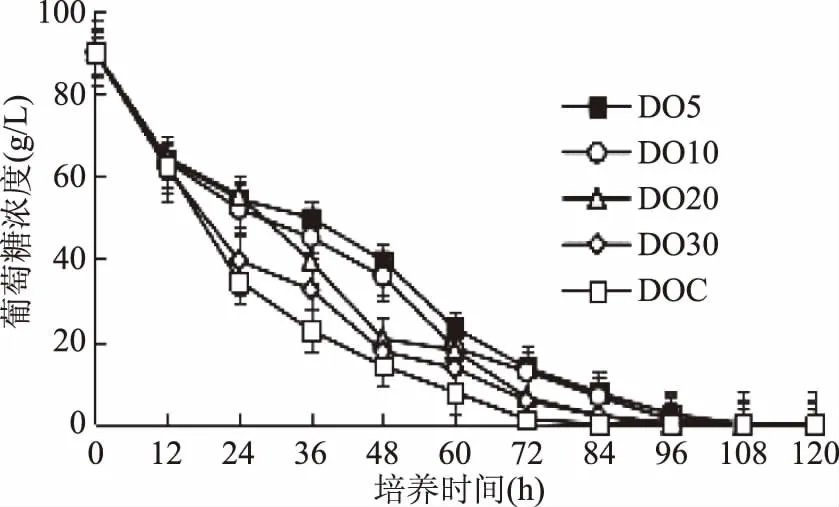
图3 不同溶氧含量下发酵培养基中葡萄糖浓度的变化Fig.3 Residual glucose concentration in the culture medium under different DO levels
2.3 溶氧含量对耶氏解脂酵母柠檬酸分泌的影响
当耶氏解脂酵母发酵培养过程中的氮源耗尽且碳源充足时,酵母会将过量的碳源转变为柠檬酸,而积累的柠檬酸会被转运出细胞外。由图4可以看出,发酵时间在24~96 h时,柠檬酸的积累速度加快。而且柠檬酸的产量随着发酵培养基中溶氧含量的增大而增加,而不控制溶氧含量且发酵时间为120 h时柠檬酸的积累量达到最大,为21.00 g/L,糖酸转化率为23.33%。

图4 不同溶氧含量下发酵过程中柠檬酸产量的变化Fig.4 Citric acid concentration in the medium of Y. lipolytica cultivated under different DO levels
2.4 溶氧含量对耶氏解脂酵母油脂积累和脂肪酸组成的影响
耶氏解脂酵母细胞内油脂的积累主要是通过限制培养基中的氮源,当氮源耗尽且碳源充足时会在细胞内积累大量的油脂。在5种溶氧含量发酵条件下,酵母细胞逐渐利用培养基中葡萄糖并转化为油脂储存在细胞内,且在发酵时间为96 h时,细胞内油脂含量达到最大。如图5所示,耶氏解脂酵母细胞内的油脂含量随着发酵培养基中溶氧含量的增大而增加,在不控制溶氧时,耶氏解脂酵母细胞的产油量达到最大,占细胞干重的11.62%(96 h),糖油转化率为1.87%。而随着发酵培养基中葡萄糖的耗尽,油脂的含量略有下降,这是由于当培养基中的碳源消耗完全时,酵母可以利用细胞内储存的油脂作为碳源,维持自身的生长,这与Bellou[21]和Makril[22]等的研究相符。
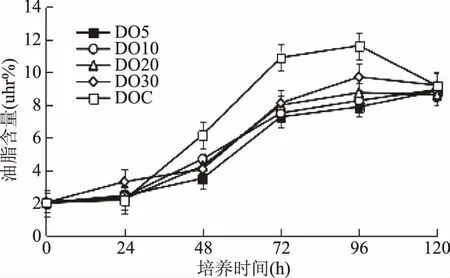
图5 不同溶氧含量下耶氏解脂酵母细胞内油脂含量的变化Fig.5 Lipid contents of Y. lipolytica cultivated under different DO levels
所提取油脂气相色谱分析结果如表1所示,耶氏解脂酵母发酵产生的脂肪酸主要有软脂酸(C16∶0)、棕榈油酸(C16∶1)、硬脂酸(C18∶0)、油酸(C18∶1)和亚油酸(C18∶2),并且发酵过程中溶氧含量对耶氏解脂酵母细胞内的脂肪酸组成影响较大。发酵时间为96 h时,软脂酸(C16∶0)的含量随着溶氧的增大而减少,油酸(C18∶1)的含量随着溶氧的增大而增加。在不控制培养基溶氧含量时,软脂酸和油酸的含量分别为20.13%和48.62%,与溶氧含量为5%时相比,软脂酸的含量减少了14.31%,油酸的含量提高了12.31%。细胞内多不饱和脂肪酸的形成需要分子氧作为电子受体参与反应,因此,耶氏解脂酵母发酵过程中溶氧含量的增加可能会促使多不饱和脂肪酸含量的增加。
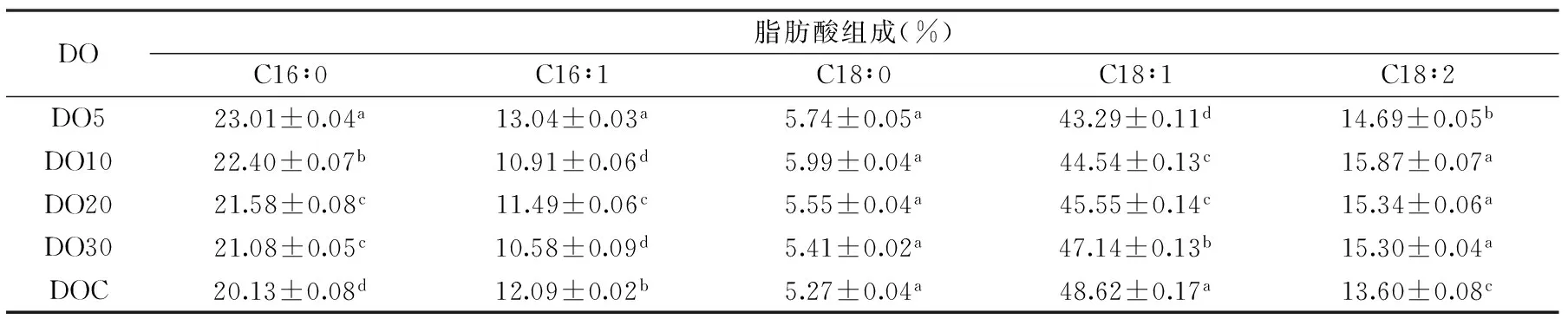
表1 不同溶氧含量下耶氏解脂酵母细胞内脂肪酸组成Table 1 The fatty acid profile in Yarrowia lipolytica under different DO levels
3 讨论
关于耶氏解脂酵母的研究主要集中在油脂积累和柠檬酸分泌调控等方面,研究表明发酵培养基中溶氧含量的增加可有效提高耶氏解脂酵母发酵产物的含量。Lopes发现提高耶氏解脂酵母发酵培养基中的氧传递速率,可使产物脂肪酶的产量从96.6 U/L提高到533.5 U/L[23];控制耶氏解脂酵母发酵过程中的转速在400~900 r/min之间,通气量在0.18~0.6 vvm之间,可使柠檬酸产量达到92.8 g/L[24]。本研究结果符合上述结论,随着培养基中溶氧含量的增大耶氏解脂酵母的发酵产物油脂含量和柠檬酸分泌量均有所增加,油脂含量和柠檬酸的产量分别提高了47.84%和172%(表2)。葡萄糖经过糖酵解途径和三羧酸循环产生NADH和FADH2,需要经过电子呼吸链将氢离子传递给氧气,并产生大量的ATP,其中糖酵解途径的部分反应需要ATP的参与。细胞在缺氧的条件下,NADH和FADH2不能彻底被转化为ATP,提供给糖酵解的ATP减少,葡萄糖的消耗速率也降低(图3),而三羧酸循环产生的柠檬酸也会减少,所以柠檬酸的分泌量降低(图4)。而柠檬酸裂解产物乙酰辅酶A还是油脂合成的底物之一,油脂合成途径中需要消耗大量的ATP,而且,不饱和脂肪酸的合成需要氧气的参与,因此培养基中氧气的限制会降低细胞内油脂的合成(图5)。耶氏解脂酵母发酵过程中油脂和柠檬酸积累速度不同步,发酵时间在48~72 h时,细胞内的油脂快速积累;发酵时间在72~96 h时,柠檬酸也快速积累并分泌到细胞外,这与Carlos的研究一致[25]。同时,随着培养基中溶氧含量的增加,软脂酸(C16∶0)的含量减少,油酸(C18∶1)的含量增多。因此,可以通过控制发酵过程中的溶氧,微调脂肪酸代谢流向,得到产率更高的不饱和脂肪酸。
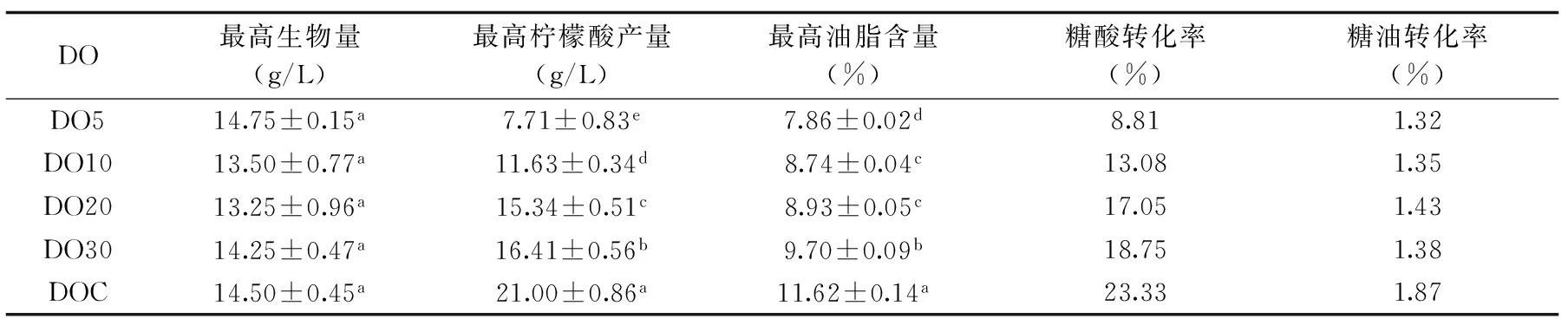
表2 不同溶氧含量下耶氏解脂酵母柠檬酸分泌量和油脂含量的比较Table 2 Citric acid and lipid content under different DO levels
4 结论
在发酵罐中培养耶氏解脂酵母,并通过转速和通气量的关联来控制发酵过程中的溶氧含量,实验结果显示培养基中溶氧含量越高耶氏解脂酵母的产油量和柠檬酸分泌量越大,同时溶氧含量还会影响油脂的脂肪酸组成,导致油脂的不饱和脂肪酸含量增加。本研究为耶氏解脂酵母产脂发酵过程的溶氧含量的控制提供了一定的实验基础。
[1]Xin Meng,Yang Jianming,Xu Xin,et al.Biodiesel production from oleaginous microorganisms[J].Renewable Energy,2009,34(1):15.
[2]颜治,陈晶.微生物油脂及其开发利用研究进展[J].粮食与油脂,2003,16(7):1315.
[3]Ratledge C.Regulation of lipid accumulation in oleaginous microorganisms[J].Biochemical Society Transactions,2002,30(6):10471050.
[4]Chen Y,Ding Y,Yang L,et al.Integrated omics study delineates the dynamics of lipid droplets inRhodococcusopacusPD630[J].Nucleic Acids Research,2014,42(2):10521064.
[5]相光明,刘建军,赵祥颖,等.微生物油脂研究进展[J].粮油加工,2008,9(9):5660.
[6]陈文娜,陈慧,彭宽.微生物油脂发酵技术研究现状[J].粮食与油脂,2014,27(1):1821.
[7]Liu HuHu,Madzak C,Sun MeiLi,et al.EngineeringYarrowialipolyticafor arachidonic acid production through rapid assembly of metabolic pathway[J].Biochemical Engineering Journal,2017,119(7):5258.
[8]LedesmaAmaro R,Nicaud J M.Metabolic Engineering for expanding the substrate range ofYarrowialipolytica[J].Trends in Biotechnology,2016,34(10):798809.
[9]Cristiano E,Zhang Jianguo,Hu Bo.Lipid accumulation by pelletized culture ofMucorcircinelloideson corn stover hydrolysate[J].Applied Biochemistry Biotechnology,2014,174(1):411423.
[10]Gitte S,Dennis V,Anna K,et al.Microbial growth studies in biodiesel blends[J].Bioresource Technology,2011,102(8):52595264.
[11]Ferreira P,Lopes M,Mota M,et al.Oxygen mass transfer impact on citric acid production byYarrowialipolyticafrom crude glycerol[J].Biochemical Engineering Journal,2016,110(7):3542.
[12]Liu Huhu,Ji Xiaojun,Huang He.Biotechnological applications ofYarrowialipolytica:past,present and future[J]. Biotechnology Advances,2015,33(8):15221546.
[13]Tai M,Stephanopoulos G.Engineering the push and pull of lipid biosynthesis in oleaginous yeastYarrowialipolyticafor biofuel production[J].Metabolic Engineering,2013,15(1):19.
[14]Liu Xiaoyan,Wang Xinfeng,Xue Jiaxing,et al.Citric acid production byYarrowialipolyticaSWJ1b using corn steep liquor as a source of organic nitrogen and vitamins[J].Industrial Crops and Products,2015,78(19):154160.
[15]秦晴.溶氧对木薯为原料发酵生产柠檬酸的影响[J].甘肃农业科技,2016,44(12):3536.
[16]李佳伟,刘龙,李江华,等. 两阶段搅拌转速控制策略发酵生产柠檬酸[J]. 食品与生物技术学报,2014,33(2):131136.
[17]李小鑫,高明昊,张苗苗,等.溶氧对γ聚谷氨酸合成的影响[J].中国生物工程杂志,2015,35(3):4248.
[18]Wu S,Hu C,Zhao Xin,et al.Phosphatelimitation mediated lipid production byRhodosporidiumtoruloides[J].Bioresource Technology,2010,101(15):61246129.
[19]Folch J,Lees M,SloaneStanley G,et al.A simple method for the isolation and purification of total lipids from animal tissues[J].Biol Chem,1957,226(1):497509.
[20]Timoumi A,Bideaux C,Guillouet SE,et al. Influence of oxygen availability on the metabolism and morphology ofYarrowialipolytica:insights into the impact of glucose levels on dimorphism[J].Applied Microbiology and Biotechnology,2017,101(19):73177333.
[21]Bellou S,Makri A,Sarris D,et al.The olive mill waste water as substrate for single cell oil production byZygomycetes[J]. Journal of Biotechnology,2014,170(8):5059.
[22]Makri a,Fakas S,Aggelis G.Metabolic activities of biotechnological interest inYarrowialipolyticagrown on glycerol in repeated batch cultures[J].Bioresource Technology,2010,101(7):23512358.
[23]Lopes M,Gomes N,Gonçalves C,et al.Yarrowialipolyticalipase production enhanced by increased air pressure[J].Lett Appl Microbiol,2008,46(2):255260.
[24]Rywińska A,MusiaI,Zarowska B,et al.Effect of agitation and aeration on the citric acid production byYarrowialipolyticagrown on glycerol[J].Biochemistry Biotechnology,2012,42(3):279291.
[25]Carlos E R,Carine B,Stéphane E,et al.Dynamic metabolic modeling of lipid accumulation and citric acid production byYarrowialipolytica[J].Computers and Chemical Engineering,2017,100(10):139152.
