柘树植物酵素中氨基酸分析及抗氧化性能研究
2018-04-12程勇杰陈小伟张沙沙王珍珍毛旸晨沙如意毛建卫
程勇杰,陈小伟,张沙沙,楼 坚,张 婷,王珍珍,毛旸晨,沙如意,*,毛建卫,*
(1.浙江科技学院生物与化学工程学院,浙江杭州 310023;2.浙江省农产品化学与生物加工技术重点实验室,浙江杭州 310023;3.浙江省农业生物资源生化制造协同创新中心,浙江杭州 310023;4.杭州医学院,浙江杭州 310053)
食用植物酵素(Plant Jiaosu)是以一种或多种新鲜蔬菜、水果、谷豆类、海藻类、药食两用本草类等食材为原料,加(或不加)糖类物质,经多种有益菌通过较长时间发酵而生产的功能性微生物发酵产品[14],含有丰富的次生代谢产物、植物本身营养成分和益生菌等功能成分,特别是小分子功能成分[57]。
氨基酸是食用植物酵素品质的组成成分之一。蛋白质并不能被人体直接利用,而是在消化酶的作用下分解成低分子的多肽或氨基酸才被吸收利用。氨基酸可以保持体内总氮平衡、转化成糖或者脂肪以提供能量以及参与激素、酶等的合成[89]。氨基酸不仅是合成蛋白质的物质基础,还可以保障机体正常的新陈代谢,维持生命。无论人体缺乏任何一种必需氨基酸还是非必需氨基酸,都会导致代谢功能的异常,产生代谢功能障碍,甚至产生某些疾病[10]。目前对于食用植物酵素中的氨基酸研究甚少,且氨基酸的种类多,含量差别大,影响因素多,这些都直接影响了对食用植物酵素功能性的评价。
柘树(CudraniatricuspidataBur.)为桑科(Moraceae)柘属(Cudrania)植物[11]。柘树植物全身都是宝,其茎皮可作造纸原料,木材可作染料,心材可作高档家具,叶可来饲喂蚕虫,根皮可药用,治肾虚耳鸣、腰膝冷痛、黄痘、疮巧、咯血等[1214]。柘树果实可煎汤内服亦可直接食用,可外敷,具有清凉活血,舒经活络的作用[15]。目前从柘树植物中分离出大量异戊烯基氧杂蒽酮化合物、黄酮类化合物、异黄酮类化合物和生物碱[1619]等具有显著的抗氧化、抑菌、抗炎、抗肿瘤等[2022]生物活性。国外仅有少数关于柘树提取物抗氧化活性及其在防止肥胖上的应用研究报道[2325],国内对柘树植物活性物研究极少,对于柘树的果实、花和叶子及加工利用的研究尚未见报道。本文以柘树为原料制备食用植物酵素,研究其发酵产物中氨基酸成分变化与抗氧化的相关性,对于柘树的高值化生物利用具有重要的意义。
1 材料与方法
1.1 材料与仪器
柘树小青果、花、叶 2016年5月10日采自浙江省长兴县柘树合作社;复合糖浆 浙江省农产品化学与生物加工技术重点实验室制备;盐酸(优级纯)、重蒸苯酚(分析纯)、柠檬酸钠缓冲液、柠檬酸(优级纯)、氢氧化钠(优级纯)、冰乙酸(色谱纯)、茚三酮(分析纯)、抗坏血酸(分析纯) 国药化学试剂有限公司(上海,中国);α,α二苯基β-苦苯肼(DPPH)、2,2联氮基双(3乙基苯并噻唑啉6-磺酸)二氨盐(ABTS) 美国Sigma公司;混合氨基酸标准液 日本和光纯业工业株式会社。
PHS3C精密酸度计 杭州齐威仪器有限公司;HZTB3002电子称、PTXFA210电子天平 福州华志科学仪器有限公司;GZX9140MBE电热恒温鼓风干燥箱 上海博讯实业有限公司医疗设备厂;SWCJ型超净工作台 无锡易纯净化设备有限公司;KQ300E型超声波清洗器 昆山市超声仪器有限公司;L8900氨基酸自动分析仪 日本日立公司;真空干燥箱 上海博讯实业有限公司医疗设备厂。
1.2 实验方法
1.2.1 柘树植物酵素的制备 用无菌水轻轻冲洗除去柘树小青果、花和叶表面的沙子和灰尘,常温晾干。柘树小青果、花和叶分别与糖浆按质量比3∶4,加入到已灭菌的玻璃发酵瓶中,封口,放在暗处,常温下发酵150 d,取液体样,于10000 r/min离心10 min后,保留上清液待用。
1.2.2 氨基酸定性定量分析 氨基酸分析的条件参考国标GB/T 5009.1242003[26],略有改进,具体分析条件如下:氨基酸分析仪;色谱柱:磺酸型阳离子树脂分离柱(4.6 mm×60 mm×3 μm);检测器:荧光检测器;流动相:柠檬酸柠檬酸钠缓冲液;流速:0.4 mL/min;分离柱柱温:57 ℃;反应柱柱温:135 ℃;进样量:20 μL;检测波长:通道一570 nm,通道二440 nm。
取1 mL样品加到玻璃水解管中,加入10 mL 6 mol/L的HCl溶液,加重蒸酚3~4滴,冷却5 min,向水解管中充入一定量的氮气,在氮气环境下迅速封管,在110 ℃下水解22 h。冷却之后打开水解管,将水解液全部移至50 mL容量瓶中,用去离子水清洗、过滤及定容。再取2 mL滤液真空干燥,反复2次,最后蒸干,然后加0.02 mol/L柠檬酸钠缓冲液1 mL,过0.22 μm滤膜过滤后上机。
采用外标法测定柘树三种酵素的氨基酸种类及含量。
1.2.3 营养评价 氨基酸的含量以浓度(mg/mL)表示,计算样品中的必需氨基酸的比值(RAA)、氨基酸比值系数(RC)及比值系数分(SRC)。其中RAA及RC的数值越趋向1,表示该样品的氨基酸越接近WHO/FAO的推荐值;SRC作为评判营养价值的指标,其值越接近100,则表示该样品的各种必需氨基酸的含量越均衡,营养价值就越高[2729]。
1.2.4 ABTS自由基清除能力测定 参考Re R[30]的方法,略有改动。将过硫酸钾溶液加入到7 mmol/L ABTS(用5 mmol/L的pH7.4的磷酸盐缓冲液配制),使得ABTS最终浓度为2.45 mmol/L,在室温下黑暗处放置12~16 h。使用前利用PBS缓冲液将ABTS溶液稀释至吸光度为0.7±0.02(734 nm)。
分别取1、2、3、4、5 μL样品,添加磷酸盐缓冲液至300 μL,再加入5 mL上述ABTS稀释液,在30 ℃下,反应1 h。以去离子水为参比溶液,以VC(4 mg/mL)为对照。在734 nm下测定吸光度,并计算IC50。
ABTS自由基清除能力(%)=[1(A1A2)/(A0A2)]×100
式中:A0:空白对照液的吸光度;A1:样品测定管的吸光度;A2:样品本底管的吸光度。
1.2.5 DPPH自由基清除能力测定 参考Blois[31]方法,略有改进,具体方法如下:分别取5、10、15、20、25、30 μL样品,加纯水至2 mL,分别加入到4 mL 0.1 mmol/L DPPH甲醇溶液中,再加入450 μL 50 mmol/L TrisHCl buffer,25 ℃下恒温水浴30 min。以去离子水为参比溶液,以VC(4 mg/mL)为对照。在517 nm下测定吸光度,并计算IC50。
DPPH自由基清除能力(%)=[1(B1B2)/(B0B2)]×100
式中:B0:空白对照液的吸光度;B1:样品测定管的吸光度;B2:样品本底管的吸光度。
1.2.6 羟基自由基清除能力测定 参考Liu W[32]方法,略有改进,具体方法如下:分别取25、50、100、150、200 μL样品,加纯水至2 mL,再加入1.4 mL 6 mmol/L H2O2溶液,然后加入0.6 mL 20 mmol/L 水杨酸钠和2 mL 1.5 mmol/L硫酸亚铁,混匀,37 ℃下恒温水浴1 h。以去离子水为参比溶液,以VC(8 mg/mL)为对照。在510 nm下测定吸光度,并计算IC50。
羟基自由基清除能力(%)=[1(C1C2)/(C0C2)]×100
式中:C0:空白对照液的吸光度;C1:样品测定管的吸光度;C2:样品本底管的吸光度。
1.2.7 还原力测定 参考Yildirim[33]方法,略有改进,具体方法如下:分别取5、10、15、20、25 μL样品加磷酸缓冲液(0.2 mol/L,pH6.6)至2.5 mL,然后加入2.5 mL 1%铁氰化钾,混合均匀,50 ℃下恒温水浴30 min,再加入2.5 mL 10%三氯乙酸,混合均匀,静置10 min,立即取2.5 mL上清液,加入2.5 mL去离子水和0.5 mL 0.1%三氯化铁,混匀,以去离子水为参比溶液,以VC(4 mg/mL)为对照。在700 nm下测定,并计算IC50(吸光度为0.5)。吸光度值越高则表示还原力越强。
1.3 数据处理
实验中每个处理重复三次,数据以平均值±标准差的形式呈现(n=3),采用单因素方法分析进行显著性差异分析,采用SPSS 16.0软件进行数据的IC50计算以及相关性分析,应用Excel软件制图。
2 结果与分析
2.1 色谱分析
氨基酸标品的色谱图见图1,从图1中可以看出各种氨基酸可以有效分离。由表1可以看出,柘树小青果、柘树花、柘树叶三种酵素中含有丰富的氨基酸,其总含量分别为12.667、2.870、1.198 mg/mL,其中人体必需的八种氨基酸(赖氨酸、色氨酸、苯丙氨酸、苏氨酸、异亮氨酸、亮氨酸、缬氨酸、蛋氨酸)总含量分别为4.156、0.943、0.479 mg/mL,营养价值丰富。柘树小青果酵素、柘树花酵素和柘树叶酵素中的氨基酸主要是以天冬氨酸、丝氨酸、谷氨酸、甘氨酸、丙氨酸、缬氨酸、异亮氨酸、亮氨酸和赖氨酸为主;半胱氨酸和蛋氨酸含量极少,柘树叶酵素中在检测限范围内未检出半胱氨酸和蛋氨酸;柘树小青果酵素和柘树花酵素含有17种氨基酸,柘树小青果酵素无论在氨基酸总量还是单个氨基酸含量均显著高于柘树花酵素和柘树叶酵素。

图1 氨基酸标准品色谱图Fig.1 Chromatogram of standard amino acids
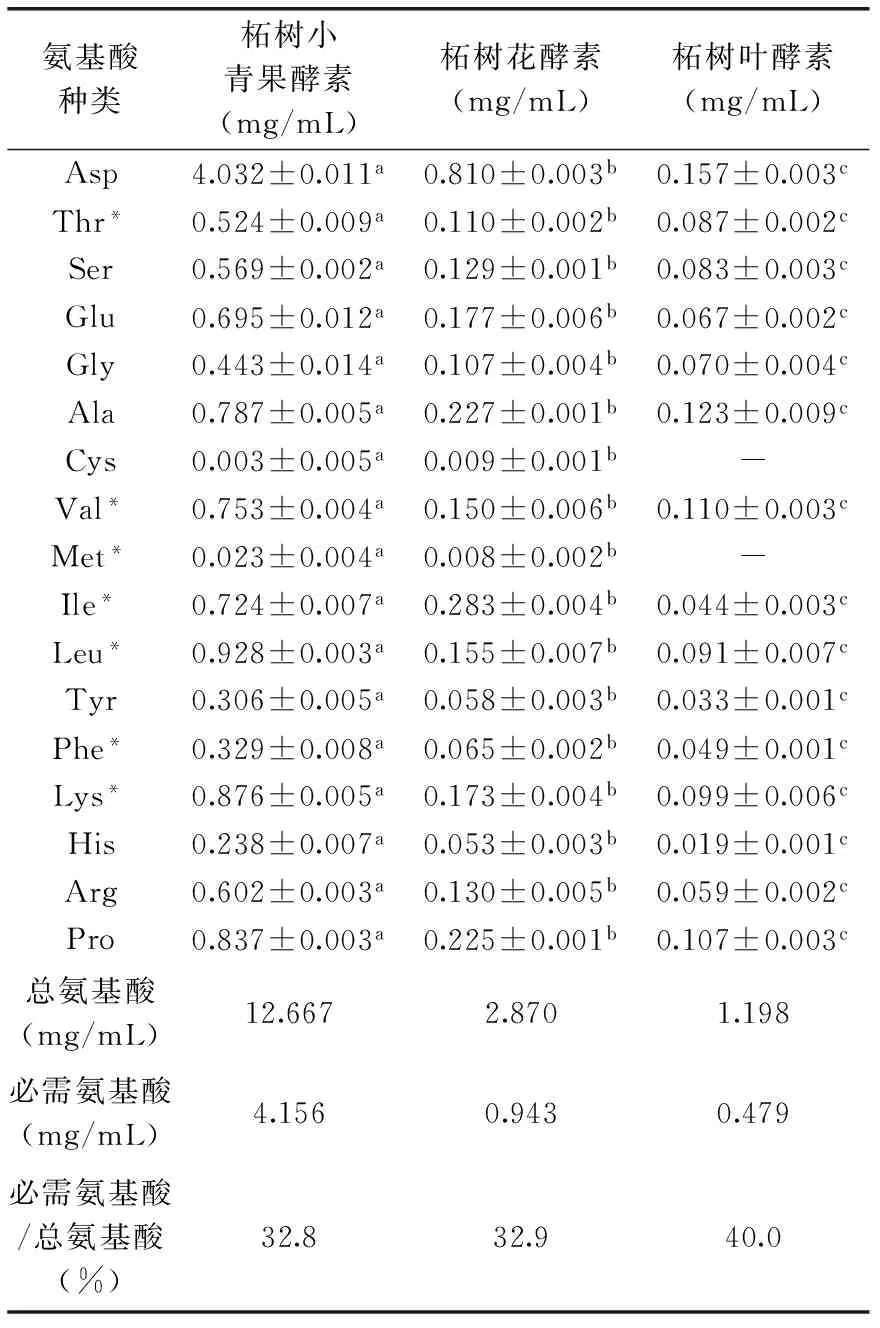
表1 柘树小青果酵素、柘树花酵素、柘树叶酵素中氨基酸的种类与含量分析Table 1 Analysis of types and concentration for amino acids from Jiaosu of Cudrania tricuspidata fruits,flowers and leaves
由表2可知,柘树小青果酵素、柘树花酵素和柘树叶酵素中Met+Cys和Phe+Tyr占总氨基酸的质量分数均低于WHO/FAO模式谱标准;柘树小青果酵素除了以上两种之外,其他必需氨基酸均高于WHO/FAO模式谱标准。三类酵素均较符合WHO/FAO模式谱标准,柘树小青果酵素和柘树花酵素的Ile的含量较高,柘树叶酵素的Thr、Val和Lys含量较高。通过计算SRC,得到柘树小青果酵素、柘树花酵素和柘树叶酵素的SRC分别为54.31、31.65和46.49。说明柘树小青果的氨基酸含量更加均衡,营养价值更高。
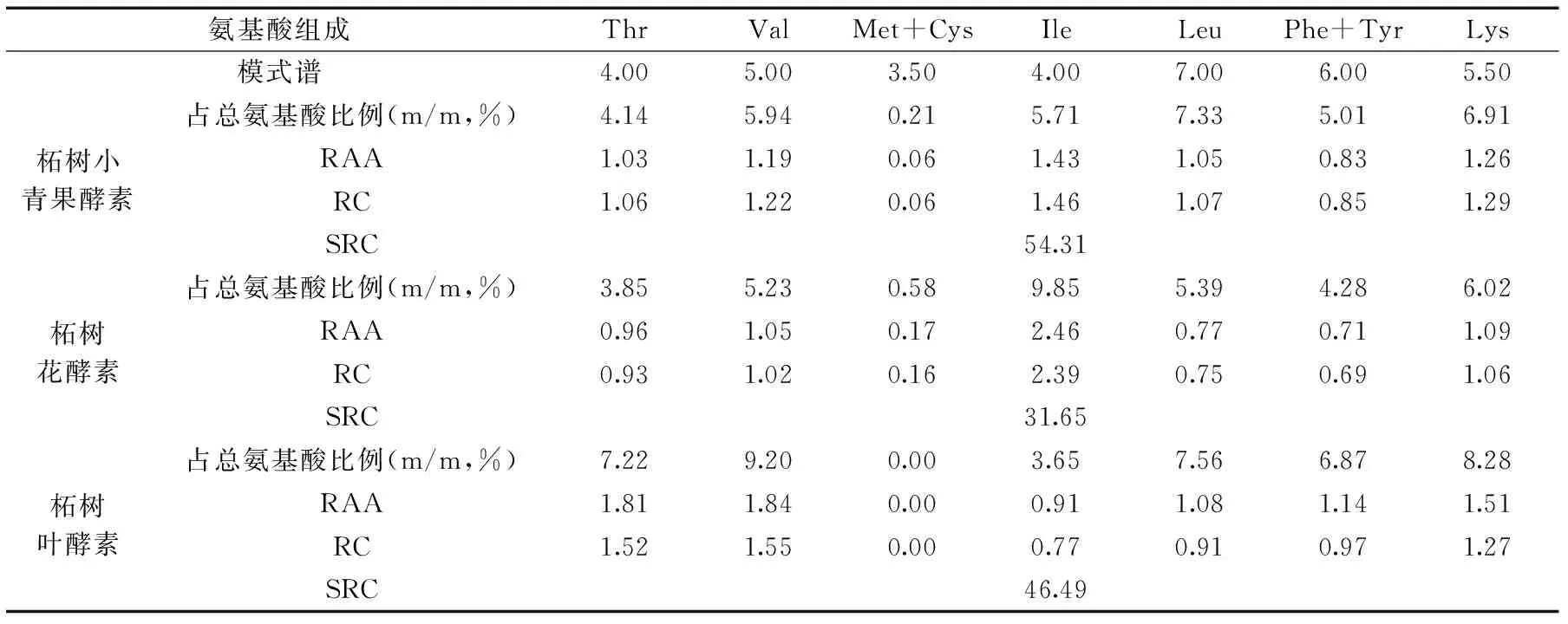
表2 柘树小青果酵素、柘树花酵素和柘树叶酵素中人体必需氨基酸的比例与模式谱比较Table 2 Essential amino acid composition and pattern spectrum in Jiaosu of Cudrania tricuspidata fruits,flowers and leaves
2.2 柘树小青果酵素、柘树花酵素和柘树叶酵素自由基清除能力
2.2.1 柘树小青果酵素、柘树花酵素和柘树叶酵素对ABTS自由基清除能力 向含有ABTS衍生阳离子的溶液中加入抗氧化剂使其在734 nm处的吸光度降低,可用于检测抗氧化剂的ABTS清除能力。柘树小青果酵素、柘树花酵素和柘树叶酵素对ABTS自由基清除能力的测定结果,如图2所示。
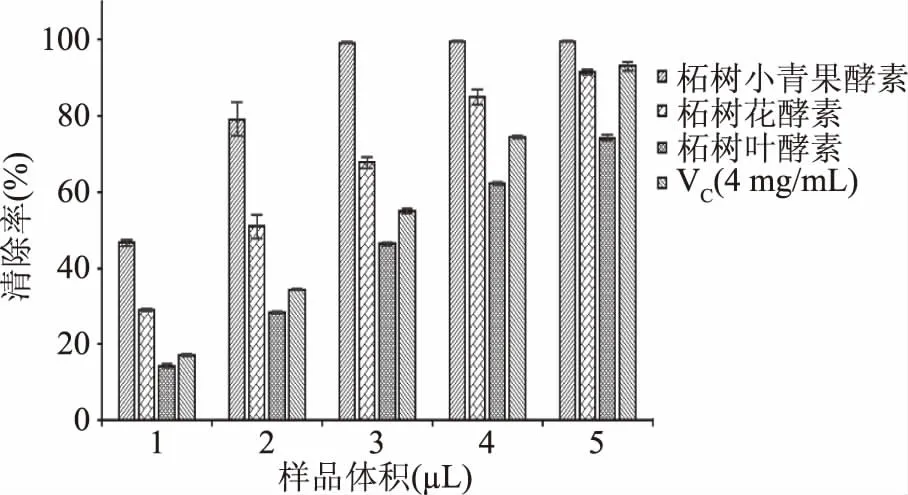
图2 三种酵素对ABTS自由基清除能力的影响Fig.2 Effect of three plant Jiaosu on ABTS radical scavenging ability
由图2可知,柘树小青果酵素、柘树花酵素和柘树叶酵素对ABTS自由基均具有优异的清除能力,随着样品量的增加,对ABTS自由基清除能力具有显著的样品加入量依赖性。在本研究的样品加入量范围内,柘树小青果酵素对ABTS自由基清除能力明显优于柘树花酵素和柘树叶酵素。柘树小青果酵素和柘树花酵素对ABTS自由基清除能力高于VC对照组,而柘树叶酵素对ABTS自由基的清除率略低于VC对照组。经计算,柘树小青果酵素、柘树花酵素和柘树叶酵素对ABTS自由基的清除力IC50分别为:1.844、2.988和5.107 mg VC当量/mL。依据IC50来看,ABTS自由基清除能力大小顺序依次是:柘树小青果酵素>柘树花酵素>VC(4 mg/mL)>柘树叶酵素。
2.2.2 柘树小青果酵素、柘树花酵素和柘树叶酵素对DPPH自由基的清除能力 柘树果实酵素、柘树花酵素和柘树叶酵素对DPPH自由基清除能力的测定结果如图3所示。
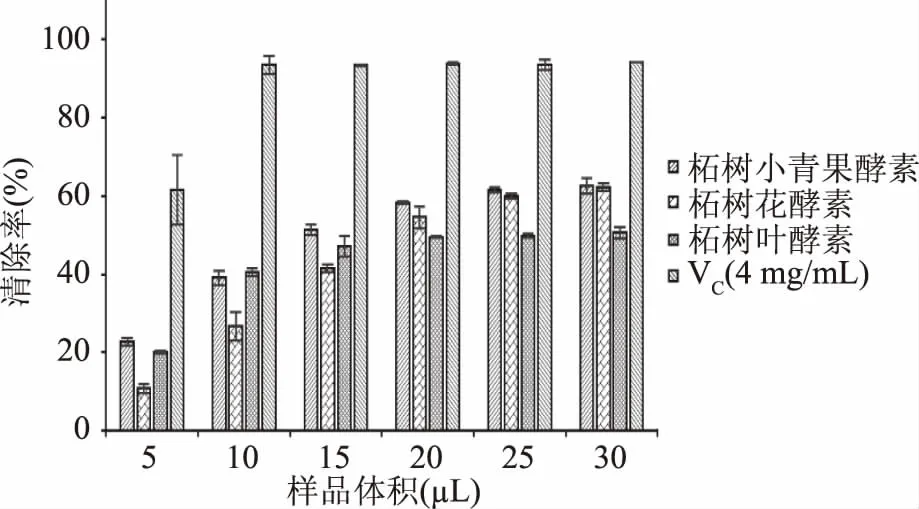
图3 三种酵素对DPPH自由基清除能力的影响Fig.3 Effect of three plant Jiaosu on DPPH scavenging ability
由图3可知,柘树小青果酵素、柘树花酵素和柘树叶酵素对于DPPH自由基都具有良好的清除能力,在实验浓度范围内,柘树小青果酵素对DPPH自由基清除能力基本都优于柘树花酵素和柘树叶酵素,在取样量在5~15 μL时,柘树叶酵素的DPPH自由基清除能力高于柘树花酵素,在取样量在20~30 μL时,柘树叶酵素的DPPH自由基清除能力低于于柘树花酵素。经计算,柘树小青果酵素、柘树花酵素和柘树叶酵素的IC50分别为:4.027、4.990和5.854 mg VC当量/mL。依据IC50来看,DPPH自由基清除能力大小顺序依次是:VC(4 mg/mL)>柘树小青果酵素>柘树花酵素>柘树叶酵素。Billaud S C C等[34]发现葡萄糖与半胱氨酸产生的美拉德反应产物抗氧化性较好,要归因于半胱氨酸巯基对DPPH自由基的清除能力。
2.2.3 柘树小青果酵素、柘树花酵素和柘树叶酵素对羟基自由基的清除能力 柘树小青果酵素、柘树花酵素和柘树叶酵素对羟基自由基的清除能力测定结果,如图4所示。
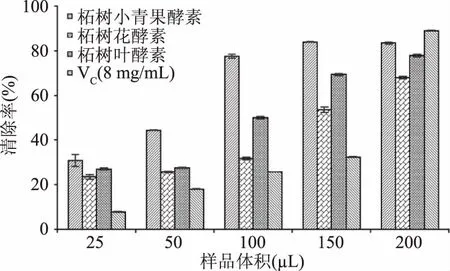
图4 三种酵素对羟基自由基清除能力的影响Fig.4 Effect of three plant Jiaosu on ydroxyl radical scavenging ability
由图4可知,当加样量在25~150 μL之间,柘树小青果酵素、柘树花酵素和柘树叶酵素明显优于VC对照,而当样品加入量达到200 μL时,VC对照的羟基自由基清除能力高于柘树小青果酵素、柘树花酵素和柘树叶酵素。经计算,柘树小青果酵素、柘树花酵素和柘树叶酵素的对羟基自由基清除率的IC50分别为:2.846、7.614和4.726 mg VC当量/mL。依据IC50来看,羟基自由基清除能力大小顺序依次是:柘树小青果酵素>柘树叶酵素>VC(8 mg/mL)>柘树花酵素。相对于其他的自由基清除能力,柘树叶酵素对羟基自由基的清除能力比柘树花酵素更高,可能是由于柘树叶酵素发酵液中存在高效清除羟基自由基的活性物质。罗海英等[35]研究发现,Gly、Ala、Glu对羟基自由基有较强的清除作用,3种nanoSe-氨基酸溶胶对羟基自由基具有 一定的清除作用,在一定浓度范围内随溶胶剂量的增加而增加,然后趋于平缓。胡文琴等[36]研究表明,许多氨基酸及其衍生物有清除自由基的能力,如:Lys、His、Tyr、Met、Pro、Arg、Glu、Cys等,而含有Tyr、His、Lys、Pro等氨基酸的多肽一般具有较强的清除羟基自由基能力。
2.2.4 柘树小青果酵素、柘树花酵素和柘树叶酵素还原力测定 柘树小青果酵素、柘树花酵素和柘树叶酵素还原力测定结果,如图5所示。
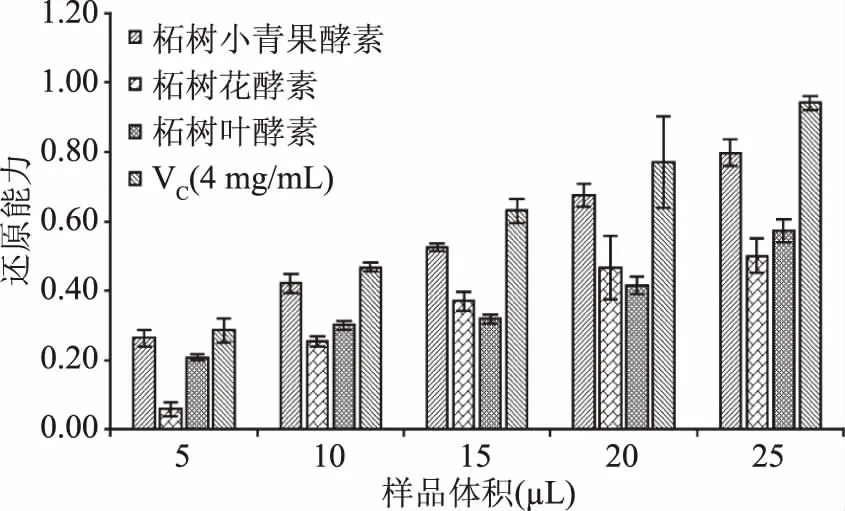
图5 三种酵素对还原力的影响Fig.5 Effect of three plant Jiaosu on reducing power
由图5可知,柘树小青果酵素还原力明显优于柘树花酵素和柘树叶酵素,都具有一定的浓度依赖性,均低于VC对照组。经计算,柘树小青果酵素、柘树花酵素和柘树叶酵素的IC50分别为:4.902、9.467和10.629 mg VC当量/mL。依据IC50来看,还原力大小顺序依次是:VC(4 mg/mL)>柘树小青果酵素>柘树花酵素>柘树叶酵素。虽然柘树花酵素的氨基酸含量(2.869 mg/mL)比柘树叶酵素氨基酸含量(1.198 mg/mL)高,但从图5来看,两种酵素的还原力并无显著性差异,可能是还原力的大小不仅与自由基的清除有关,还与过氧化物降解等因素有关。张晓溪等[37]研究发现,Cys本身就存在还原能力,其余三种氨基酸经过美拉德反应之后还原能力增强。
2.3 柘树酵素氨基酸含量与抗氧化性相关分析
为了解三种拓树酵素氨基酸与抗氧化活性指标的相互关系,分析柘树小青果酵素、柘树花酵素和柘树叶酵素中氨基酸组成和含量与还原力、DPPH自由基清除率、ABTS自由基清除率和羟基自由基清除率的相关性,结果如表3所示。
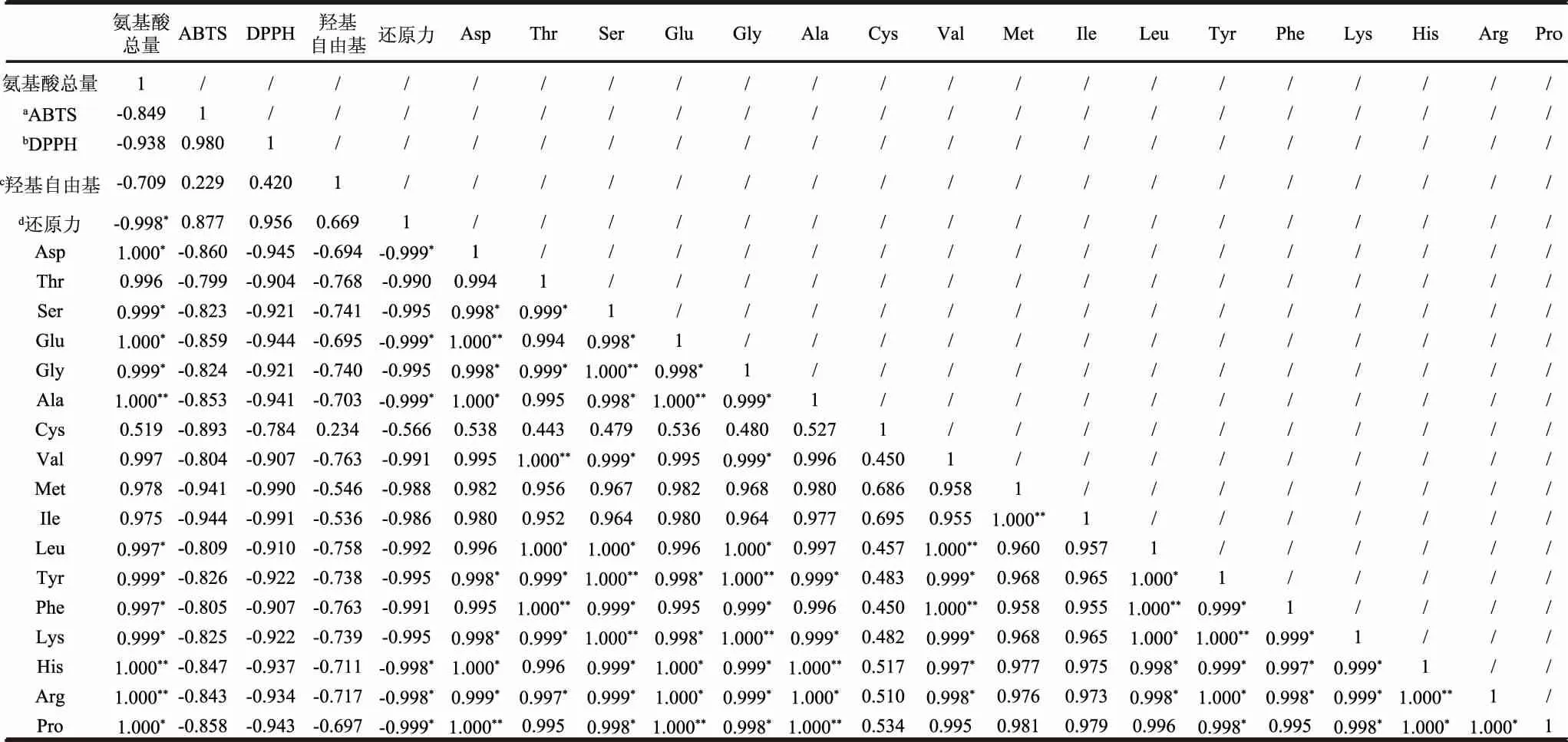
表3 柘树酵素氨基酸含量与抗氧化性相关分析Table 3 Correlation between amino acid content and antioxidant activity of Cudrania tricuspidata Jiaosu
氨基酸总量与ABTS自由基清除率、DPPH自由基清除率、羟基自由基清除率的IC50具有负相关性,但无统计学意义,与还原力IC50具有显著的负相关性(p<0.05),Pearson相关系数r=0.998。氨基酸总量与ABTS自由基清除率、DPPH自由基清除率、羟基自由基清除率和还原力IC50呈负相关,意味着具有最高氨基酸含量的柘树酵素具有最大的抗氧化性能。进一步分析影响抗氧化性能的氨基酸种类,发现Asp、Glu、Ala、His、Arg和Pro这六种氨基酸含量与还原力IC50呈显著负相关关系,Pearson相关系数|r|>0.998,说明这六种氨基酸起着主要的抗氧化作用,而从氨基酸总量和各种氨基酸含量的相关性分析结果可以看出,这六种氨基酸总量与总氨基酸含量呈高度显著正相关性,Pearson相关系数均为1.000,进一步证实了Asp、Glu、Ala、His、Arg和Pro等六种主要氨基酸在还原力抗氧化性能上起着主要的影响因素。这与Farvin等[38]报道的氨基酸序列上的His、Arg等具有抗氧化性的结果相一致,相似地,Martineztome等[39]在研究中也发现Asp、Glu、Ala、Pro等水溶性氨基酸具有抑制脂质过氧化的能力,但是在EDTAFe和羟基自由基的系统中,溶解在水中的Thr氨基酸却具有显著的促氧化活性。本研究中发现Thr氨基酸对于清除DPPH自由基、ABTS自由基和还原力维持等抗氧化性指标上具有相对较低的相关系数,具体原因还有待于进一步的实验证实。所有这些结果表明氨基酸含量和种类可能是柘树小青果酵素、柘树花酵素和柘树叶酵素抗氧化能力良好的预测因子。某些氨基酸含量与抗氧化性能有显著线性相关性,这可以为氨基酸类抗氧化食品的开发提供一些有价值的信息。
至于氨基酸含量和种类与DPPH自由基清除率、ABTS自由基清除率和羟基自由基清除率的相关性并不显著,这可能与氨基酸并不是三种抗氧化评价特异性指标有关,而且在柘树酵素中可能还存在着抗坏血酸、总酚、维生素E、总多糖、有机酸等活性成分,这也会对抗氧化剂起到协同或者增效的作用,导致具有相似氨基酸浓度的样品可能具有显著差异的抗氧化活性[40]。另一方面,本研究采用的为发酵150 d柘树小青果酵素、柘树花酵素和柘树叶酵素,在发酵过程中,氨基酸作为初级代谢产物,也可以作为底物被合成不同的次级代谢产物,而且不同的氨基酸之间也会发生相互转化,因此,在不同的发酵终点得到样品的抗氧化性能可能明显不同,而表现出最终的抗氧化测定结果与动力学参数评估不相符的现象[41]。
抗氧化剂可能通过几种作用机制起到抗氧化作用,例如抑制自由基的产生,提高对自由基的清除能力,还原能力和金属螯合能力等[42],需要综合利用多种抗氧化指标进行抗氧化效果的评价,由于不同的抗氧化评价是基于不同的反应机制,因此在利用同一种抗氧化剂进行抗氧化评价时经常会得出完全不同的结果,为了可以从一种抗氧化评价指标预测到另一种抗氧化指标,需要对不同的抗氧化评价指标进行相关性分析。DPPH自由基清除率、ABTS自由基清除率、羟基自由基清除率和还原力等四种抗氧化指标的相关性分析如表3所示。
无论基于何种反应机制,四种抗氧化评价之间均呈正相关性,其中还原力与DPPH自由基清除率、ABTS自由基清除率和羟基自由基清除率具有良好的线性相关性,Pearson相关系数r>0.65,说明还原力的测定可以为本研究中评价柘树酵素的抗氧化性提供有价值的信息。另一方面,羟基自由基清除率和DPPH自由基清除率、ABTS自由基清除率之间具有弱相关性,Pearson相关系数r>0.20,可能与在清除羟基自由基过程中存在的促氧化性物质有关。特别是DPPH自由基清除率和ABTS自由基清除率具有强的相关性,这点与许多研究不同抗氧化评价结果的相关性相一致[43],这也为柘树酵素产品抗氧化评价提供了可靠的数据信息。
3 结论
本实验通过测定柘树酵素氨基酸种类与含量以及抗氧化性能得出,柘树小青果酵素、柘树花酵素和柘树叶酵素含有丰富的氨基酸,且种类较齐全,总氨基酸含量分别为12.667、2.870和1.198 mg/mL,包含人体必需的八种氨基酸含量分别达4.156、0.943和0.479 mg/mL。其中柘树小青果酵素中人体必需氨基酸的含量更均衡,营养价值更高。抗氧化活性研究表明:柘树小青果酵素自由基清除能力优于柘树花酵素和柘树叶酵素,除羟基自由基清除能力外,其他自由基清除能力的大小为柘树小青果酵素>柘树花酵素>柘树叶酵素,且还原力、DPPH自由基清除能力、羟基自由基清除能力和ABTS自由基清除能力均表现出明显的剂量依赖性;柘树酵素氨基酸含量与抗氧化性相关分析结果表明,可以通过测定拓树酵素中的氨基酸含量来表征其抗氧化特性,Asp、Glu、Ala、His、Arg和Pro这六种氨基酸与柘树酵素的还原力具有显著相关性,起主要的抗氧化作用。所以在一定程度上可以说明柘树酵素中的氨基酸具有良好的抗氧化效果,从而可以说明食用柘树植物酵素具有功能定向保健食品的巨大潜力。本研究为进一步开发酵素类功能性产品提供实验依据。
[1]蒋增良,毛建卫,黄俊,等. 葡萄酵素在天然发酵过程中体外抗氧化性能的变化[J]. 中国食品学报,2014,14(10):2934.
[2]毛建卫,吴元锋,方晟. 微生物酵素研究进展[J]. 发酵科技通讯,2010,39(3):4244.
[3]蒋增良,毛建卫,黄俊,等. 蓝莓酵素在天然发酵过程中抗氧化性能的变化[J]. 食品工业科技,2013,34(2):194-197,201.
[4]中国生物发酵产业协会. T/CBFIA 080012016,酵素产品分类导则[S]. 北京:中国标准出版社,2016.
[5]王珍珍,沙如意,蔡成岗,等. 树莓酵素中耐高渗酵母菌的分离鉴定及生长特性研究[J].食品工业科技,2017,38(8):178182,188.
[6]蒋增良,毛建卫,黄俊,等. 葡萄酵素在天然发酵过程中体外抗氧化性能的变化[J]. 中国食品学报,2014,14(10):2934.
[7]蒋增良. 天然微生物酵素发酵机理、代谢过程及生物活性研究[D]. 杭州:浙江理工大学,2013:16.
[8]邵士慧. 食品中氨基酸的作用及测定方法[J]. 湖南农机,2016(4):92.
[9]刘艳,王志宏,曲金瑶,等. 乙酰半胱氨酸口服溶液抑菌剂抑菌效力研究[J]. 齐鲁药事,2015(3):152155.
[10]张春晓,蒋滢,黄美英,等. 不同肝脏疾病患者血浆游离氨基酸水平改变的模式[J]. 氨基酸和生物资源,2002,24(2):4345.
[11]张志,吴海健,皮恩浩,等. 柘树黄酮体内外抗肿瘤作用研究[J].世界临床药物,2009,10:601605.
[12]李波,王美,谭亚南,等. HPLCDAD同时测定柘树和构棘根与茎中4种黄酮类成分的含量[J]. 中国中药杂志,2013,38(2):166170.
[13]吴海健. 柘树总黄酮的质量标准及制剂研究[D]. 上海:复旦大学,2008.
[14]石磊. 柘树化学成分及药理作用的研究进展[J]. 曲阜师范大学学报:自然科学版,2010,36(3):8894.
[15]杨久琳,张岩. 柘树化学成分及生物活性的研究进展[J].中国药房,2015(6):861864.
[16]曹春廷,孙丛龙,白卫滨,等. 柘树果实的抗乳腺癌活性部分的提取、分离及结构鉴定[J]. 食品科学,2015(13):4851.
[17]王枚博,黄建明,侯爱君. RPHPLC法测定柘树根中四种异戊烯基口山酮的含量[J].复旦学报:医学版,2006(4):559562.
[18]董国霞,陈靠山,石磊,等. 柘树根多糖CPS1的分离纯化及理化性质分析[J]. 中国药学杂志,2006,41(23):18311833.
[19]皮恩浩. 柘树抗肿瘤活性成分的药代动力学研究[D]. 上海:复旦大学,2010.
[20]徐誉泰,张可炜,李艳,等. 柘树黄酮对胃癌细胞株NKM大分子合成的影响[J]. 中医药学报,1998,26(5):4748.
[21]曹春廷. 柘树果实抗氧化成分分析及其异黄酮Scandenolone诱导乳腺癌细胞凋亡通路研究[D]. 雅安:四川农业大学,2015.
[22]ChangHo Jeong.Invitroantioxidative activities and phenolic composition of hot water extract from different parts ofCudraniatricuspidata[J]. Preventive Nutrition and Food Science,2009,14(4):283289.
[23]DaeHun Kang. Antioxidant activities of extracts from fermented mulberry(Cudraniatricuspidata)fruit and inhibitory actions on elastase and tyrosinase[J]. Korean Journal of Food Preservation,2011,18(2):236243.
[24]Suh DH,Jung E S,Park H M,et al. Comparison of metabolites variation and antiobesity effects of fermented versus nonfermented mixtures ofCudraniatricuspidata,Loniceracaerulea,and soybean according to fermentationinvitroandinvivo[J]. Plos One,2016,11(2):e0149022.
[25]SoRa Choi. Antioxidant activity of methanol extracts fromCudraniatricuspidatabureau according to harvesting parts and time[J]. Korean Journal of Medicinal Crop Science,2009,17(2):115120.
[26]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会. GB/T 5009.1242003,食品中氨基酸的测定[S]. 北京:中国标准出版社,2015.
[27]FAO/WHO.Report of a joint FAO/WHO ad hoc expert committee:Rom energy and protein requirements[C].World Health Organization:Switzerland,1983:3638.
[28]鲁敏,安华明,赵小红. 无籽刺梨与刺梨果实中氨基酸分析[J]. 食品科学,2015(14):118121.
[29]严冬,杨鑫嵎. 西藏不同产地冬虫夏草中氨基酸成分分析及其营养价值评价[J]. 中国农学通报,2014,30(3):281284.
[30]Re R,Pellegrini N,Proteggente A,et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay[J]. Free Radical Biological and Medicine,1999,26(910):12311237.
[31]Blois M S. Antioxidant determination by the use of a stable free radical[J]. Nature,1958,181:11991200.
[32]Liu Wei. Preparation of a hydroxypropyl Ganoderma lucidum polysaccharide and its physicochemical properties[J]. Food Chemistry,2010,122(4):965971.
[33]Yildirim A,Mavi A,Kara A A. Determination of antioxidant and antimicrobial activities ofRumescrispusL. extracts[J]. Journal of Agricultural and Food Chemistry,2001,49(8):40834089.
[34]C Sophie,B Catherine,P Stephan,et al. A comparison study between antioxidant and mutagenic properties of cysteine glucosederived Maillard reaction products and neoformed products from heated cysteine and hydroxymethylfurfural[J]. Food Chemistry,2009,114:132138.
[35]罗海英,周艳晖,白燕,等. 纳米硒氨基酸溶胶的抗氧化作用[J]. 食品科技,2011,36(4):202206,210.
[36]胡文琴,王恬,霍永久,等. 酪蛋白酶解物体外抗氧化作用的研究[J]. 食品科学,2004(4):158162.
[37]张晓溪,曾艳,张泽生,等. 果糖与氨基酸美拉德反应产物的抗氧化性研究[J]. 食品工业科技,2011,32(6):175-178,240.
[38]Farvin K H S,Baron C P,Nielsen N S,et al. Antioxidant activity of yoghurt peptides:Part 2Characterisation of peptide fractions.[J]. Food Chemistry,2010,123(4):10901097.
[39]Martineztome MartinezTome. Comparison of the antioxidant and prooxidant activiteis of broccoli amino acid with those of common food additives[J]. Journal of the Science of Food and Agriculture,2001,81(10):10191026.
[40]Terpinc P. Studies of the correlation between antioxidant properties and the total phenolic content of different oil cake extracts[J]. Industrial Crops and Products,2012,39(1):210217.
[41]Terpinc Petra. A kinetic approach for evaluation of the antioxidant activity of selected phenolic acids[J]. Food Chemistry,2010,121(2):366371.
[42]Huang Deijian,Ou Boxin,Prior Ronald L. The chemistry behind antioxidant capacity assays[J]. Journal of Agricultural and Food Chemistry,2005,53(6):18411856.
[43]Neo YunPing,Ariffin A,Tan C P,et al. Phenolic acid analysis and antioxidant activity assessment of oil palm(E.guineensis)fruit extracts[J]. Food Chemistry,2010,122(1):353359.
