肺叶切除术和局限性切除术对老年Ⅰ期非小细胞肺癌患者的预后影响
2018-03-08吉红波
吉红波
肺癌是世界上最常见也是死亡率最高的恶性肿瘤,其发病率高峰年龄是70~74岁。
目前研究发现局限性切除术(楔形切除术和肺段切除术)对于早期NSCLC可以达到与肺叶切除术相似的治疗效果,并且能够最大限度的保存肺功能,降低围手术期并发症及死亡率,但是也可能因为切除范围及淋巴结清扫数目不足导致复发率增高。本研究着重关注局限性切除术对老年NSCLC患者围手术期并发症及远期生存的影响,现报告如下。
1 资料与方法
1.1 临床资料
选取2008年至2012年在我院初次就诊明确诊断为NSCLC并行肺癌切除术(肺叶切除术、局限性切除术)的患者。纳入标准为:年龄≥65岁;根据UICC分期标准术后病理分期为Ⅰ期;术前未行放化疗治疗;术前行脑、胸、腹影像学检查及ECT未发现转移灶。最终245例患者纳入本研究,详细查阅并记录所有入组患者的临床病理资料,包括术前合并症、手术信息、术后并发症及生存资料等。
1.2 治疗方法
入组的245例患者均行肺叶切除术或局限性切除术(肺段切除术、楔形切除术),肺叶及肺段切除术需取样或系统清扫肺门及纵膈淋巴结,而楔形切除只需切除肿大淋巴结。术后给予4~6个周期NCCN指南推荐的标准化疗方案化疗。
1.3 随访
通过查阅患者病历资料或以电话形式进行随访。随访内容包括:胸部CT,放射性核素骨扫描等。患者术后每3个月随访1次,至术后1年,随后每6个月随访1次,至术后3年,此后每年随访1次。中位随访时间为37(2~65)个月,432例患者的随访至死亡或截止日期(2015年12月)。选择总生存期(OS)和无病生存期(DFS)为研究终点。OS定义为从手术日期至患者死亡或者随访截止的日期。DFS定义为从手术日期至首次出现复发、转移或者随访截止的日期。
1.4 统计学分析
两组患者间临床特征差异采用卡方检验;生存分析采用Kaplan-Meier法分析单因素对生存期的影响,并采用Log-rank时序检验分析各组间的生存差异,绘制生存曲线。所有采集数据均采用SPSS 19.0统计软件进行处理,P<0.05为具有统计学差异。
2 结果
2.1 基本临床资料
纳入研究的245例NSCLC患者根据手术方式不同,被分为肺叶切除术组及局限性切除术组,基本临床特征如表1所示。39例患者接受了局限性切除术而206例患者接受了肺叶切除术,两组患者年龄、性别等人口学资料及糖尿病、冠状疾病、高血压等合并症差异无统计学差异。但是,局限性切除术患者的COPD患病率要高于肺叶切除术患者(17.9% vs 7.7%,P<0.05),同时局限性切除术患者FEV1较肺叶切除术患者差(87.86 vs 79.27,P<0.05)。
两组患者肿瘤位置及分化程度差异无统计学差异,但是两组肿瘤病理类型差异较大(P<0.05,表2),肺叶切除术组患者中腺癌为53.4%、鳞癌为42.7%,而局限性切除术组中腺癌为71.8%、鳞癌为15.4%。同时,两组肿瘤大小差异具有统计学意义,肺叶切除术患者中29.6%肿瘤直径<2 cm,而局限性切除术患者中46.1%的肿瘤直径<2 cm。
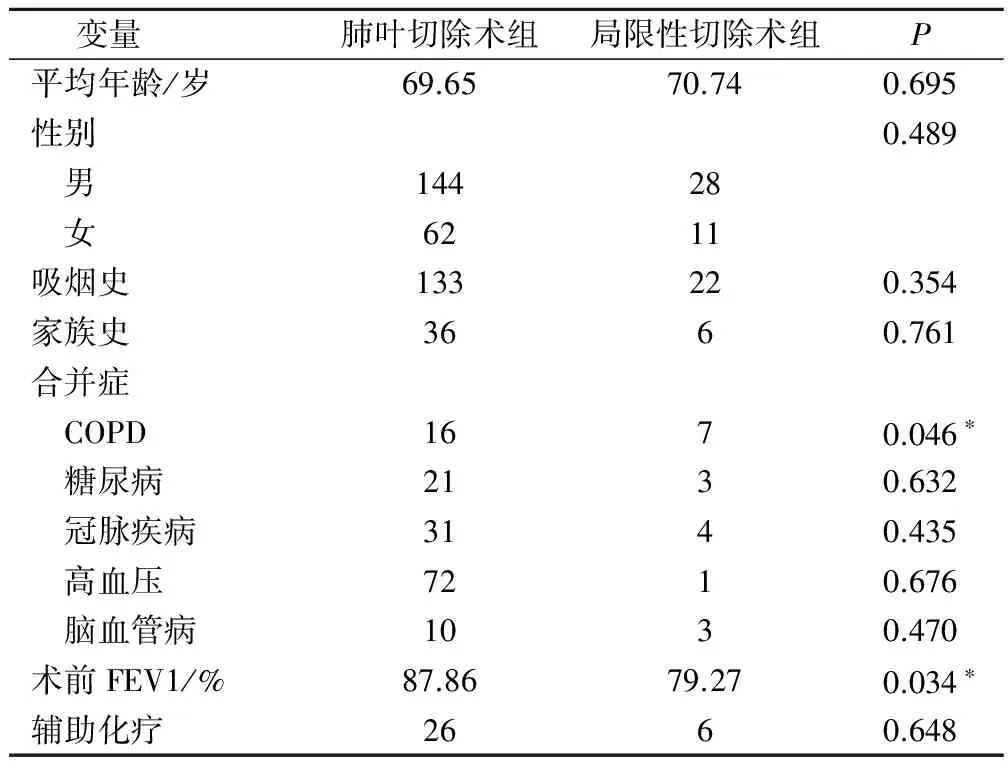
表1 两组基本临床特征比较/例
注:*为P<0.05。

表2 两组肿瘤特征比较
注:*为P<0.05。
2.2 手术相关资料
两组患者手术相关资料见表3所示。肺叶切除术组较局限性切除术组手术时间长(123.6 min vs 81.8 min,P<0.05)、术中失血量多(121.07 ml vs 68.08 ml,P<0.05)。但是,肺叶切除术组患者较局限性切除术组患者术中平均淋巴结清扫数目要高(13.3 vs 2.9,P<0.05)。
2.3 生存期差异
肺叶切除术与局限性切除术两组中均未出现术中死亡病例,但是2例肺叶切除术患者发生围手术期死亡,分别为急性心肌梗死和急性呼吸窘迫综合症导致。
肺叶切除术组与局限性切除术组相比较OS和DFS无统计学差异(图1A,图1B);根据肿瘤大小进一步进行亚组分析,当肿瘤直径≤2 cm时两组OS及DFS未见显著差异(图2A,2B),但是当肿瘤直径>2 cm时肺叶切除术组的DFS要长于局限性切除术组(图2D),而OS仍无显著差异(图2C)。同时,根据FEV1进行亚组分析显示,当FEV1<80%时,2组患者OS及DFS无明显差异(图3A,3B),而当FEV1≥80%时,肺叶切除术组的OS要显著优于局限性切除术组(图3C)。

表3 两组患者手术特征及术后并发症/例
注:*为P<0.05。

A为手术方式对OS的影响;B为手术方式对DFS的影响。

A为肿瘤直径<2 cm时,手术方式对OS的影响;B为肿瘤直径<2 cm时,手术方式对DFS的影响;C为肿瘤直径>2 cm时,手术方式对OS的影响;D为肿瘤直径>2 cm时,手术方式对DFS的影响。

A为FEVl<80%时,手术方式对OS的影响;B为FEVI<80%时,手术方式对DFS的影响;C为FEVl≥80%时,手术方式对OS的影响;D为FEVl≥80%时,手术方式对DFS的影响。
3 讨论
本研究中选取了245例老年Ⅰ期NSCLC患者进行研究分析,证实肺叶切除术与局限性切除术两者之间生存率未见显著差异,这与以往文献报道结果基本一致[1-2],但是进一步以肿瘤直径进行亚组分析显示,当肿瘤直径<2 cm时,两种手术方式在生存率上没有差异,当肿瘤直径≥2 cm时肺叶切除术在DFS方面显示出优势。
NSCLC手术方式研究中经常采取2 cm作为临界点。Okada等于1997年 提出局限性切除术在治疗直径较小的周围型NSCLC时可以获得与肺叶切除术相似的生存期[3]。进一步研究证实当肿瘤直径<2 cm时患者可以获得更好的生存优势及更低的复发率[4]。Warren等报道称对于<2 cm NSCLC患者而言,行局限性切除术患者的预后不亚于肺叶切除术患者,这对于存在肺功能障碍的老年患者尤为明显。一项美国国家肿瘤中心的研究显示肺叶切除术患者在生存期上优于行局限性切除术患者,但是对于年龄大于70岁的 老年患者并没有优越性[5]。近期很多回顾性研究分析指出在不影响远期生存的情况下对老年患者行局限性切除术可以显著减少围手术期并发症及死亡[6]。
研究报道称老年患者行肺叶切除术后其围手术期心脑血管意外的死亡率显著高于年轻患者,尤其当年龄高于70岁时这一趋势更加明显[7]。因患者行肺叶切除术后循环发生改变,其心脏负担进一步加重而容易诱发心率失常;老年患者因术后下床活动晚及本身血管条件差等原因容易造成深静脉血栓的形成,后期血栓脱落容易造成肺栓塞、脑栓塞等致死性疾病[8]。我们在本研究发现局限性切除术患者其术后并发症较肺叶切除术患者少,但是无明显统计学差异,这与Ginsberg等报道基本一致[9]。
有研究认为局限性切除术因无法保证足够的阴性切缘及遗漏肺内微小转移灶可能会造成更高的局部复发率[10],但是我们研究发现两种手术方式的局部复发率无明显差异,这与EI-Sherif A等的研究基本一致,其报到称肺叶切除术与局限性切除术的局部复发率分别为28%和29%,两者差异无统计学意义。Koike等研究报道称对于肿瘤直径小于2 cm的Ⅰ期NSCLC患者行局限性切除术不会增加其复发的风险[11]。
局限性切除术的最大优势在于能够更大程度的保留患者的肺功能,这点对于肺功能较差的老年患者更为重要。本研究中接受局限性切除术患者并发COPD的比例为17.9%,与肺叶切除术患者差异具有统计学意义,同时局限性切除术患者FEV1%较肺叶切除术患者更低。对FEV1%进行亚组分析显示,当FEV1%≥80%时行肺叶切除术患者具有生存优势,而FEV1%<80%时肺叶切除术较局限性切除术无明显生存优势。
综上所述,局限性切除术对于肺功能较差且存在较多合并症的老年Ⅰ期NSCLC患者可以达到与肺叶切除术相同的效果,是这部分患者安全有效的选择。
[1] E1-Sherif A,Gooding WE,Santos R,et al.Outcomes of sublobar resection versus lobectomy for stage I non-small cell lungcancer:a 13-year analysis〔J〕.Ann Thorac Surg,2006,82(2):408-415.
[2] Okami J,Ito Y,Higashiyama M,et al.Sublobar resection provides all equivalent survival after lobectomy in elderly patients wim early lung cancer〔J〕.Ann Thorac Surg,2010,90(5):1651-1656.
[3] Kodama K,Doi O,Higashiyama M,et al.Intentional limited resection for selected patients with T1 N0 M0 non-small-cell lung cancer:a single-institution study〔J〕.J Thorac Cardiovasc Surg,1997,114(3):347-353.
[4] Okada M,Yoshikawa K,Hatta T,et al.Is segmentectomy with lymph node assessment an alternative to lobectomy for non-small cell lung cancer of 2 cm or smaller?〔J〕.Ann Thorac Surg,2001,71(3):956-960.
[5] Okada M,Koike T,Higashiyama M,et al.Radical sublobar resection for small-sized non-small cell lung cancer:a multicenter study〔J〕.J Thorac Cardiovasc Surg,2006,132(4):769-775.
[6] 张秀强,岳东升,王长利.两种术式治疗老年Ⅰ期非小细胞肺癌的预后分析〔J〕.中国肿瘤临床,2015,42(7):386-391.
[7] Berry MF,Hanna J,Tong BC,et al.Risk factors for morbidity after lobectomy for lung cancer in elderly patients〔J〕.Ann Thorac Surg,2009,88(4):1093-1099.
[8] Speicher PJ,Ganapathi AM,Englum BR,et al.Survival in the elderly after pneumonectomy for early stage non-small cell lung cancer:a comparison with nonoperative management〔J〕.J Am Coll Surg,2014,218(3):439-449.
[9] Ginsberg RJ,Rubinstein LV.Randomized trial of lobectomy versus limited resection for T1 NO non.small cell lung cancer〔J〕.Ann Thorac Surg,1995,60(3):615-622.
[10] EI-ShenfA,Femando HC,Santos R,et al.Margin and local recurrence after sublobar resection of non-small cell lung cancer〔J〕.Ann Surg Oncol,2007,14(8):2400-2405.
[11] Koike T,Yamato Y,Yoshiya K,et al.Intentional limited pulmonary resection for peripheral T1N0M0 small-sized lung cancer〔J〕.Jpn J Thorac Cardiovasc Surg,2003,51(10):515-519.
