低场核磁共振分析猪肉宰后成熟过程中的水分变化
2017-12-06,,,,,,*
,,,, ,,*
(1.中国劳动关系学院高等职业技术学院,北京 100048;2.北京市理化分析测试中心,北京 100094;3.中国农业大学食品科学与营养工程学院,教育部-北京市共建功能乳品重点实验室,北京市高等学校畜产品工程研究中心,食品质量与安全北京市重点实验室,北京 100083)
低场核磁共振分析猪肉宰后成熟过程中的水分变化
甄少波1,刘奕忍2,郭慧媛3,王虎军1,潘腾3,任发政3,*
(1.中国劳动关系学院高等职业技术学院,北京 100048;2.北京市理化分析测试中心,北京 100094;3.中国农业大学食品科学与营养工程学院,教育部-北京市共建功能乳品重点实验室,北京市高等学校畜产品工程研究中心,食品质量与安全北京市重点实验室,北京 100083)
以三元杂交猪为对象,利用核磁共振技术分析猪肉不同相态水分的弛豫时间和含量比例,研究了不同保水性猪肉在宰后成熟过程中水分变化情况。结果表明:猪肉成熟过程中的核磁共振T2弛豫谱显示3个峰,横向弛豫时间分别为T21(2.127~2.541 ms)、T22(31.248~48.817 ms)和T23(167.086~275.782 ms)。宰后同一时间下低、中、高三组保水性猪肉T21及P21均无显著性差异,与低保水性组相比,高保水性猪肉T22及T23均显著降低,P22显著升高,自由水比例P23显著低于低保水性组(p<0.05)。宰后成熟过程中各组肉样T21变化不大,T22和T23均呈现先上升后下降的趋势,并在宰后8 h达到最高值。成熟时间对P21无显著性影响,但对P22和P23影响显著(p<0.05)。核磁成像图显示肉样亮度随着成熟时间的延长而增加。该实验结果对于研究肉品成熟过程中的水分变化具有重要意义,同时为解释肉品保水性机理提供理论依据。
核磁共振,水分,弛豫时间,猪肉,成熟,保水性
水是畜肉中含量最高且非常重要的化学组分,肌肉中的水分含量大约为75%。肉品储存水分的能力被称为肉品的保水性(Water Holding Capacity,WHC),保水性是衡量肉品品质的重要指标之一,它直接影响肉品的加工特性[1],原料肉中的水分含量和分布形态是影响肉与肉制品质量和货架期的重要因素[2-3]。探究肉品保水性已成为国内外肉类领域的热点[4]。常规的肉品保水性主要通过滴水损失、离心损失、蒸煮损失等方法来进行测定[5]。这些传统的检测方法能够反映肉的持水能力,但并不能反映肉品中水分的分布及迁移状况,而且检测过程费时费力,还会破坏样品原有的结构和性质。低场核磁共振技术(low-field nuclear magnetic resonance,LF-NMR)是一种新型的分析检测技术,它不仅能够分析肉品的水分分布状态、不同状态水的含量及迁移过程,同时还可以进行成像分析,是一种快速、高效、无损的光谱检测技术[6]。国内外学者用LF-NMR研究了宰前管理、蒸煮、冻结、解冻方式、冷却工艺、腌渍等对冷却肉保水性的影响[7],但是针对不同保水性猪肉在宰后成熟过程中肌肉内部水分分布状态及迁移规律的研究相对较少。
本文以三元杂交猪为实验对象,利用低场核磁共振技术,动态检测其脉冲 CPMG(carr-purcell-meiboom-gill sequence)序列信号,测定肉样横向弛豫时间T2,根据T2弛豫时间的反演图谱,通过其时段信号和波峰位置的改变揭示不同保水性猪肉在宰后成熟过程中的水分分布状态及迁移规律,探究冷却猪肉保水性机理,并为核磁共振技术在肉品的应用提供理论依据。
1 材料与方法
1.1材料与仪器
杜长大三元杂交猪 30头,北京华都猪场。
NMR PQ 001分析仪 上海纽迈电子科技有限公司;AY220电子天平 日本SHIMADZU公司。
1.2实验方法
1.2.1 屠宰工艺 选取质量为(90±5) kg的实验猪30头。实验当天,所有猪在运输前已禁食禁水4 h,运输卡车为单层单栏设计,车速约60 km/h,经1.5 h运输到达北京顺鑫农业鹏程食品分公司。所有猪经3 h静养后,采用三点式电击晕(电压85 V,时间3 s)处理。击晕后,经水平放血、热烫(温度 63 ℃,时间6 min)、剥皮、摘除内脏、劈半等工艺,胴体进入4 ℃冷库冷却24 h。
1.2.2 核磁肉样处理 取宰后45 min、4、8、12、24 h后的猪胴体背最长肌,除去脂肪和筋膜,再切成8 mm×8 mm×15 mm的长方体肉条,切面要平整垂直,置于直径12 mm的圆柱形玻璃管内为核磁共振专用样品管内,并用塑封膜将管口封好,再将样品管放入直径15 mm的核磁管中,在核磁共振成像仪中进行测量。每个胴体测3个重复。
1.2.3 指标测定
1.2.3.1 保水性测定 保水性采用滴水损失率方法测定。切取胴体冷却24 h后第三与第四根肋骨间的背最长肌,去除脂肪和筋腱,切成3 cm×2 cm×2 cm的肉样,称重W1后,用铁丝钩住肉块的一端,悬挂于聚乙烯的塑料袋中(肉样不得与塑料袋壁接触),扎紧袋口后悬挂于4 ℃冰箱内,24 h后取出并用滤纸擦去肉样表面汁液,再次称重W2。利用两次称量的重量差异计算肉的重量损失百分比,每头胴体做3个平行。滴水损失(Drip Loss)计算公式如下:
滴水损失率(%)=[(W1-W2)/W1]×100
1.2.3.2 NMR 横向弛豫时间(T2)测定 NMR横向弛豫时间的测定在核磁共振分析仪上进行。测定前仪器需预热 30 min以上。测试条件为:质子共振频率设置为23.0 MHz,测量温度为32 ℃,NMR 横向弛豫时间T2用CPMG 序列(carr-purcell-meiboom-gill sequence)测量。所使用的参数为:90°脉冲和180°脉冲之间的时间τ值=200 μs、重复采样NS=4、重复间隔时间TR=1800 ms、回波个数 EchoCount=2000、采样频率SW=100 kHz。CPMG指数衰减曲线用仪器自带的MultiExp Inv Analysis 软件(上海纽迈电子科技有限公司)进行反演,得到弛豫时间分布情况。
1.2.3.3 NMR核磁共振成像 NMR成像采用多层自旋回波(multi-slice spin echo,MSE)序列来产生自旋回波图像。参数设置重复间隔时间TR=550 ms,回波间隔时间TE=20 ms。成像层厚为2 mm,图像分辨率为128 像素×256 像素。
1.4数据统计分析
采用SPSS 13.0对所测30个肉样的滴水损失率进行聚类分析,不同滴水损失组之间的差异采用ANOVA方差分析及Ducan检验(p<0.05),结果表示为平均数±标准差。
2 结果与分析
2.1聚类分析
根据滴水损失率的大小,将30个样品分为滴水损失率小于2.8%、大于5.5%以及3.0%~5.5%之间三组,即低滴水损失组(n=5),高滴水损失组(n=4)和中滴水损失组(n=21)。三组滴水损失率的变异范围分别是1.73%~2.72%,5.51%~6.53%和3.16%~4.98%。
2.2冷却猪肉的低场核磁共振检测
肉中水分存在的形式可分为三种,即结合水、不易流动水和自由水,三种水分的含量和存在状态会影响肉的品质和贮藏性。通过核磁共振原理可知,质子所处的化学环境不同,T2弛豫时间的长短也不相同,T2弛豫时间越短表明水与底物结合越紧密,水分自由度越低,T2弛豫时间越长表明水分与底物结合越松散,水分越自由[8]。NMR检测所得到的样品弛豫特性可以反映样品内部氢质子所处的物理化学属性。肌肉组织中1H核磁共振信号主要来自于水分子,核磁共振T2弛豫特性则能够反映肌肉中水分子动力学特征。因此T2弛豫时间可以间接反映水分的自由度,从而表征出猪肉中水分的存在状态。
图1显示的是冷却24 h肉样的NMR横向弛豫时间T2的反演图谱。从图1中可以看出,肉样在进行NMR反演后的弛豫图有3个峰,区间分别处于T21(1~10 ms)、T22(10~100 ms)和T23(100~1000 ms)。三个峰的分界明显,弛豫时间和峰面积也明显不同,这可以反映肉中水分存在的三种状态,T21为蛋白质分子表面的极性基团与水分子紧密结合的结合水,T22代表肌肉中存在于肌纤丝、肌原纤维及细胞膜之间的不易流动水,占肌肉中水分的绝大部分,T23表示存在于细胞外间隙中可自由流动的水,峰面积的差异代表不同状态水的比例。这与Bertram等人的检测结果完全相同[9]。也有其他学者通过LF-NMR在肉中检测出不同数量的组分[10-11],与本实验结果不一致的原因可能是肉样产生信号的不均匀可能会导致不同弛豫特性的质子群,或是肉中存在不同状态水之间的转换导致的[12]。
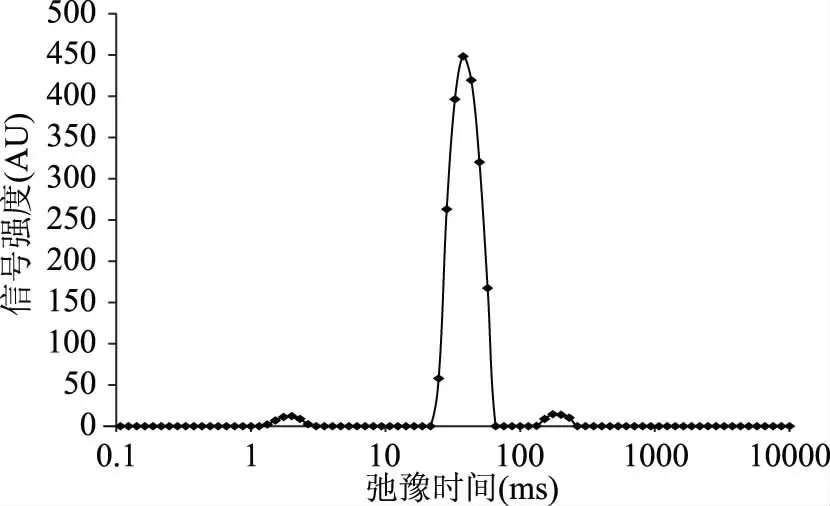
图1 冷却24 h后猪肉的NMR横向驰豫时间T2反演图
2.3不同保水性猪肉宰后成熟过程中T2弛豫特性
不同保水性猪肉成熟过程中T2弛豫时间的变化如图2所示。横向弛豫时间可以反应水分的自由度,T2分布的变化表征猪肉成熟过程中各状态水分的结合状态和自由移动程度。从图2中可以看出,T21峰弛豫时间相对较短,介于 2.127~2.541 ms之间,随着宰后成熟时间的延长,三组肉样的T21呈现一定的下降趋势,但各组肉样在整个宰后成熟过程中下降幅度均在0.4 ms以内,统计结果并无显著性差异(p>0.05),这表明宰后成熟作用对猪肉内部结合水自由度的影响并不大。宰后同一时间下不同保水性猪肉的T21无显著差异,表明T21代表的结合水对猪肉保水性的影响并不大。弛豫时间在 31.248~48.817 ms之间的T22峰波动比较明显,T22在宰后8 h内呈上升趋势,并在宰后8 h达到最高值,之后平缓下降。这一结果表明宰后前期存在于肌原纤维内部的不易流动水自由度增加,原因可能是宰后僵直使得肌纤维纵向收缩,肌细胞内渗透压增加致使细胞内部空间膨胀造成胞内水分子自由度增加。高保水性组的弛豫时间T22明显低于中、低保水性两组(p<0.05),说明高保水性猪肉内部不易流动水与底物结合得更加稳定。对于T23而言,其弛豫时间在167.086~275.782 ms之间,不同保水性猪肉的弛豫时间T23在宰后成熟过程中呈现先上升后下降的趋势,在宰后8 h达到最高值,这与Tornberg等人的研究结果一致[13]。

图2 不同保水性猪肉在成熟过程中T2弛豫时间的变化
2.4不同保水性组宰后肌肉的水分分布及迁移规律
核磁共振反演软件可自动算出谱图上每个峰的峰面积,与样品中氢质子的数量成正比,各个峰面积比例可以反映样品中不同状态水分的含量比例,峰面积比例变化情况可以表征各种状态水分群的分布状态和流动迁移情况。不同保水性组猪肉在宰后成熟过程中T2弛豫峰的面积百分比如图3所示,其中P21、P22、P23分别表示弛豫时间T21、T22、T23的弛豫峰面积百分比。从图3中可以看出,宰后同一时间下,高保水性组P21虽略有上升,但相互之间并无显著性差异(p>0.05)。三组肉样的P21均随着宰后成熟时间的延长呈现先降低后升高的趋势,但肉在宰后成熟过程中的P21并无显著性差异(p>0.05)。原因是肉在成熟过程中糖酵解产生的乳酸致使pH下降,当pH达到或接近蛋白质等电点时,蛋白质的净电荷为零,相互靠近使其与水的水合作用减弱,所以表征结合水的P21减少[14],尽管如此,结合水占肌肉总体水分比例不到10%,因此宰后成熟过程中结合水对保水性无太大影响。
P22代表的是肉样内部不易流动水的比例。图3显示不同保水性组的P22具有显著性差异(p<0.05),高保水性组猪肉P22明显高于低保水性组,这与Bertram等人[15]的研究结果完全一致。本实验中高保水性组宰后24 h的P22为93.81%,比低保水性组高出3.5个百分点。本研究发现P22随着宰后成熟时间的延长呈现先上升后下降的趋势,且在宰后8 h达到最高值,原因可能是宰后成熟早期肌肉无氧酵解使得肌细胞膜通透性增加引起了肌丝空间膨胀[16],使其吸水力增强,导致细胞内水分增加。随后不易流动水比例减小,原因是肌肉pH进一步降低使得肌原纤维网格结构收缩,钙蛋白酶降解肌动骨架蛋白和细胞膜之间的连接蛋白,形成汁液流失通道,致使肌原纤维之间的的不易流动水转移到肌原纤维外部,形成自由水[17]。
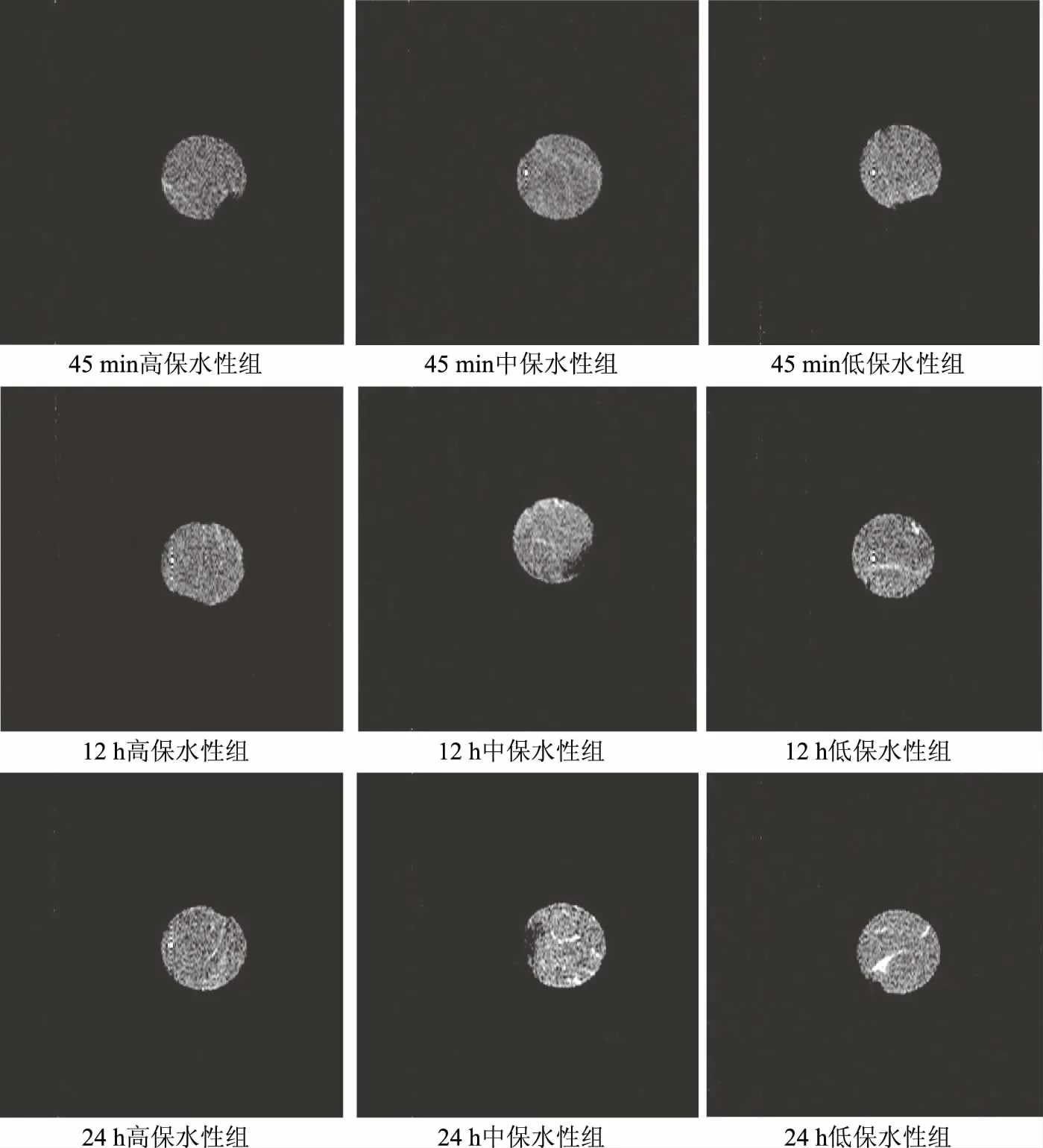
图4 不同保水性猪肉在成熟过程中的核磁成像图
自由水是肉中水分活度最大的水,宰后肉品的水分迁移是一个动态的过程,水分活度最大的自由水最先滴出,P23代表自由水的比例。因此,P23与冷却肉的保水性关系非常密切。图3可以看出,保水性越低的肉P23越高,低保水性组自由水比例P23显著高于高保水性组(p<0.05)。此外,P23随着宰后成熟时间的延长呈先下降后上升的趋势。本实验中P23在宰后8~12 h内降到最低值,随后又有一定程度增加。原因可能是宰后早期肌丝空间膨胀吸水使胞外自由水转化为胞内水,随后P23增加是因为随着成熟后期僵直的进行,肌节收缩变短,肌原纤维之间的水分被挤压到外部空隙中,不易流动水逐渐转化为自由水[18]。
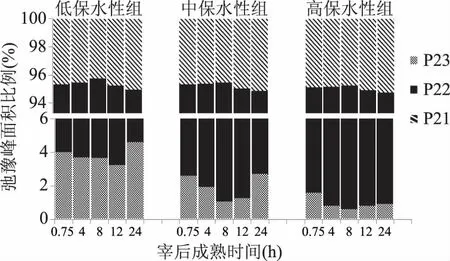
图3 不同保水性猪肉在宰后成熟过程中峰面积比例变化
2.5猪肉宰后成熟过程中的核磁成像分析
不同保水性猪肉宰后成熟过程中的核磁成像如图4所示。本实验采用的是质子密度加权成像,能得到肌肉内部的质子密度图,反映肉中氢质子的分布,通常氢质子越密集的区域,质子密度图谱越亮,表明该区域水分含量越高[19]。由图4可以看出,宰后同一时间下,保水性越低,肉样内部形成汁液流失通道,所以肉样成像图片的亮度越高。此外,肉在宰后成熟不同阶段,核磁成像亮度不同。宰后45 min时各组肉样的核磁成像亮度差异不明显,水分分布相对比较均匀,宰后12 h时的肉样核磁成像边缘亮度增高,肉样在宰后24 h的边缘和内部亮度进一步增加,低保水性组猪肉边缘及内部区域均呈现较大亮区,这可能是由于肌肉成熟后期水分迁移率增大形成汁液流失通道造成的,这一结果与该组T23峰面积比例增加的结果也是一致的。由此可以得出,核磁共振成像技术作为一种无损检测的新方法,可直观地反映肉品的保水性。
3 结论
利用低场核磁共振及成像技术测定横向弛豫时间,研究了不同保水性猪肉在成熟过程中的水分分布状态及迁移情况。结果表明,低场核磁共振技术能够很好地表征宰后成熟不同阶段下猪肉中不同形式水分的分布和迁移状况。根据T2弛豫谱的多组分特征和猪肉内部水分特性,将猪肉成熟过程中的水分划分为结合水、不易流动水和自由水三种水分状态,横向弛豫时间T21(2.127~2.541 ms)定义为结合水,T22(31.248~48.817 ms)为不易流动水,T23(167.086~275.782 ms)定义为自由水;肉在成熟过程中T21变化不大,T22和T23呈现先上升后下降的趋势,水分自由度先增加后下降;结合水比例P21在成熟过程中无显著性差异,不易流动水比例P22和自由水比例P23变化显著(p<0.05),呈相反趋势,肉成熟过程中保水性的变化就是不易流动水和自由水的相互转化迁移的结果;核磁共振成像技术可直观反映猪肉内部水分分布情况,能作为判断猪肉保水性的依据,为今后研究肉品水分提供了一种快速准确的检测方法,同时为屠宰行业动态监测肉品保水性提供理论依据。
[1]Moller S M,Gunvig A,Bertram H C. Effect of starter culture and fermentation temperature on water mobility and distribution in fermented sausages and correlation to microbial safety studied by nuclear magnetic resonance relaxometry[J]. Meat Science,2010,86(2):462-467.
[2]Pearce K L,Rosenvold K,Andersen H J,et al. Water distribution and mobility in meat during the conversion of muscle to meat and ageing and the impacts on fresh meat quality attributes-A review[J]. Meat Science,2011,89(2):111-124.
[3]杨赫鸿,李沛军,孔保华,等. 低场核磁共振技术在肉品科学研究中的应用[J]. 食品工业科技,2013,33(13):400-405.
[4]Maribo H,Olsen E V,Barton-Gade P,et al. Effect of early post mortem cooling on temperature,pH fall and meat quality in pigs[J]. Meat Science,1998,50(1):115-129.
[5]Honikel K O. Reference methods for the assessment of physical characteristics of meat[J]. Meat Science,1998,49(4):447-457.
[6]Brescia M A,Jambrenghi A C,di Martino V D,et al. High resolution nuclear magnetic resonance spectroscopy(NMR)studies on meat components:Potentialities and prospects[J]. Italian Journal of Animal Science,2002,1(2):151-158.
[7]Hinrichs R,Götz J,Noll M,et al. Characterisation of the water-holding capacity of fresh cheese samples by means of low resolution nuclear magnetic resonance[J]. Food Research International,2004,37(7):667-676.
[8]姜晓文,韩剑众.生鲜猪肉持水性的核磁共振研究[J].食品工业科技,2009,47(7):128-130.
[9]Bertram H C,Andersen H J,Karlsson A H. Comparative study of low-field NMR relaxation measurements and two traditional methods in the determination of water holding capacity of pork[J].Meat Science,2001,57(2):125-132.
[10]Micklander E,Bertram H C,Henrik M,et al. Early post-mortem discrimination of water-holding capacity in pig longissimus muscle using new ultrasound method[J]. LWT-Food Science and Technology,2005,38(5):437-445.
[11]韩敏义,费英,徐幸莲,等. 低场NMR研究pH对肌原纤维蛋白热诱导凝胶的影响[J]. 中国农业科学,2009,42(6):2098-2104.
[12]Borisova M A,Oreshkin E F. On the water conditions in pork meat[J]. Meat Science,1992,31(3):257-265.
[13]Tornberg E,Wahlgren M,Brøndum J,et al. Pre-rigor conditions in beef under varying temperature and pH falls studied with rigometer,NMR and NIR[J]. Food Chemistry,2000,69(4):407-418.
[14]Offer G. Modeling of the formation of pale,soft and exudative meat-effects of chilling regime and rate and extent of glycolysis. Meat Science,1991,30(2):157-184.
[15]Bertram H C,Engelsen S B,Busk H,et al. Water properties during cooking of pork studied by low-field NMR relaxation:Effects of curing and the RN-gene[J]. Meat Science,2004,66(2):437-446.
[16]李春,张录达,任发政,等. 利用低场核磁共振研究冷却条件对猪肉保水性的影响[J]. 农业工程学报,2012,28(23):243-249.
[17]Bertram H C,Dønstrup S,Karlsson A H,et al. Post mortem energy metabolism and pH development in porcine M. longissimus dorsi as affected by two different cooling regimes. A31P-NMR spectroscopic study[J]. Magnetic Resonance Imaging,2001,19(7):993-1000.
[18]Bertram H C,Karlsson A H,Andersen H J. The significance of cooling rate on water dynamics in porcine muscle from heterozygote carriers and non-carriers of the halothane gene-a low-field NMR relaxation study[J]. Meat Science,2003,65(4):1281-1291.
[19]陈珊珊,李然,俞捷,等. 永磁低场核磁共振分析仪原理和应用[J]. 生命科学仪器,2009,7(10):49-53.
Analysisofmoisturechangesofporkduringpostmortemagingbylow-fieldNMR
ZHENShao-bo1,LIUYi-ren2,GUOHui-yuan3,WANGHu-jun1,PANTeng3,RENFa-zheng3,*
(1.Higher Vocational and Technical College,China Institute of Industrial Relations,Beijing 100048,China;2.Beijing Centre for Physical and Chemical Analysis,Beijing 100094,China;3.Beijing Laboratory of Food Quality and Safety,College of Food Science and Nutritional Engineering,China Agricultural University,Beijing Higher Institution Engineering Research Center ofAnimal Product,Key Laboratory of Functional Dairy,Beijing 100083, China)
In order to investigate the moisture changes of pork with different water holding capacity during aging,a total of thirty Duroc×Large White×Landrace pigs were used in this study by using low-field nuclear magnetic resonance(LF-NMR),and transverse relaxation time and water propotion of different phase water were analysed. In the present investigation,three peaks were identified in pork during aging through the multi-exponential fitting of the bulk NMR T2transverse relaxation time data. The peaks were directly related to three water components T21(2.127~2.541 ms),T22(31.248~48.817 ms)and T23(167.086~275.782 ms). Compared with low WHC group,T22,T23and P23decreased significantly in high WHC group,while P22increased dramatically,T21and P21was not significantly different from the three groups. During postmortem aging,the general trend of T22and T23increased firstly and declining,and reached the highest value at 8 h postmortem,the water molecules mobility of immobilized water and free water had the same trend,while T21changed little. The proportion of free water P22increased initially and then decreased during aging,while the opposite trend was detected for the proportion of free water P23. The NMR images showed that the brightness of pork increased during aging. The results was of important significance to study the moisture changes of pork during postmortem aging,and it could provide theoretical basis for explain the mechanism of water holding capacity of meat.
nuclear magnetic resonance;moisture;transverse relaxation time;pork;aging;water holding capacity
2017-04-01
甄少波(1983-),男,博士,副教授,研究方向:食品加工,E-mail:zhenshaobo@139.com。
*
任发政(1962-),男,博士,教授,研究方向:畜产品加工,E-mail:renfazheng@263.net。
现代农业产业技术体系北京市生猪产业创新团队项目(BAIC02-2017)。
TS252.1
A
1002-0306(2017)22-0066-05
10.13386/j.issn1002-0306.2017.22.014
