缺氧诱导因子对滩羊肉宰后初期能量水平及肉色的影响
2022-09-30罗瑞明刘吉娟
姬 琛,杨 波,罗瑞明,,*,刘吉娟
(1.宁夏大学农学院,宁夏 银川 750021;2.宁夏大学生命科学学院,宁夏 银川 750021;3.宁夏大学食品与葡萄酒学院,宁夏 银川 750021)
滩羊是广泛分布于宁夏、甘肃、陕西等地的区域性家畜品种,具有重要的食用及经济价值。肌肉转化为肉的过程始于呼吸和血液循环的停止。当受到缺氧缺血信号刺激时,组织内部发生一系列复杂的生理生化反应,细胞/组织为了维持平衡,通过糖酵解产生三磷酸腺苷(adenosine triphosphate,ATP),从而调控肉品质形成过程。因此,研究宰后成熟过程中糖酵解的生化调控对于了解肉品质特性的发展至关重要。
缺氧诱导因子(hypoxia-inducible factor 1,HIF-1)是一种广泛存在于哺乳动物骨骼肌中的转录因子,由HIF-1α和HIF-1β亚基组成,在机体缺氧反应和适应中起主导作用,其活性主要取决于HIF-1α蛋白质的表达水平。正常条件下,由于HIF-1α迅速被降解无法合成HIF-1,而缺氧条件下,稳定的HIF-1α与HIF-1β结合,激活许多靶基因,进而维持机体的正常功能,如调节糖代谢。Sun Lianlian等的研究结果表明HIF-1α可将刺参代谢从氧化磷酸化转化为糖酵解,以应对病原体的挑战。Verma等的研究结果表明HIF-1通过调节靶基因葡萄糖转运子、乳酸脱氢酶等促进糖酵解。因此,HIF-1对于活体中糖酵解有重要的调控作用。
糖酵解是宰后成熟过程中重要的代谢过程,对肉的色泽、保水性、嫩度、质构和风味均有重要影响。本课题组前期研究中发现滩羊肉中磷酸丙糖异构酶(triosephosphate isomerase,TPI)在8 d的成熟过程中表达量先上升后下降,且与0 d比较,4 d其表达量上调近2 倍。Zhang Ying等研究发现HIF-1通过调节血管发育、血管生成的能量代谢、血管平滑肌收缩和各种缺氧相关信号通路调控藏鸡的缺氧适应性。然而,宰后肉品质形成过程中HIF-1是否同样具有重要作用,以及宰后HIF-1对糖酵解是否同样具有调节作用,目前鲜见相关研究报道。由于宰后肉品质形成同样由缺氧缺血信号调节启始,因此,本研究假设HIF-1在宰后成熟过程中对糖酵解关键酶、能量水平及肉品质有重要影响,故选取4 ℃成熟2、6、12、24、48 h的滩羊背最长肌为研究对象,测定不同成熟期HIF-1表达量的变化,确定其与能量水平、糖酵解关键酶TPI活力及肉色变化的关系,以期为宰后肉品品质形成提供新的思路及见解。
1 材料与方法
1.1 材料与试剂
滩羊背最长肌购于宁夏盐池县大夏牧场食品有限公司。选取9 只体质量相近的6 月龄公滩羊,屠宰前统一管理。屠宰后立即采集其右侧胴体的背最长肌,剔除可见脂肪与结缔组织后放置于保鲜袋中,于4 ℃、风速3 m/s、相对湿度85%条件下成熟。
羊HIF-1试剂盒、TPI、ATP、二磷酸腺苷(adenosine diphosphate,ADP)、单磷酸腺苷(adenosine monophosphate,AMP)试剂盒 上海科兴生物科技有限公司;多聚半乳糖醛酸酶、果胶甲基酯酶、磷酸盐缓冲液(phosphate buffered saline,PBS)、硫酸、醋酸钠、柠檬酸、HO、乙二胺四乙酸钠、甘油、四甲基联苯胺(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
DW3.0.1型超低温冰箱 无锡冠亚恒温制冷技术有限公司;352型酶标仪 芬兰Labsystems Multiskan MS公司;AC8型洗板机 芬兰雷勃公司;TG16W型离心机湖南湘仪实验室仪器开发有限公司;GNP-9080型恒温培养箱 上海昕仪仪器仪表有限公司;便携式数字pH计上海德图仪器国际贸易有限公司;CR-400型色差仪日本柯尼卡美能达公司;FA2104型电子天平 杭州万特衡器有限公司。
1.3 方法
1.3.1 样品采集
分别采集宰后于温度4 ℃、风速3 m/s、相对湿度85%条件下成熟2、6、12、24、48 h的滩羊背最长肌200 g,用于测定pH值与肉色;分别采集不同成熟时间样本5 g封装于灭菌冷冻管中,置于液氮中速冻后转移至-80 ℃冰箱备用,用于测定能量水平、TPI活力及HIF-1表达量。
1.3.2 pH值测定
使用便携式数字pH计测量肌肉pH值。使用前以pH 9.18、6.86和4.0的标准缓冲液校正pH计。
1.3.3 肉色测定
剔除可见脂肪与结缔组织后将样品修整为6 cm×6 cm×2 cm的块状,采用色差仪测定样品的*、*、*值。光源为D65,观察角度为10°,孔径为8 mm,测定前以白板校正色差仪。
1.3.4 HIF-1表达量、TPI活力及能量物质水平测定
根据相关酶联免疫吸附测定试剂盒操作说明书测定ATP、ADP、AMP水平及HIF-1表达量与TPI活力。
1.4 数据处理与分析
每个指标重复测定3 次,结果以平均值±标准差表示。采用SPSS软件对数据进行方差分析并进行邓肯多元方差检验后采用Origin软件绘图。<0.05为差异显著,<0.01为差异极显著。
2 结果与分析
2.1 滩羊肉宰后成熟初期pH值及肉色变化
由表1可知,滩羊肉宰后2~48 h pH值显著下降(<0.05),12~48 h内降幅较大。这一结果与陈炼红等对牦牛肉4 ℃成熟6~72 h内pH值变化规律的研究结果基本一致。宰后由于缺氧缺血,糖酵解作为细胞的主要能量来源,除产生ATP外还会生成丙酮酸及乳酸,且ATP水解产生的磷酸均会促使pH值下降;另外,有研究表明宰后蛋白质降解也会引起肌肉pH值下降。肉色是消费者判断鲜肉货架期的重要指标之一,是影响消费者购买行为的决定因素。宰后成熟期间肉色主要由肌红蛋白的氧化还原状态决定。宰后2~6 h内*值无显著变化(>0.05),6~48 h内*值显著上升(<0.05),*值表示亮度,能够反映肉色的稳定性,6~48 h内*值显著升高可能是随着宰后糖酵解的进行肌肉pH值逐渐下降,当pH值降至蛋白质等电点时,蛋白质对于不易流动水的吸附作用降低,导致贮存于肌肉结构中的不易流动水转化为自由水,当自由水附着于肌肉表面时会增强光的反射,致使*值升高。*值代表红度,是决定鲜肉色泽的关键参数,滩羊宰后2~6 h内*值无显著变化(>0.05),6~48 h内显著升高(<0.05),这一变化趋势与李兆亭等的研究结果一致,表明宰后48 h内随着成熟时间的延长,滩羊肉逐渐呈现樱桃红色,可能是由于宰后随着时间延长,较多的肌红蛋白与氧结合,形成红色的氧合肌红蛋白,致使*值升高。宰后48 h内*值逐渐升高,可能是氧合肌红蛋白被进一步氧化为褐色的高铁肌红蛋白,且该反应不可逆所致。

表1 滩羊肉宰后成熟初期肉色及pH值的变化Table 1 Changes in meat color and pH in Tan sheep meat at the early stage of postmortem aging
2.2 滩羊肉宰后成熟初期HIF-1表达量的变化
大量研究证实HIF-1是多种动物、组织及器官缺氧环境适应性的关键调控因子,如牦牛、藏鸡、秀丽隐杆线虫等,然而HIF-1在动物屠宰后对于代谢的调控作用仍缺乏研究。图1所示为宰后2~48 h内滩羊肉中HIF-1表达量变化,宰后2~24 h内HIF-1表达量呈显著升高的趋势(<0.05),并于24 h达到最大值,为2 h时的1.43 倍,与24 h相比,48 h时HIF-1表达量无显著变化(>0.05),但48 h HIF-1表达量仍显著高于2 h时HIF-1表达量(<0.05),为2 h时的1.40 倍。6 h时HIF-1表达水平上升至2 h时的1.25 倍,表明宰后由于呼吸与血液循环的停止,滩羊肌细胞立即处于缺氧状态,受缺氧信号的调控,迅速合成HIF-1复合体。HIF-1的转录主要受HIF-1α亚基调控,而HIF-1α是细胞对缺氧反应的重要元件,生理水平条件下由于细胞内氧含量充足,HIF-1α蛋白迅速通过von Hippel-Lindau蛋白因子途径降解;缺氧条件下,稳定的HIF-1α与HIF-1β形成HIF-1复合体,并与靶基因结合,促进一系列基因的表达,调控机体对缺氧条件的反应和适应。本研究中HIF-1表达量于宰后6 h内迅速升高可能是由于稳定的HIF-1α与HIF-1β形成了HIF-1复合体,导致短时间内HIF-1迅速积累,这说明HIF-1在宰后细胞/组织内的形成过程可能与其在活体中的形成过程类似,均受到缺氧信号的调节,该过程可能反映了动物宰后短期内细胞/组织对于缺氧缺血的调节机制。
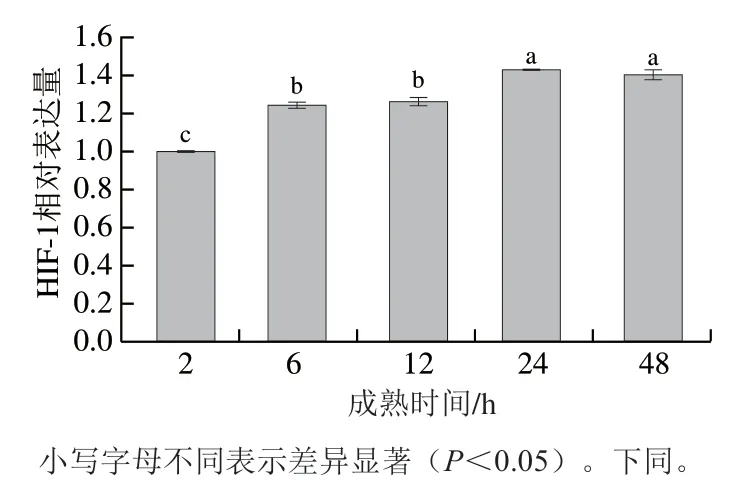
图1 滩羊肉宰后成熟初期HIF-1的表达量Fig. 1 Expression level of HIF-1 in Tan sheep meat at the early stage of postmortem aging
2.3 滩羊肉宰后成熟初期TPI活力的变化
TPI是糖酵解过程的关键酶,宰后成熟过程中少量有效能量的产生受糖酵解的调控。如图2所示,宰后TPI活力在6 h内显著升高(<0.05),并于6 h达到最大值,为2 h时的1.07 倍,48 h时显著降至2 h时的0.73 倍(<0.05),表明宰后6 h滩羊肌细胞中糖酵解可能已被激活。林珩迅等研究发现猪肉在4 ℃条件下成熟时,TPI活力先升高后降低,并于宰后6 h达到最大值,本研究结果与其一致。尤丽琴等研究发现滩羊背最长肌于4 ℃下成熟4 d时,糖原磷酸化酶、TPI、丙酮酸激酶、磷酸甘油酸异构酶、甘油醛-3-磷酸脱氢酶等糖酵解关键酶表达量均显著上调。Schoepflin等研究表明HIF-1形成后立即转移至细胞核并结合特定的序列。Kumar等认为生理水平条件下,HIF-1的靶基因通过介导红细胞生成或诱导血管生成从而增加氧气运输;或通过增加葡萄糖转运子和糖酵解酶表达,在低氧状态下改善组织功能。然而,动物屠宰后机体不能通过红细胞生成或血管生成增加氧气运输,只能通过调整糖代谢以适应缺氧条件,因此,本研究中TPI活力变化可能是由于动物屠宰后缺氧缺血促使6 h内HIF-1表达量迅速升高,HIF-1转移至细胞核后与靶基因结合,通过调节靶基因促进糖酵解,促使TPI活力升高,以上结果进一步说明HIF-1在宰后成熟过程中对糖酵解的调控作用可能与其在活体中类似。
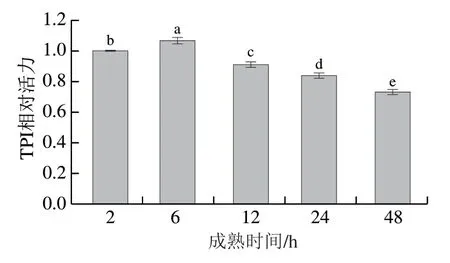
图2 滩羊肉宰后成熟初期TPI活力变化Fig. 2 Activity of TPI in Tan sheep meat at the early stage of postmortem aging
2.4 滩羊肉宰后成熟初期能量水平的变化
表2所示为滩羊肉宰后成熟初期能量物质的变化趋势。ATP是生物体内能量的直接来源,通过水解为机体供能,也是宰后成熟过程中发生各种生理生化反应的必要条件。宰后成熟过程中,由于缺氧缺血,组织不能通过有氧呼吸产生能量,此时,磷酸肌酸在肌酸激酶的催化下将ADP磷酸化为ATP,然而这种转化只能在短时间内维持ATP的产生;因此,宰后短时间内糖酵解被激活并产生能量。由表2可知,宰后2~48 h内ATP水平显著降低(<0.05),12 h后ATP水平降幅较大,宰后48 h ATP水平降至成熟初期的最低值,表明宰后初期细胞内的生理活动消耗了有限的ATP,同时,由于组织内一系列酶促反应,ATP被依次降解为ADP、AMP,导致ATP水平显著降低。孙志昶研究发现牦牛背最长肌宰后成熟2~48 h内ATP含量显著下降,本研究结果与其一致。Tassy等发现宰后缺氧和糖酵解的加速造成细胞内ATP含量快速减少。宰后成熟初期滩羊肉中ADP水平呈显著下降趋势(<0.05),2~6 h内ADP水平降幅较大,AMP水平整体呈下降趋势。罗辉等对秦川牛宰后4 ℃贮藏过程中能量物质变化趋势的研究表明ATP、ADP、AMP含量均呈下降趋势。贾青等研究发现牦牛背最长肌贮藏120 h内,ATP、ADP、AMP含量均呈显著下降趋势,本研究结果与以上研究结果一致。ATP、ADP、AMP水平均下降可能是由于细胞/组织在缺氧、缺血条件下所生成的ATP水平大幅降低,受ATP水平降低的影响,ADP、AMP水平也随之降低。高永芳等研究表明,4 ℃贮藏72 h后未处理的牛背最长肌中ATP含量显著降低,贮藏24~72 h内ADP含量升高,AMP含量于12~24 h内升高,本研究结果与其不一致,可能是物种之间存在差异所致。

表2 滩羊肉宰后成熟初期ATP、ADP和AMP水平的变化Table 2 Changes in the contents of ATP, ADP and AMP in Tan sheep meat at the early stage of postmortem aging
2.5 滩羊肉宰后成熟初期HIF-1表达量与能量水平、TPI活力、pH值及肉色的关系
由表3可知,宰后成熟2~48 h内滩羊肉HIF-1表达量与TPI活力、能量物质水平、肉色及pH值均显著相关(<0.05、<0.01)。其中,HIF-1表达量与ATP及ADP水平呈极显著负相关(<0.01),与AMP水平呈显著负相关(<0.05),与TPI活力及pH值呈极显著负相关(<0.01),与肉色指标*值及*值呈极显著正相关(<0.01),与*值呈显著正相关(<0.05)。此外,ATP水平与pH值呈极显著正相关(<0.01),与*、*值及*值均呈极显著负相关(<0.01);ADP水平与TPI活力及pH值极显著正相关(<0.01),与*、*值极显著负相关(<0.01),与*值显著负相关(<0.05);AMP水平与pH值极显著正相关(<0.01),与*值极显著负相关(<0.01),与*值显著负相关(<0.05),与*值没有显著相关性(>0.05);TPI活力与pH值呈极显著正相关(<0.01),与*、*值及*值均呈极显著负相关(<0.01);pH值与*、*值及*值均呈极显著负相关(<0.01)。刘秋凤等研究发现宰后24 h北京黑猪pH值与*值呈极显著负相关,本研究结果与其一致。

表3 宰后成熟初期HIF-1表达量与TPI活力、ATP、ADP和AMP水平、肉色及pH值的相关性分析Table 3 Correlations between the expression level of HIF-1 and TPI activity, ATP, ADP and AMP contents, meat color and pH
相关性分析结果表明HIF-1表达量对宰后糖酵解关键酶活力、能量物质水平、肌肉pH值及肉色有显著影响。研究表明,HIF-1是机体适应缺氧环境最重要的因子,HIF-1复合体形成后立即转移至细胞核,并与靶基因结合,促进一系列基因的表达,通过级联调控下游靶基因直接影响机体对低氧环境的反应及适应。本研究结果表明,滩羊肉宰后成熟初期HIF-1表达量迅速升高,HIF-1复合体形成后可能转移至细胞核与糖酵解基因结合,促进糖酵解相关基因表达,促使糖酵解增强,提高了糖酵解酶TPI活力,致使TPI活力于6 h内显著升高;活化的糖酵解酶将糖原转化为乳酸导致乳酸积累,同时伴有丙酮酸的生成,ATP水解生成磷酸,致使肌肉pH值降低;此外,由于宰后糖酵解是组织唯一的供能来源,随着组织内生理生化反应的进行,ATP迅速被消耗,且伴随着水解反应的发生,能量物质水平下降。因此,HIF-1可能通过促进糖酵解间接影响了能量物质水平及肌肉pH值下降的速度与程度。此外,有研究表明,糖酵解关键酶乳酸脱氢酶活力越高,肉色越稳定。糖酵解决定宰后成熟过程中肌肉pH值下降的速度及程度,而肌肉pH值是影响宰后成熟过程中肉色形成的重要指标。张杏亚等研究发现8 d成熟期内,与秦川牛肌红蛋白衍生态相关的酶中糖酵解关键酶烯醇化酶、甘油醛-3-磷酸脱氢酶、乳酸脱氢酶均在成熟期内差异表达。辛建增研究表明糖酵解关键酶甘油醛-3-磷酸脱氢酶催化甘油醛-3-磷酸生成烟酰胺腺嘌呤二核苷酸,可还原高铁肌红蛋白,进而抑制高铁肌红蛋白的累积,提高肉色稳定性。综上,HIF-1可能是引起宰后能量代谢方式转变为糖酵解的关键因素,对于宰后肉品品质形成具有重要的调控作用。
3 结 论
宰后2~24 h内HIF-1表达量迅速升至最高值,24 h后有所下降,TPI活力于宰后6 h时升至最高值,随后逐渐降低,宰后48 h内能量物质ATP、ADP、AMP水平均随成熟时间延长逐渐降低,pH值宰后48 h内显著降低(<0.05),*、*值及*值均随成熟时间延长显著升高(<0.05)。宰后成熟2~48 h内滩羊肉HIF-1表达量与TPI活力、能量物质水平、肉色及pH值均显著相关(<0.05、<0.01),可能是由于受宰后缺氧信号诱导,HIF-1表达量于6 h内迅速升高,HIF-1复合体转移至细胞核与糖酵解基因结合,促进糖酵解相关基因表达,促使糖酵解途径增强,提高了糖酵解相关酶活力,并降低肌肉pH值。HIF-1可能通过调控宰后糖酵解及肌肉pH值影响肉色。本研究结论有助于理解宰后成熟过程中肉品质形成的复杂机理。
