茶叶籽酵母的分离鉴定及其发酵特性研究
2017-12-06,,,,
,,,,
(1.贵州师范学院,贵州贵阳 550018;2.贵州元亨山茶叶籽生物科技有限公司,贵州贵阳 550018;3.河南科技学院园艺园林学院,河南新乡 453003;4.金华市农业科学研究院,浙江金华 321017)
茶叶籽酵母的分离鉴定及其发酵特性研究
姜金仲1,2,杨鹏鸣3,王兴春2,穆安德2,郑寨生4
(1.贵州师范学院,贵州贵阳 550018;2.贵州元亨山茶叶籽生物科技有限公司,贵州贵阳 550018;3.河南科技学院园艺园林学院,河南新乡 453003;4.金华市农业科学研究院,浙江金华 321017)
为了阐明酵母菌在茶叶籽水浆发酵分层过程中的作用,从发酵5 h的发酵液分离、纯化出一株酵母菌(编号:JJZ11)。通过形态观察、ITS rDNA及26S rDNA基因测序与比对,以及系统发育树的构建与分析,确定JJZ11为Meyerozymacaribbica的一个菌株,命名为茶叶籽酵母(MeyerozymacaribbicaJJZ11),菌种保藏号为CCTCC M 2016470。在茶叶籽水浆发酵过程中:茶叶籽水浆发酵液中茶叶籽酵母数量随发酵时间延长逐渐减少,进行到10 h时,降低为零;发酵液pH随时间的延长由开始时的6.2逐渐降低,10 h时为3.73。当培养基pH小于4.3时,茶叶籽酵母的菌落数量均为零。茶叶籽水浆发酵分层过程与茶叶籽酵母的数量变化具有同步性,所以,茶叶籽酵母是引起茶叶籽水浆发酵分层的主要微生物之一。
茶叶籽酵母,MeyerozymacaribbicaJJZ11,茶叶籽水浆,发酵分层,茶叶籽
茶叶籽油是以茶叶树(Camelliasinensis)的种子为原料生产的食用油,因其富含多种生物活性成分而被誉为东方橄榄油[1-2]。我国有茶园面积约120万公顷,按每公顷产茶叶籽37.5 kg计算,年产茶籽约4.5亿千克;利用这些茶叶籽可以生产茶叶籽油45000 t、茶叶籽淀粉27000 t。但是,由于传统茶叶籽油生产工艺还存在产率低、产品单一、茶叶籽组成成分相互污染以及毛油味道“戟喉”苦等问题,这些茶叶籽资源目前仅有不到百分之十得到了利用,其余大部分被自然腐烂在茶园里。为了解决茶叶籽油传统生产工艺存在的问题,姜金仲报道了一种茶叶籽油生产新工艺-茶叶籽油生物发酵生产工艺[3-4],该工艺的核心是“茶叶籽水浆发酵分层现象”,即通过生物发酵将茶叶籽水浆分为三层,然后取出上层加热生产茶叶籽油;该工艺的最大优点是在生产茶叶籽油的过程中有效避免了茶叶籽其他构成成分对茶叶籽油的污染,同时又能生产茶叶籽淀粉,提高了茶叶籽油的产率及茶叶籽资源利用率[4]。既然发酵分层是由发酵引起的,发酵液中就必然存在发酵微生物。因此,本文对发酵液中的一种微生物(茶叶籽酵母)进行了分离鉴定,并对其发酵特性进行了研究,以期为茶叶籽酵母的进一步利用奠定理论基础。
1 材料与方法
1.1材料与仪器
茶叶籽仁 土炕烘干带内种皮茶叶籽仁,种子主要采摘自湖北省随州市广水市福建大白茶品种,茶叶籽仁含水率8.4%、含油率(索氏抽提法)26.2%;MRS固体培养基 按照文献[5]方法配制;石油醚 德州润昕实验仪器有限公司;蛋白胨 安琪酵母有限公司;牛肉膏 德州润昕实验仪器有限公司;酵母膏 广州市昕迪实验器材有限公司;K2HPO4佛山市顺德区魏玛化工有限公司;NaOAc 北京迪马欧泰科技发展中心;琼脂 安琪酵母股份有限公司。
XSP-9CA光学显微镜 上海光学仪器一厂;PHSJ-4A pH计 西安禾普生物科技有限公司;GL124-1SCN电子天平 季尔国际贸易(上海)有限公司;TG16-WS高速离心机 济南来宝医疗器械有限公司;ET-7打浆机 湖北武汉宏旭机械设备责任有限公司。
1.2实验方法
1.2.1 茶叶籽水浆发酵液的制备 称取茶叶籽仁100 g,加清水300 g于35 ℃条件下浸泡16 h,将浸泡好的茶叶籽清洗后加水300 g进行2轮打浆、过滤得滤液(茶叶籽水浆),将滤液置于35 ℃恒温发酵,约5 h左右,滤液开始明显分为上、中、下三层,备用。
1.2.2 酵母的分离纯化 在茶叶籽水浆发酵进行到5 h时,从发酵液中层取样,在固体培养基上进行划线培养,培养温度25 ℃;长出菌落后,挑选独立的菌落,用接种针挑取样本放在载玻片上,用美蓝染色[6],观察是否是类似酵母菌的细胞,如果是类似酵母菌的细胞,接种扩大繁殖该菌落,再进行鉴定繁殖,反复4次,得到一株类似酵母的细胞纯种,编号为JJZ11。
1.2.3 JJZ11菌株的鉴定 按照鉴定手册[7]中的方法对JJZ11菌株进行形态学观察及鉴定。包括:菌落形态及细胞形态的观察;繁殖特性及假菌丝的观察等;显微镜60倍镜下观察拍照。
ITS rDNA及26S rDNA序列测定、分析及系统发育树的构建[8]:ITS rDNA及26S rDNA的序列测定、分析及系统发育树绘制由中国食品发酵工业研究院微生物检测中心完成;测序结果利用GenBank数据库进行Blast同源序列检索,然后采用MEGA5.0软件进行同源性分析,1000次相似度重复计算,构建以置信度为依据的系统发育树。
1.2.4 发酵液茶叶籽酵母数量镜检测定 按照1.2.1的方法制取发酵液,从茶叶籽水浆放入水浴锅内开始,每隔1 h从发酵分层的中层液中取5 mL样液放于试管中,在80 ℃下水浴加热5 min后,用胶头滴管取一滴于载玻片中央,用美蓝染色[6],盖上盖玻片,在显微镜60倍镜下观察,取分别位于盖玻片四角及中央的5个视野观察,并记录视野下的似酵母菌细胞数量。
1.2.5 茶叶籽水浆发酵液pH的测定 从发酵开始,每隔1 h取出发酵液50 mL,过滤,4000 r/min离心10 min,用pH计测定pH。
1.2.6 培养基pH对茶叶籽酵母生长的影响 以MRS固体培养基为基础,用稀酸及稀碱调节pH,使培养基pH分别为4.3、5.3、6.3、7.3及8.3。然后灭菌、常规涂布法接种,恒温箱中25 ℃进行培养,每3 h观察一次生长现象及培养皿中的菌落数。
1.3数据处理
实验数据用SSPS 17.0及Excel处理。
2 结果与分析
2.1JJZ11菌株的菌落及个体形态
JJZ11菌株28 ℃培养7 d的菌落如图1所示,由图1可以看出:JJZ11菌株的菌落呈奶油状,乳白色,表面平伏,光滑反光。茶叶籽酵母28 ℃培养72 h的个体形态如图2所示,细胞近球形、椭圆形或棒状,大小1.3~2.0 μm×2.0~5.5 μm,有假菌丝,出芽繁殖。
图1 JJZ11菌株的菌落

图2 JJZ11菌株细胞及出芽

图3 JJZ11的系统发育树
2.2JJZ11菌株系统发育树的建立与分析
JJZ11菌株的ITS rDNA序列全长为516 bp,26S rDNA序列全长为533 bp。利用Blast进行序列同源检索,与Meyerozymacaribbica的相似度为100%。以ITS rDNA及26S rDNA的同源性为基础,用MEGA 5.0软件进行系统进化分析,得到系统发育树如图3。系统发育学分析结果表明,该系统树中MeyerozymacaribbicaCBS9966T(FUNCBS/AY187283)是一个单独的外群种,JJZ11菌株与该种单独构成一个分支;二者序列的相似性最大,遗传距离最小,JJZ11菌株与该种的亲缘关系最近;因此,中国食品发酵工业研究院微生物检测中心将JJZ11菌株鉴定为:Meyerozymacaribbica的一个菌株,将该菌株命名为茶叶籽酵母(MeyerozymacaribbicaJJZ11)。菌种已于2016年9月9日保藏在中国典型培养物保藏中心(CCTCC),保藏号为CCTCC M 2016470。
2.3茶叶籽酵母细胞在茶叶籽水浆发酵过程中的数量动态
为了确定茶叶籽酵母(MeyerozymacaribbicaJJZ9911)在茶叶籽水浆发酵中的作用,测定了茶叶籽水浆发酵过程中不同时段发酵液中茶叶籽酵母细胞的数量,检测结果见图4。由图4可以看出,茶叶籽酵母细胞的数量随着发酵时间的延长呈现整体下降趋势,发酵进行到10 h时,茶叶籽酵母细胞的数量已经降为零。这说明发酵开始时茶叶籽酵母细胞的数量最多,随着发酵时间的延长,中层液茶叶籽酵母的数量会逐渐减少。其可能的原因是:随着发酵时间的延长,发酵液已逐渐不适合茶叶籽酵母的生长;到10 h时,发酵液已完全不适合茶叶籽酵母的生长。
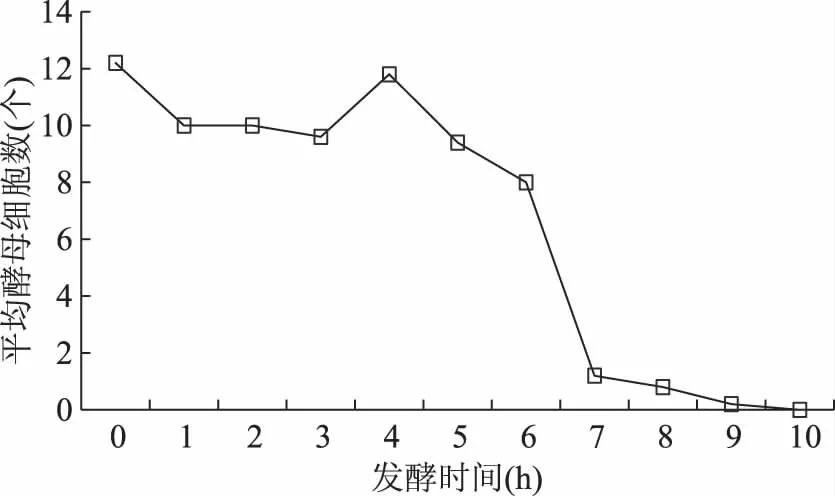
图4 发酵液中茶叶籽酵母细胞数量的动态
由图4还可以看出,虽然发酵5 h以前,茶叶籽酵母细胞的数量有所减少,但减少幅度较小,最低点比最高点只降低了21.3%;但是,5 h之后降低幅度迅速增大,直至细胞数量为零。
2.4茶叶籽水浆发酵液的pH变化趋势
由2.3可知,茶叶籽水浆发酵进行到10 h时,在茶叶籽水浆发酵中层液内已不存在茶叶籽酵母。为了解释这种现象发生的原因,对茶叶籽水浆发酵液的pH进行了跟踪测定,结果如图5。发酵液pH随时间的延长由开始时的6.2逐渐降低,10 h时为3.73,到13 h时达到最低点3.39,以后又呈现出小幅度振荡走高趋势。
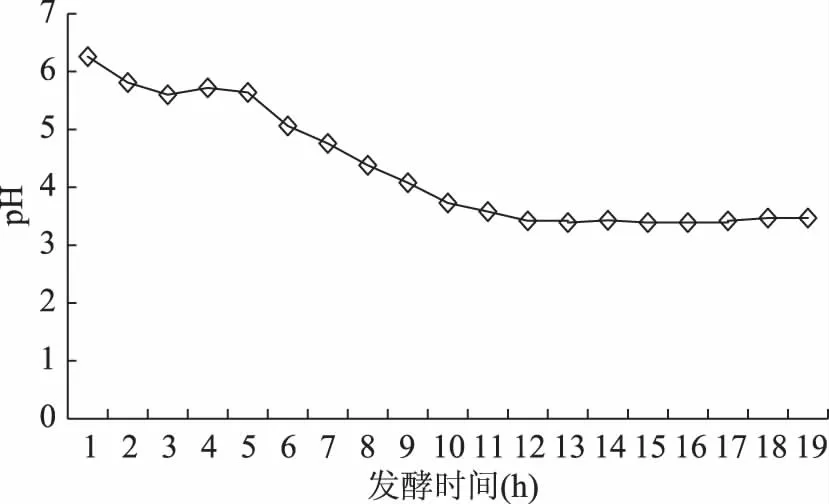
图5 发酵液pH随发酵时间的变化
2.5培养基pH对茶叶籽酵母生长的影响
由上述茶叶籽水浆发酵液pH变化趋势可以看出,茶叶籽水浆发酵液中茶叶籽酵母的数量与发酵液的pH变化趋势有一定的对应关系,为了验证发酵液pH变化是否为影响茶叶籽水浆发酵液中茶叶籽酵母数量的因素,对茶叶籽酵母进行了培养基模拟培养实验,结果如图6。由图6可以看出,在给出的5个培养观测时间点(36、39、42、45、48 h)数量变化曲线中,当培养基pH为4.3时,培养基上的酵母菌落数量均为零,这说明在培养基pH等于4.3时,茶叶籽酵母已不能正常生长。

图6 不同培养基pH条件下菌落数的变化
3 讨论
3.1关于茶叶籽酵母的鉴定
茶叶籽酵母为Meyerozymacaribbica酵母的一个菌株,具有茶叶籽水浆发酵分层作用,目前未见国内有关Meyerozymacaribbica的研究报道。国外最早报道Meyerozymacaribbica是Kurtzman CP等[9]。Meyerozymacaribbica虽然有自己的属名及种名,但它却是发酵假丝酵母(Candida fermentati)的无性型,所以,又称为无性型发酵假丝酵母(anamorph Candida fermentati)[10],可见它的有性菌株属于另外一个属。Kim[11]报道过Meyerozymacaribbica的一个菌株:MeyerozymacaribbicaMG20W,认为MG20W的基因组(complete genome sequence)与MeyerozymaguilliermondiiATCC 6260T的亲缘关系最近,且该菌株具有嗜盐的特性;而茶叶籽酵母却与MeyerozymacaribbicaCBS9966T(FUNCBS/AY187283)的亲缘关系最近;这说明利用全基因组序列(complete genome sequence)进行亲缘关系比对时,其比对结果与ITS rDNA及26S rDNA的比对结果有所差异。
茶叶籽水浆含有大量的茶皂素,茶皂素对多种酵母菌具有显著的抑制作用[12],但作为酵母的MeyerozymacaribbicaJJZ11菌株却能在茶叶籽水浆发酵过程中繁殖生长,结合Kim[11]报道的MG20W嗜盐特性,说明Meyerozymacaribbica酵母具有适应不同生长环境的能力,因而具有广阔的开发利用潜力。
3.2茶叶籽水浆发酵液中茶叶籽酵母菌数量变化与茶叶籽水浆发酵分层的关系
茶叶籽水浆发酵分层现象是“茶叶籽油生物发酵生产工艺”的核心,该现象的具体发生过程为:茶叶籽水桨发酵液开始时上下是浑然一体的,呈乳白色,随着发酵时间的延长,发酵液分层逐渐由模糊变为清晰,发酵进行到4.5 h左右,发酵液明显分为3层,乳白色顶层、淡棕色中层及灰白色底层[13]。由图4可知,从发酵开始到发酵5 h这段时间,发酵液中茶叶籽酵母的数量是最多的阶段,由图5可知,这段时间也处在整个发酵液pH逐渐降低的时段;酵母菌有氧代谢过程的主要产物为丙酮酸[14]和二氧化碳,从而导致发酵物pH降低;因此,可以判断主要是茶叶籽酵母的发酵作用导致了茶叶籽水浆发酵液pH在这段时间的降低;发酵液的pH降低破坏了茶叶籽水浆胶体的平衡状态,导致茶叶籽水浆胶体内比较轻的悬浮物上浮而分层。
综合以上分析,可以初步认为,茶叶籽酵母是引起茶叶籽水浆早期发酵并导致发酵液分层的主要微生物之一。
3.3茶叶籽酵母数量的变化与茶叶籽水浆发酵液pH之间的关系
由图4可知,茶叶籽水浆发酵液中茶叶籽酵母数量随发酵时间延长逐渐减少,进行到10 h时,降低为零;由图5可知,发酵液pH随时间的延长由开始时的6.2逐渐降低,10 h时为3.73;由图6可知,当培养基pH为4.3时,培养基上的酵母菌落数量均为零。
综合分析上述结果可以看出,茶叶籽水浆开始时pH较高,比较适合茶叶籽酵母的生长,随着发酵液时间延长及发酵液pH的逐渐降低,茶叶籽酵母的适生条件逐渐变差,到10 h时发酵液pH(3.73)已远低于培养基模拟培养的最低pH,茶叶籽酵母失去了适宜的生存条件,所以,发酵进行到10 h时在发酵液中已找不到茶叶籽酵母。李剑芳等[15]指出,葡萄酒产香酵母E-45,最适生长pH为5.4,最低和最高分别为1.6和9.5;于洋等[16]指出,发酵毕赤酵母YF-19的适宜pH为2.95;由此可见,酵母的pH适应范围是很广的,茶叶籽酵母的适宜pH及极端不适宜pH是在这些资料范围内的。
4 结论
JJZ11菌株是从茶叶籽水浆发酵液中分离出的酵母菌株,通过分离提纯、形态观察、ITS rDNA及26S rDNA基因测序与比对,以及系统发育树的构建与分析,确定JJZ11菌株为Meyerozymacaribbica酵母的一个菌株;并将该菌株初步命名为:茶叶籽酵母(MeyerozymacaribbicaJJZ11);菌种保藏号为CCTCC M 2016470。
在茶叶籽水浆发酵过程中:茶叶籽水浆发酵液中茶叶籽酵母数量随发酵时间延长逐渐减少,进行到10 h时,降低为零;发酵液pH随时间的延长由开始时的6.2逐渐降低,10 h时为3.73。用培养基培养茶叶籽酵母,当培养基pH小于4.3时,无论培养时间长短,茶叶籽酵母的菌落数量均为零。
发酵液中茶叶籽酵母细胞的数量5 h之前居最高位,5 h之后迅速下降,到10 h时降低到零,而茶叶籽水浆发酵分层现象恰好发生在5~7 h之前[13],所以,茶叶籽酵母是引起茶叶籽水浆发酵分层的主要微生物之一。
[1]梁杏秋,王晓琴,黄兵兵. 茶叶籽油组成分析及其抗氧化机理研究进展[J]. 中国粮油学报,2013,28(11):131-134.
[2]孙达,凌益春,王岳飞,等.茶叶籽油的加工工艺及其保健功效研究进展[J]. 茶叶,2010,36(3):144-147.
[3]Jinzhong JIANG,Cuijuan REN,Zibu WANG. New Process for Extracting Oil and Starch from Tea Seed[J]. Journal of Food Science and Engineering,2013,3(12):699-703.
[4]姜金仲,王超英,韩晗,等. 茶叶籽仁水浆静置发酵分层生产茶叶籽油及淀粉[J].中国油脂,2015,40(3):74-78.
[5]张颖,张萍. 用改良MRS培养基检测啤酒中乳酸菌的方法[J]. 安徽大学学报(自然科学版),1999,23(4):104-106.
[6]孔祥诚,陈江,李晓聪,等. 美兰染色法检测酵母活性的优化实验[J]. 啤酒科技,2006(12):50-52.
[7]巴尼特. 酵母菌的特征与鉴定手册[M]. 青岛:青岛海洋大学出版社,1991.
[8]宋亚娜,陈瑞庆,周莉娟,等. 福建橄榄18S-26S rRNA及其ITS片段的克隆与序列分析[J]. 亚热带植物科学,2007,36(4):5-9.
[9]Kurtzman C P,Suzuki M. Phylogenetic analysis of ascomycete yeasts that form coenzyme Q~9 and the proposal of the new generaBabjeviella,Meyerozyma,Millerozyma,PriceomycesandScheffersomyces[J]. Mycoscience,2010,51(1):2-14.
[10]Wahengbam Romi,Santosh Keisam,Giasuddin Ahmed. Reliable differentiation ofMeyerozymaguilliermondiifromMeyerozymacaribbicaby internal transcribed spacer restriction fingerprinting[J].BMC Microbiology,2014(14):52-62.
[11]Kim J S,Baek J H,Park N H,et al. Complete genome sequence of halophilic yeastMeyerozymacaribbicaMG20W isolated from rhizosphere soil[J]. Genome Announce,2015,3(2):e0012715.
[12]江和源,张建勇,高晴晴. 茶皂素的性质、制备与应用[J].中国茶叶,2007(3):14-15.
[13]姜金仲,杨鹏鸣,王超英,等. 茶叶籽水浆发酵分层过程及其间总质量动态研究[J].中国粮油学报,2017,32(2):104-108.
[14]毛青钟. 论黄酒发酵过程酵母和乳酸杆菌协同作用关系[J]. 山东食品发酵,2006(1):29-31.
[15]李剑芳,张灏. 发酵弥猴桃汁中产香酵母的分离鉴定及生长特性的研究[J],食品科学,2001,22(9):19-22.
[16]于洋,粟春燕,陈晶瑜. 3株葡萄酒非酿酒酵母的生长与发酵特性[J]. 食品科学,2015,36(19):106-110.
Studiesonidentificationandfermentationcharacteristicsofteaseedyeast
JIANGJin-zhong1,2,YANGPeng-ming3,WANGXing-chun2,MUAn-de2,ZHENGZhai-sheng4
(1.Guizhou Education University,Guiyang 550018,China;2.Guizhou Yuanheng Mountain Tea Seed Biological Technology Co.,Ltd.,Guiyang 550018,China;3.School of Horticulture Landscape Architecture,Henan Institute of Science and Technology,Xinxiang 453003,China;4.Jinhua Agricultural Science Institute,Jinhua 321017,China)
To illuminate function of yeast on the fermentation-layering of tea-seed-water-milk(TSWM),a strain of yeast(NO. JJZ9911)was isolated and purified from 5 h-fermented TSWM. By mean of morphological observation,ITS rDNA and(26S rDNA gene sequencing and comparison,and building and analysis of a phylogenetic tree,it was determined that JJZ9911 was one strain ofMeyerozymacaribbica. Therefore the strain was named as tea seed yeast(MeyerozymacaribbicaJJZ11),and its preservation number was CCTCC M 2016470. In the fermentation-layering process of TSWM,the number of tea seed yeast in fermented liquid gradually reduced with the extension of fermentation time and reduced to zero when fermentation reached to 10 h.The pH of fermented liquor gradually reduced from 6.2 to 3.73 till fermentation reached to 10 h. The number of tea seed yeast colony was zero while the medium pH was less than 4.3.The fermentation-layering process of TSWM was synchronic with the number change of tea seed yeast,therefore,the tea seed yeast was one of the main microbial that caused fermentation-layering of TSWM.
tea seed yeast;MeyerozymacaribbicaJJZ11;tea seed water milk;fermentation-layering;tea seed
2017-02-07
姜金仲(1958-),男,博士,教授,主要从事茶叶籽综合开发利用方面的研究,E-mail:jjz9911@163.com。
国家自然科学基金项目(31460405);贵州省科技计划项目(黔科合成果[2017]4127)。
TS222
A
1002-0306(2017)22-0105-05
10.13386/j.issn1002-0306.2017.22.021
